混合菌种和盐含量对发酵鲢鱼肉品质的影响研究
石建喜, 许艳顺, 姜启兴, 卢素芳, 夏文水
(1.江南大学 食品学院,江苏 无锡 214122;2.武汉市水产科学研究所,湖北 武汉 430207)
我国是渔业大国,2014年水产品总产量6 172.00万t,其中养殖淡水鱼类总产量2 481.73万t,但是我国淡水鱼加工比例仍较低,不足15%,严重制约了我国淡水渔业的发展。鲢鱼作为产量仅次于草鱼的淡水鱼类,肉质鲜嫩,营养丰富,但由于其肉薄刺多、土腥味较重的问题,导致鲢鱼的消费量受到极大限制。腌制发酵是一种水产品传统保藏加工技术,腌制发酵过程中,产品的理化特性、微生物群以及感官特性发生变化,最终引起产品风味、质构、色泽以及其他品质特征的改善,以更好地满足消费者需求。但由于传统发酵都是利用自然界的微生物在适宜的温湿条件下发酵而成,发酵过程难以控制[1]。
近年来,利用现代微生物接种技术提升传统发酵鱼制品品质已引起广泛关注,将自传统发酵制品分离的菌种接种到产品中,能够缩短产品的生产周期和提高安全性。微生物发酵菌种以及发酵工艺条件对最终产品风味和食用品质有着重要影响。本研究室前期以鲢鱼为原料,采用单一和混合发酵剂对淡水鱼糜进行发酵,得到了具有独特风味、高凝胶强度的发酵鱼糜制品[2-6];Adams等人[7]研究了乳酸菌发酵鱼糜的影响因素,发现随含盐量增加pH降低速率减缓;现有研究主要针对发酵菌种筛选、鱼糜发酵过程中品质变化方面,对微生物接种发酵、盐含量对发酵鱼块品质以及风味的影响还鲜有报道。
因此,本研究选用从传统发酵鱼制品中筛选出的植物乳杆菌120、酿酒酵母152、木糖葡萄球菌135作为混合发酵剂在20℃条件下发酵鲢鱼块,比较分析两种盐浓度条件下鱼肉理化、微生物及风味品质变化,为利用现代微生物发酵技术提升传统腌制鱼制品风味品质和安全性提供指导。
1 材料与方法
1.1 材料
1.1.1 实验材料 鲢鱼:鲜活,购于无锡市华润万家超市,质量2.5±0.2 kg,去除头、内脏,用清水冲洗干净后切成长、宽、厚为 5±0.2 cm×5±0.2 cm×2±0.2 cm的鱼块。
菌种:植物乳杆菌120、酿酒酵母152、木糖葡萄球菌135分离于自然发酵酸鱼,均由江南大学食品学院提供。
1.1.2 主要仪器设备 分光光度计:UV2100型,上海尤尼柯仪器公司;冷冻离心机:4K15型,SIGMA公司;均质机:T10型,广州仪科实验室技术有限公司;气相质谱连用仪:QP2010 plus型,日本岛津公司;电子分析天平:AB104-N型,梅特勒-托利多仪器有限公司;电热恒温培养箱:HH-B11.420-BS型,上海跃进医疗器械厂;电热鼓风干燥箱:GZXGF101-1BS型,上海跃进医疗器械厂。
1.2 实验方法
1.2.1 发酵鲢鱼的制备 实验分4组:①盐质量分数5%;②盐质量分数3%;③盐质量分数5%,加1%混合发酵剂;④盐质量分数3%,加1%混合发酵剂。混合发酵剂植物乳杆菌120、酿酒酵母152、木糖葡萄球菌135添加比例为1∶1∶1。4组实验均加入质量分数1%的葡萄糖做碳源,在20℃发酵48 h。
1.2.2 混合发酵剂的制备 将菌种植物乳杆菌120、酿酒酵母152和木糖葡萄球菌135分别接种在不同的培养基上活化培养,重复操作3次。将培养的菌种菌液于4℃、10 000 r/min离心10 min,然后用无菌生理盐水洗涤两次,再悬浮于无菌生理盐水中。最后将菌液浓度调整到105~106cfu/mL,将菌液于4℃保存,并于24 h内使用。
1.2.3 微生物分析 取25 g样品于无菌均质袋中,加入225 mL无菌生理盐水,用均质拍打器均质3 min。吸取上清液1 mL,将样品等梯度稀释。选择3个合适稀释度,每个稀释度取0.1 mL分别加入不同的选择性培养基中,采用稀释涂布的方法对微生物计数。菌落总数用平板计数琼脂(PCA)培养基,37℃培养2 d;乳酸菌用MRS培养基在30℃培养2 d;酵母菌用马铃薯葡萄糖琼脂培养基在30℃培养36 h;葡萄球菌用高盐甘露醇琼脂(MSA)培养基于30℃培养2 d;假单胞菌用CFC选择培养基于26℃培养72 h;肠杆菌用结晶紫中性红胆盐葡萄糖琼脂(VRBA)双层培养基在37℃培养24 h。
1.2.4 pH值的测定 精确称取10 g鱼肉,加100 mL蒸馏水用高速分散机匀浆1 min,匀浆结束后立即用pH计测定匀浆物的pH值,重复测定3次。
1.2.5 总酸含量的测定 参照Ikenebomeh法[8],总酸度用乳酸表示。
1.2.6 挥发性盐基氮(TVBN)含量的测定 按照国标GB/T2003稍微修改进行测定。
1.2.7 氨基态氮(ANN)含量的测定 采用甲醛滴定法[9]。
1.2.8 脂质氧化的测定 用硫代巴比妥酸(TBA)表示氧化酸败的程度。取2 g碎肉,加入20 mL 10%三氯乙酸溶液高速均质30 s,4℃2 000 g离心5 min,将上清液进行过滤,取过滤液5 mL与5 mL 0.02 mol/L TBA溶液混合,沸水浴加热20 min,迅速冷却20 min,在532 nm处测吸光值。空白由5 mL三氯乙酸溶液与5 mL TBA溶液混合。TBA值用丙二醛(MDA)质量分数表示,单位为mgMDA/kg样品。
1.2.9 GC-MS测定挥发性风味物质 (1)挥发性风味物质的提取。采用固相微萃取的方法提取风味物质。取鱼肉2 g,萃取温度为50℃,萃取时间为60 min。将萃取头插入气相色谱进样口250℃解析3 min,取样3次,进行平行操作。(2)GC-MS测定。气相色谱条件:弹性毛细管柱 (30 m×0.25 mm×0.25 μm),载气氦气流量为 0.81 mL/min,不分流进
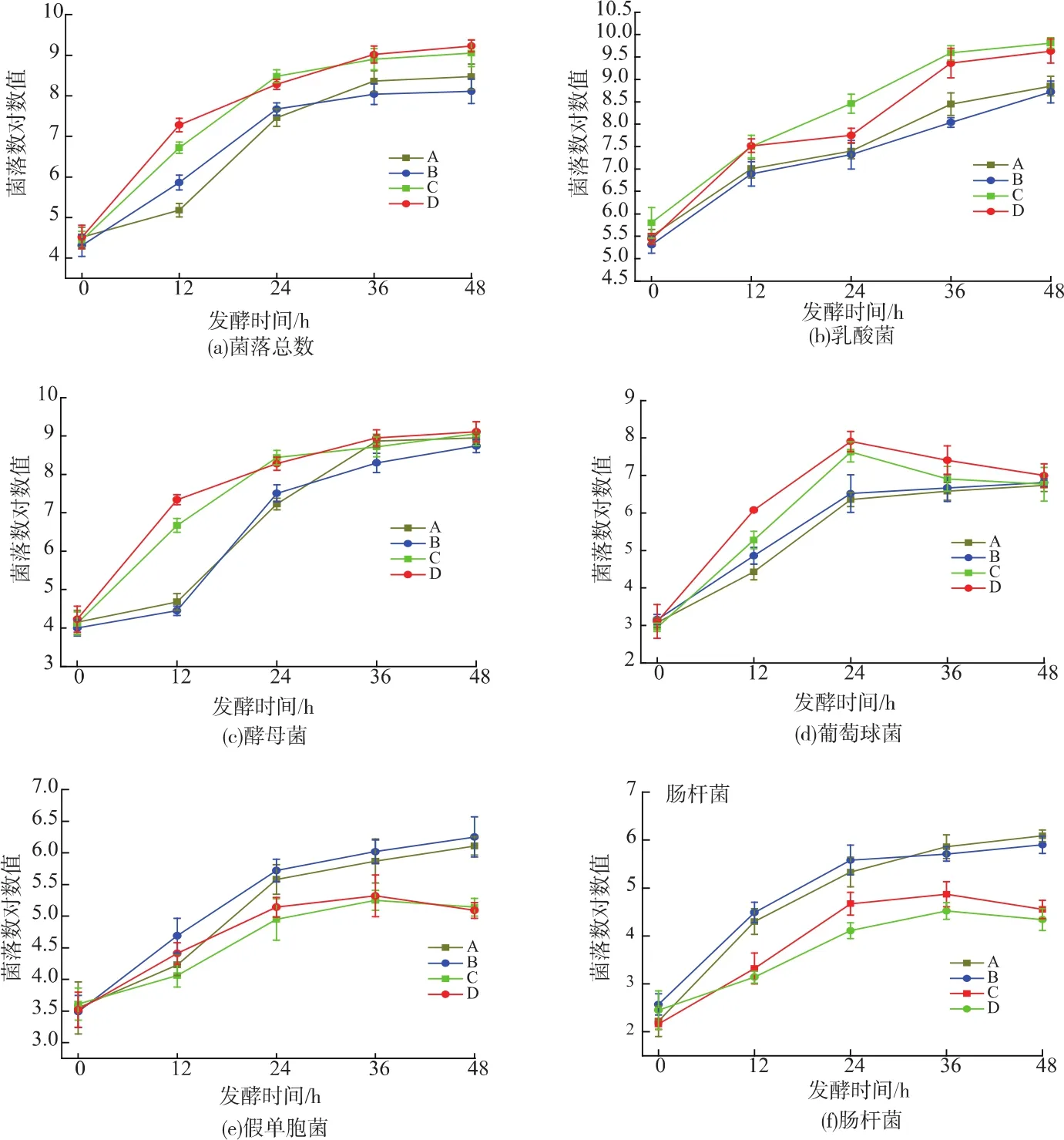
图1 不同发酵条件下鲢鱼发酵过程中微生物的变化Fig.1 Microbiological changes in sliver carp during fermentation under different condition
样,进样口温度维持250℃。起始柱温40℃维持3 min,然后以5℃/min升温至120℃,保持5 min,再以15℃/min升温至240℃,保持5 min。质谱条件:离子源温度200℃,四级杆温度150℃,电子电压70 eV。
1.2.10 数据处理 数据用Origin 8.5统计作图,利用SPASS 22.0软件进行差异显著性分析。
2 结果与讨论
2.1 鲢鱼发酵过程中微生物变化
鲢鱼发酵过程中微生物的变化见图1。微生物是影响发酵鲢鱼最终品质的重要因素,本实验主要对菌落总数、乳酸菌、酵母菌、葡萄球菌、肠杆菌以及假单胞菌等6种菌种进行了分析。由于盐质量分数较低,在3%~5%的含盐量范围内,盐质量分数对微生物生长的影响并不明显。
由图1(a)可知,随着发酵的进行,0~24 h菌落总数快速增加,24~48 h增长速度变缓,说明后期乳酸菌代谢产生的有机酸、细菌素等抑菌物质对微生物的增长产生了抑制作用。发酵初期,由于发酵剂直接注射入发酵液中,因此接种组与对照组的差异并不是很明显。但乳酸菌(图1(b))随着发酵时间的增加而增加,对照组的乳酸菌数明显低于接种混合发酵剂组,接种组发酵24 h时菌落数对数值已达到7.58~8.46,而对照组在36 h时最高仅为8.45,接种组在36 h时已达到9.36~9.59。且乳酸菌与总菌数变化趋势相似,因此推断乳酸菌为鲢鱼发酵过程中的优势菌。
酵母菌和葡萄球菌对鲢鱼风味物质的形成具有重要作用。由于接种组中加入酵母菌,所以发酵前12 h,增长速度较对照组迅速,直至24 h时,接种组增速开始减缓;48 h时数量差异已不是很明显(图1(c))。酵母菌可以通过消耗过氧化物和氧气来抑制亚硝基肌红蛋白的降解和产品的腐败[10]。
接种组中葡萄球菌数量高于对照组,接种组和对照组均维持快速增长,当到达24 h时,接种组开始出现明显下降趋势,对照组虽在增加却速度变缓,这可能是由于pH的降低造成的,因为在存在耐酸细菌的环境中,葡萄球菌竞争性相对较弱[11]且酸度的增强抑制了葡萄球菌的生长。
肠杆菌、假单胞菌是发酵鱼产品中的致病菌,所以对产品安全有重要的影响。发酵前12 h,假单胞菌数量在3.5~3.6,肠杆菌数量在2.2~2.6,由于营养物质丰富,肠杆菌和假单胞菌迅速增加,但随着时间延长,乳酸菌等优势菌的快速增长使其生长受到竞争,且pH的降低也不利于其生长,削弱了有害菌的生长环境,因此发酵至36 h时均有先增长迅速后增长平缓的趋势。继续发酵,实验组中肠杆菌、假单胞菌和葡萄球菌出现明显降低,推测是受pH值以及抑菌物质的影响产生的。
2.2 添加混合发酵剂对理化指标的影响
2.2.1 鲢鱼发酵过程中pH值和总酸含量(TA)的变化 pH值和TA的变化如图2所示,发酵初期,鱼肉pH值均在6.5~6.8。随着发酵时间的增加,0~12 h pH值和TA值变化较为缓慢,24 h时pH值明显下降,TA值上升,由此可知微生物在此时间范围内生长迅速,使pH值迅速下降,抑制有害微生物的生长。发酵48 h时,接种组的pH值明显低于对照组,当接种组pH值为4.23~4.44时,对照组的pH仍保持在5左右,说明加入混合发酵剂后发酵时间明显缩短,且pH的降低伴随着明显的TA值升高,与前面的乳酸菌的增长相一致。3%和5%食盐含量的两接种组,前者pH值变化更明显。
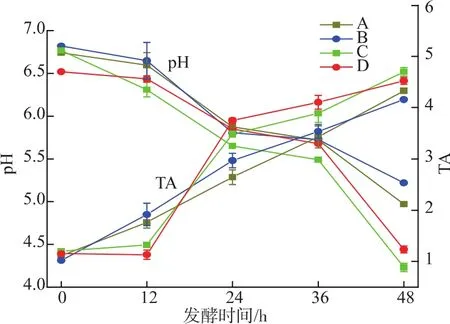
图2 不同发酵条件下鲢鱼发酵过程中pH和TA的变化Fig.2 pH andTA changesin slivercarp during fermentation under different conditions
2.2.2 鲢鱼发酵过程中挥发性盐基氮(TVBN)的变化 由图3可知,不论在何种发酵条件下,随着发酵时间的增加,TVBN值均增加;48 h时,接种组质量分数分别为0.188 7和0.192 2 mg/g,对照组质量分数分别为0.232 1和0.254 5 mg/g,已开始出现腐败特征。根据微生物生长情况可知,乳酸菌的快速生长降低了pH,并产生其他抑菌物质,明显抑制腐败菌的生长,并抑制TVBN的增加。两接种组间虽最后差别不是很大,但5%食盐质量分数组TVBN增长速度明显较3%食盐组快。
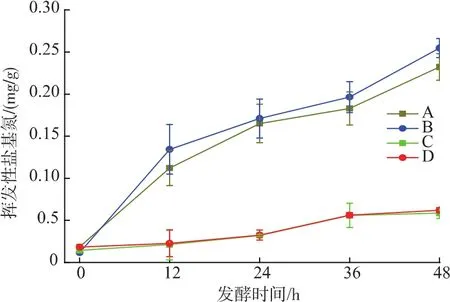
图3 不同发酵条件下鲢鱼发酵过程中TVBN的变化Fig.3 TVBN changes in sliver carp during fermentation under different conditions
2.2.3 鲢鱼发酵过程中氨基态氮 (ANN)的变化氨基态氮含量可以反映发酵鱼肉的蛋白水解程度。由图4可知接种混合发酵剂的发酵鱼肉的ANN含量均高于对照组,除了因pH值的降低提高鱼肉中的酸性蛋白活性外,与乳酸菌和木糖葡萄球菌本身产生的蛋白酶也有很大的关系。
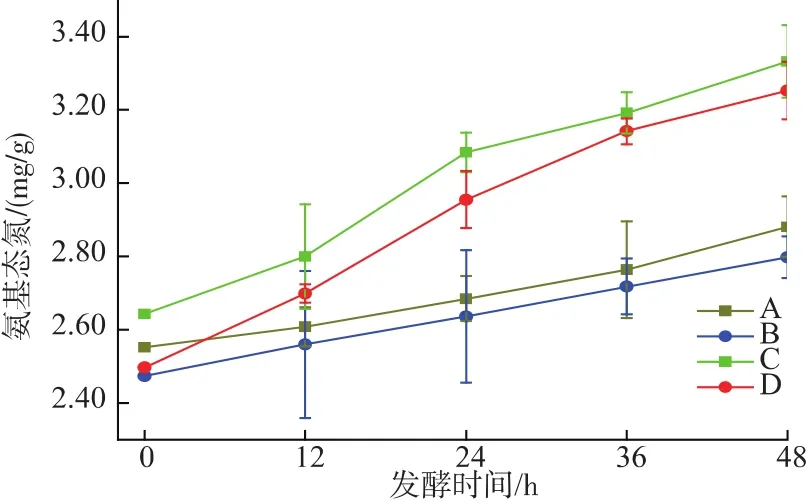
图4 不同发酵条件下鲢鱼发酵过程中ANN的变化Fig.4 ANN changes in sliver carp during fermentation under different conditions
2.2.4 鲢鱼发酵过程中硫代巴比妥酸(TBARS)的变化 TBARS是衡量脂肪氧化程度的指标之一。由图5可知,发酵初期鱼肉中TBARS值为0.24~0.26 mg/kg,随着发酵时间的延长TBARS显著增加,接种组中由于优势菌种的作用,明显低于对照组。添加混合发酵剂的两组最高为2.322 mg/kg,而对照组最低为3.225 mg/kg,最高达到3.412 mg/kg,说明混合发酵剂明显抑制TBARS的增长。在此发酵时间内,发酵鱼肉中TBARS含量低于丙二醛限量值5 mg/kg[12]。
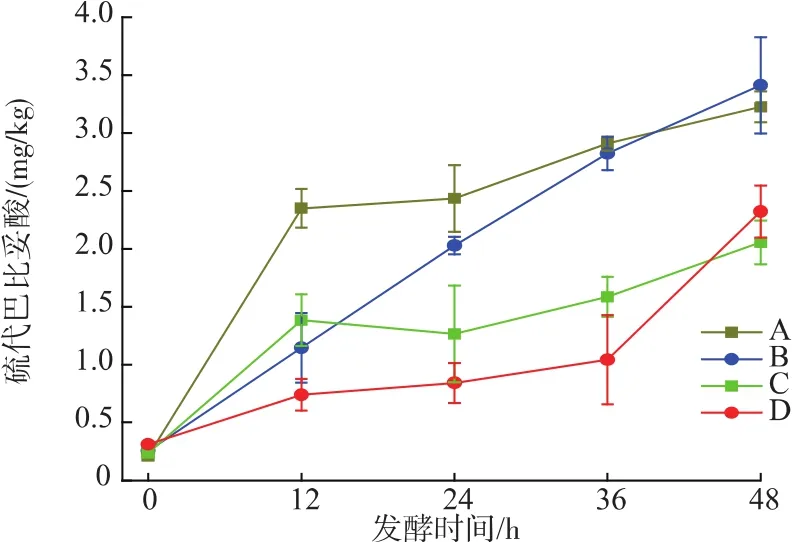
图5 不同发酵条件下鲢鱼发酵过程中TBARS的变化Fig.5 TBARS changes in sliver carp during fermentation under different conditions
2.3 不同发酵条件下挥发性风味成分的分析
鱼肉发酵过程中产生的风味物质对鱼肉产品的最终品质有重要影响。图6表示了不同发酵条件下发酵鲢鱼挥发性风味成分及其相对含量的变化。空白对照组 (A、B)分别检测出风味化合物种类为31和41种;接种混合发酵剂组(C、D)分别检测出挥发性风味化合物种类为65和65种。
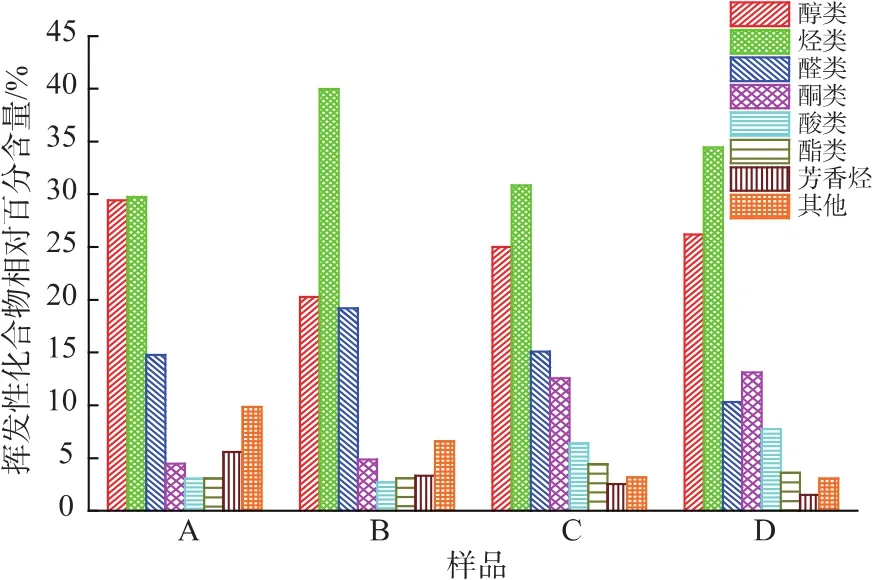
图6 不同发酵条件下发酵鲢鱼的挥发性风味物质的变化Fig.6 Changesofvolatility in sliver carp during fermentation under different conditions
发酵过程中酵母菌对醇类化合物的生成贡献最大;并且3%的盐质量分数更有利于醇类的生成。另外,尽管醇类物质中3-甲基-1-丁醇、1-辛醇和1-壬醇含量相对较高,但由于其阈值较高,对风味的影响较小,而1-辛烯-3-醇因其较小的风味阈值且具有蘑菇香而对风味具有重要的贡献。
碳氢化合物是所有挥发性风味成分中质量分数最多的物质,且各组之间的差距并不明显,占到总挥发性风味物质的45%左右,但由于其阈值较高,因此其对风味的影响较小。
醛类物质由于较小的阈值对食品风味具有重要的贡献。根据醛类的来源可将醛分为脂质氧化醛和氨基酸降解醛[13]。己醛、辛醛和壬醛等直链醛主要是不饱和脂肪酸的氧化产生,支链醛主要来自氨基酸降解。发酵鲢鱼中的醛类化合物主要包3-甲基丁醛、庚醛、壬醛,其中支链醛3-甲基丁醛相对含量最高,对风味的贡献较大[14]。
酮类形成主要来自于脂质的氧化和Strecker反应而发生的氨基酸降解。混合接种组(C、D)的酮类化合物明显高于对照组,这可能是由于葡萄球菌促进酮类风味物质的生成。单个酮类物质中,变化最明显的是2-甲基-3-辛酮。2-酮 (3,5-辛二烯-2-酮)由于具有特殊的香味[15],因此被认为对肉产品风味具有重要作用。
酸、酯和芳香烃的挥发性化合物质量分数相对较低。接种混合发酵剂组(C、D)的酸类化合物质量分数 (6.38%~7.76%)明显高于对照组 (2.69%~3.06%),这主要是由于鱼肉发酵过程中乳酸菌产酸的原因。其中酸类化合物中乙酸质量分数相对较高。接种组的酯类质量分数分别为(3.6%~4.41%),高于对照组(3.09%~3.11%),说明接种微生物有利于酯类物质的生成。芳香烃中只检测出一种呋喃(2-戊基呋喃),所占比例约为0.2%~0.7%,研究表明,2-戊基呋喃是由亚油酸和n-6脂肪酸衍生而来[16],且由于阈值相对较低,因此对风味形成有重要贡献。
3 结语
(1)鱼肉混合接种发酵过程中乳酸菌快速生长,导致鱼肉pH值48 h内降到4.5以下,有效抑制了鱼肉中肠道菌、葡萄球菌和假单胞菌的生长繁殖以及TVBN和TBARS的积累。
(2)采用微生物混合接种发酵技术可改善鱼肉风味,相较对照组,接种组中酯类、酮类和酸类香气增加较为明显;其中乙酸、己醇、1-辛烯-3-醇、3,5-辛二烯2-酮、3-甲基丁醛是主要的风味物质。
(3)在3%~5%的食盐质量分数范围内,盐含量对发酵鱼肉理化及风味品质没有显著影响。

