交叉引物等温扩增检测猪肉源性成分
冯 涛 , 李素芳 , 毛梦娇 , 邵柔铭 , 潘家荣 *
(1.中国计量大学 浙江省海洋食品品质及危害物控制技术重点实验室,浙江 杭州310018;2.中国计量大学 海洋食品加工质量控制技术与仪器国家地方联合工程实验室,浙江 杭州310018)
肉制品掺假现象已成为我国食品行业重点关注的问题。诸多媒体报道,不法商贩使用廉价肉类掺入或直接代替价值更高的牛羊肉进行食品加工及销售,严重侵害消费者的利益。猪肉是我国食用最广泛的肉类之一,其价格相对于牛羊肉更便宜。而信仰伊斯兰教的穆斯林民族的饮食习惯又严禁猪肉源性成分的混入。肉类加工制品琳琅满目、种类繁多,难以通过感官进行分辨。因此对工商、食品安全部门而言,建立有效的肉类加工制品中猪源性成分的定性鉴定方法,对掺假不法行为的监管与打击十分必要。这有助于保证广大消费者的健康及促进民族和谐。
核酸扩增技术[1]是有效鉴别动物源性成分的方法。高琳等利用线粒体DNA Cyt b基因PCR-RFLP技术成功鉴别猪肉和牛肉[2],周彤等使用荧光定量PCR方法检测肉制品中猪源性成分[3],国外也有诸多利用PCR方法对鸭、牛、羊等动物进行物种鉴定的报道[4-6]。核酸等温扩增技术也越来越多地应用于动物源性成分的鉴定,以LAMP为基础的扩增方法被广泛使用和研发[7-8]。
交 叉 引 物 等 温 扩 增 (Crosspriming amplification,CPA)是一种新型的核酸等温扩增技术。通过对CPA的两条特定引物进行分子标记,使扩增产物成为拥有两个特定结合位点的 “抗原”[9]。这种方法具有灵敏度高、特异性强、操作过程简单等优点,已经被大量用于检测细菌、病毒、病原体等[10-13]。但在动植物鉴定方面还少有报道,因此CPA-核酸试纸条检测技术在食品掺假方面具有研究和使用前景。
mtDNA是高等动物的核外遗传物质,单细胞中含有多个线粒体,线粒体中,基因的数量少,基因拷贝数多,且具有种内和种间多态性[14-15],拷贝数大。而细胞核DNA中基因的数量庞大,单拷贝的基因居多,在深加工肉制品[16]中单拷贝的基因更容易丢失。因此mtDNA较细胞核DNA更适合作用检测目标。本研究在分析牛、羊、猪、鸭、鸡线粒体DNA D-loop基因[17]序列的基础上,设计用于肉制品中猪源性成分检测的CPA引物体系,拟建立猪源性成分定性检测的交叉引物等温扩增-核酸试纸条检测方法。
1 材料与方法
1.1 材料与试剂
本研究所使用的动物样本(牛、羊、鸡、鸭、猪)购自杭州大型超市;实验用引物和探针由上海生工生物工程技术有限公司合成;核酸试纸条购自杭州尤思达生物技术有限公司。
实验所用核酸试纸条为胶体金免疫试纸条,其中加样区包含胶体金-亲和素复合物,检测线(T线)包埋荧光素的抗体,质控线(C线)包埋生物素。使用时,用移液器吸取10 μL的扩增产物滴入试纸条加样区,将试纸条插入2×SSC缓冲液中进行检测。
1.2 仪器和设备
PCR扩增仪、Nanodrop-2000电泳仪、凝胶成像系统。
1.3 总DNA的制备
用DNA提取试剂盒提取样品总DNA,方法参照使用手册。将制备好的DNA用ND-2000核酸蛋白分析仪检测,并将其质量浓度调整为约100 ng/μL。-20℃保存备用。
1.4 基因比对和CPA引物设计
在 GenBank上整理鸭、牛、羊、鸡、猪线粒体DNA D-loop基因的序列。同种动物不同个体之间的D-loop基因存在一定水平的遗传多样性,在CPA引物设计中需要考虑到这种差异。故通过比对GenBank上已公布的猪D-loop基因序列,在CPA引物设计时尽量避开突变位点,以保证CPA系统的通用性和有效性。对猪源D-loop基因上特异性片段序列设计CPA引物组并实验筛选。
1.5 CPA引物与探针的筛选及体系优化
1.5.1 引物与探针的筛选 对1.4节中设计的CPA引物组进行初步筛选,将1.3节中提取的猪DNA作为阳性对照,将提取的牛、羊、鸭、鸡4种常见畜禽肉的总DNA以及无菌水作为阴性对照,所有DNA模板均使用ddH2O稀释至100 ng/μL。筛选反应体系见表1,反应温度预设63℃,反应60 min。扩增结束,取10 μL扩增产物用核酸电泳和试纸条分别进行检测。
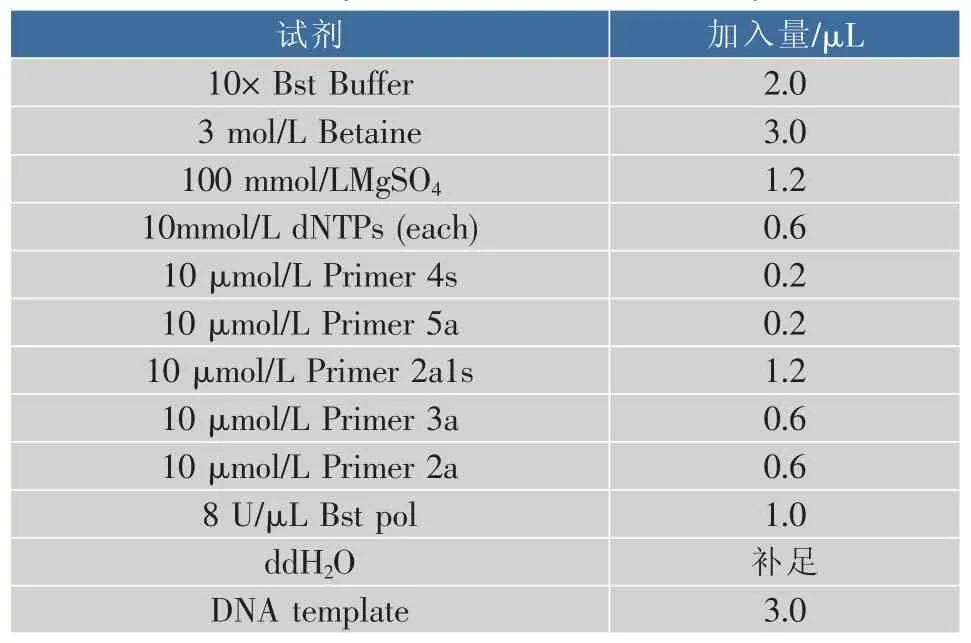
表1 20 μL CPA初始反应体系Table 1 20 μL CPA initial reaction system
1.5.2 引物与探针浓度的优化 以CPA反应体系中的交叉引物2a1s和探针(2a/3a)的质量浓度作为变量,设计引物质量浓度交叉实验。在研究中发现当交叉引物2a1s质量浓度≥探针2a/3a质量浓度时扩增效果较好,设计18组质量浓度配比实验(见表2),每个实验组中设立3个平行阴性实验(以无菌水为模板)和3个平行阳性实验(以100 ng/μL猪的总DNA为模板)。

表2 CPA引物浓度交叉实验设计Table 2 Concentration cross experiment of CPA primers
1.5.3 引物体系的特异性及稳定性实验 对1.5.2节中扩增结果理想的引物浓度组合,以猪的总DNA作为阳性对照,以牛、羊、鸭、鸡的总DNA以及无菌水作为阴性对照,进行CPA扩增引物特异性实验。反应产物分别用琼脂糖凝胶电泳和核酸试纸条进行检测,比较结果。
对特异性良好的实验组,后续进行稳定性实验。设立3个重复组,每个重复组分别设立6个平行阴性实验和6个平行阳性实验。总计18个阴性实验及18个阳性实验结果均正确的实验组为本次研究的最佳引物体系。
1.6 CPA扩增灵敏度实验
将保存的猪DNA样品梯度稀释(10倍稀释)成100、10、1、1×10-1ng/μL。 用 1.5 节中筛选优化的CPA反应体系进行扩增灵敏度实验。反应产物用电泳和试纸条分别进行检测,以确定CPA反应体系对单一成分猪肉DNA的灵敏度。
1.7 混合肉中猪肉成分的检测
将猪肉按比例 (50% 、20%、10%、5%、1% 、0%)与牛肉进行混合,用SDS动物组织DNA提取方法[18-19]提取总DNA,并将混合DNA质量浓度调整至100 ng/μL,作为模板进行CPA扩增,产物使用核酸试纸条进行检测,研究肉类混合对检出限的影响。
2 结果与讨论
2.1 特异性片段序列及CPA引物
1.4节中设计的CPA引物组,经过1.5节实验筛选后最终的引物组合见表3。图1为设计引物所使用的特异性片段序列,同时各引物在序列上对应的位置也如图1所示。比较图中牛、羊、猪的片段序列可以发现,本引物系统的特异性主要体现在引物Sus Dlp 2s1a的3端。

表3 猪源检测CPA系统引物表Table 3 Nucleotide sequences of the primers of Sus CPA
表4为通过1.5节筛选及反应体系优化后确定的最佳反应体系。
2.2 CPA扩增特异性实验结果
以鸭、羊、牛、猪、鸡DNA为模板按表4最佳反应条件进行CPA扩增实验,电泳结果如图2所示。以水为模板的阴性对照电泳图中无扩增产物,说明引物间不发生扩增反应;以猪DNA为模板的CPA扩增产物在电泳下检测出阶梯状核酸条带,在100 bp左右位置出现两条清晰的电泳条带,此为CPA扩增的特征条带,条带的位置根据引物设计位置不同有所差异;以羊、牛、鸭、鸡DNA为模板的扩增实验中,产物电泳结果显示有核酸片段产物(弥散亮带),但无CPA特征条带。在2.1节中已指出,本引物组合的特异性主要体现在引物Sus Dlp 2s1a上,其他4条引物不具有高特异性,只作为CPA必要引物存在。在扩增实验中这4条引物也能以羊、牛、鸭、鸡DNA为模板进行扩增反应。但在缺少引物Sus Dlp 2s1a的扩增产物前提下,羊、牛、鸭、鸡DNA扩增产物与猪DNA扩增结果不同。结果表明本引物系统具有良好的特异性,只对猪源性成分具有完整的CPA扩增,其他模板只能进行部分扩增反应。

图1 猪线粒体D-loop基因中目标片段及引物位置Fig.1 Nucleotide sequence alignment of the target regions of D-loop gene in pork mtDNA.Arrows indicate the primers used for CPA assays
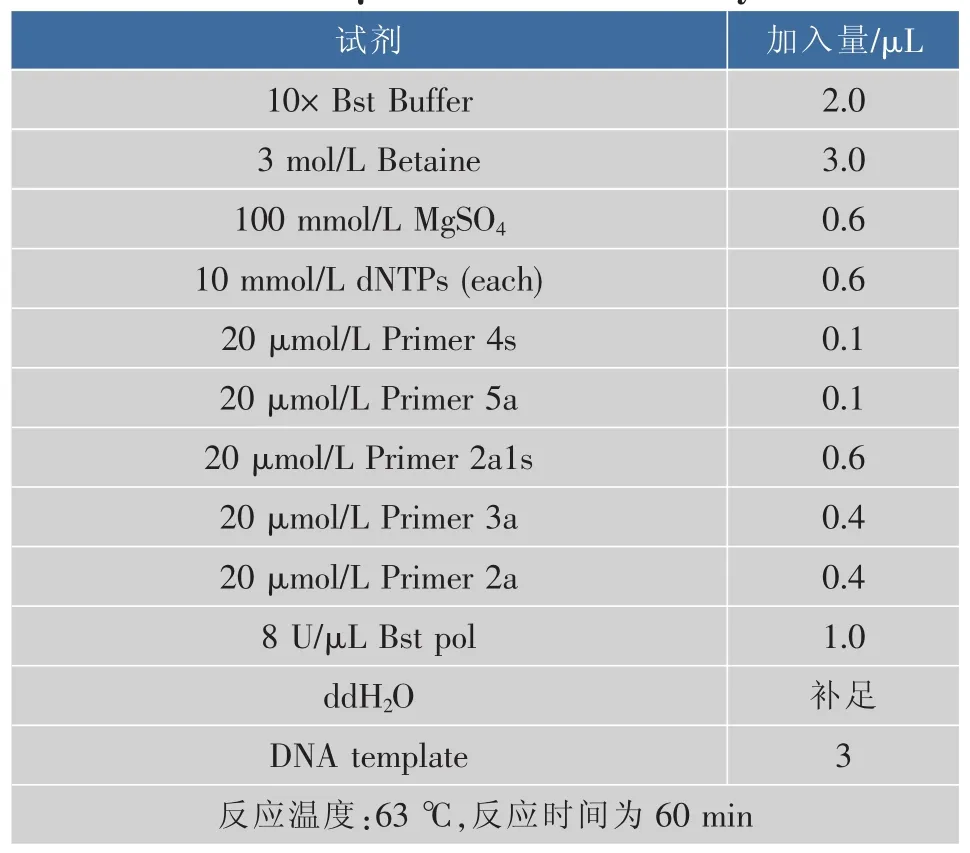
表4 20 μL CPA最佳反应体系Table 4 20 μL CPA best reaction system
核酸试纸条检测结果(图3)中只有猪DNA对应的试纸条上检测线显示为红色,其他模板对应的试纸条上检测线不显示红色。核酸试纸条检测结果与电泳结果一致,核酸试纸条能对猪DNA的CPA扩增产物正确检测。在120 V电压下,电泳系统工作30~40 min后呈现的电泳条带最为理想,而使用核酸试纸条检测,只需3~5 min即可完成加样到最终的结果观察的过程。

图2 猪源CPA系统扩增特异性电泳图Fig.2 Analysis of pork DNA by CPA with agarose gel electrophoresis
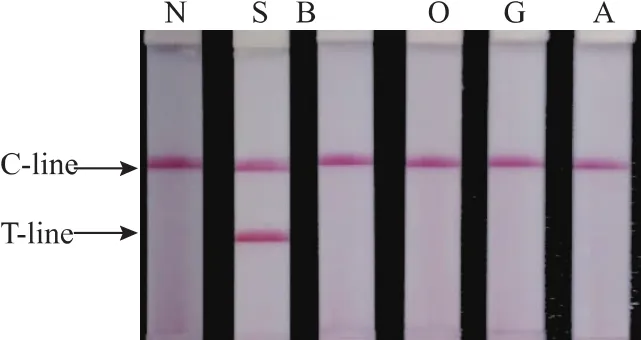
N-空白对照;S-猪模板;B-牛模板;O-羊模板;G-鸡模板;A-鸭模板
2.3 CPA扩增灵敏度
CPA反应体系对单一成分猪DNA检测的灵敏度实验结果如图4所示,模板质量浓度为100、10、1 ng/μL时,核酸试纸条检测结果为阳性。实验结果表明在研究设计并优化的CPA反应体系下,质量浓度大于等于1 ng/μL的猪DNA模板能被准确识别并进行扩增,电泳条带及试纸条检测结果明显一致。当模板质量浓度小于1 ng/μL时,本系统不能准确进行检测。

图4 猪源CPA系统梯度稀释模板扩增产物试纸条检测结果Fig.4 Nucleic acid strip test of CPA products targeting the plasmid with different folds
2.4 混合肉中猪肉成分检测结果
混合肉中不同猪肉比例的CPA检测结果见图5及表5。表5中当猪肉含量在10%以上时,CPA扩增方法能够准确地检测出样品中的猪源性成分;当猪肉成分比例在10%以下时,检测结果不稳定,表现为检测线颜色很浅或不限色,如图5中试纸条4的检测线存在少量红色,说明扩增产物中有双标记的CPA产物但产量极低。在不考虑取样误差的前提下,100 ng/μL的 10%混合样品DNA提取液中猪DNA的质量浓度为10 ng/μL,即当检测样品中猪DNA的质量浓度大于等于10 ng/μL时本方法可以检测出混合样品中的猪源性成分。比较1.6与1.7节的实验结果,混合肉中猪肉成分的检出限(10 ng/μL)要低于单猪肉成分的检出限(1 ng/μL),相差约为一个数量级(10倍)。相关的动物源性成分检测研究报道中,混合制品的检出限一般在10%以下,杨冬燕等在多重荧光PCR鉴定羊肉掺假实验中,准确检测出最低掺假比例为7%的样品[20];周如华等借助实时荧光定量PCR检测羊肉制品中鼠源性成分的检测限则为1%[21]。这是由于本研究中设计的CPA引物中部分引物具有通用性,混合肉中的其他肉成分DNA能与这部分引物进行反应,与猪DNA竞争性反应消耗引物。竞争性消耗在猪DNA含量越低时越明显。在本团队研究的鸭源成分CPA检测研究中混合制品的检出限达到1%(未发表)。因此,猪源CPA反应体系仍存在改进空间,检测灵敏度需进一步提高。

图5 混合肉中不同比例猪肉成分的检出限Fig.5 Limit of detection in different ratio meat mixtures
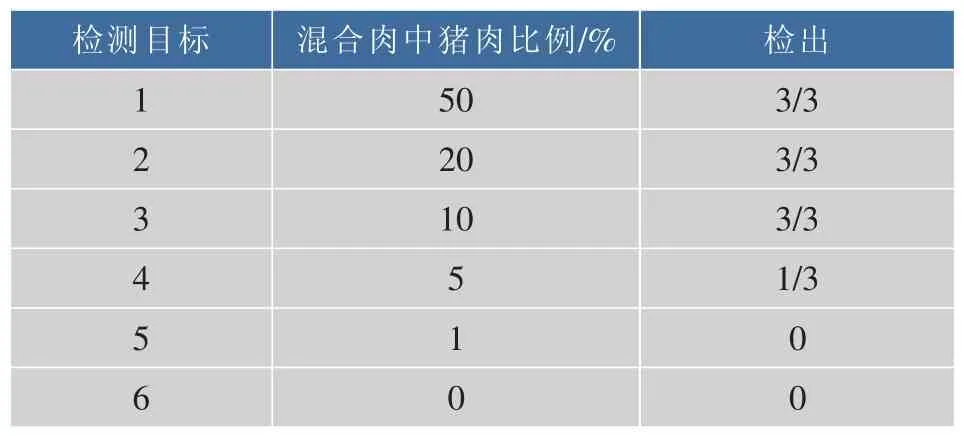
表5 不同比例混合猪肉的CPA检测结果(n=3)Table 5 Results of CPA of pork meat mixtures(n=3)
3 结 语
本研究建立了猪源性交叉引物等温扩增-核酸试纸条方法。该方法与鸭、羊、牛、猪、鸡无交叉反应,具有检测特异性,能够正确检测出样品中是否含有猪源性成分。对于单一猪肉源样品,检出限可以达到1 ng/μL。对混合肉制品中猪源成分占10%时,相当于猪DNA质量浓度大于10 ng/μL时使用本方法可以稳定地检出。本方法仍有较大的改进空间。

