复合菌种对发酵鲢鱼成熟过程中品质的影响
于沛沛, 石建喜, 姜启兴, 许艳顺, 杨 方, 高 沛, 余达威, 夏文水
(江南大学 食品学院,江苏 无锡214122)
我国是世界水产生产大国之一,2015年我国的水产品总产量为6 695.65万t,其中淡水养殖鱼类的总产量为3 290.04万t。然而,我国的淡水鱼加工比例不足20%,严重制约了我国淡水渔业的发展[1]。其中,鲢鱼具有生长速度快、不易生病等优点,且肉质鲜嫩,营养丰富,其产量仅次于草鱼。然而,由于鲢鱼的肉薄刺多、土腥味较重等问题,导致其消费量受到很大限制[2]。腌制发酵是传统的水产品保藏加工技术,产品在腌制发酵的过程中,其理化特性、微生物群及感官特性会发生很复杂的变化,最终形成产品所特有的风味、质构和色泽等,可以更好的满足消费者的需求。由于传统的发酵鱼制品都是利用环境或鱼体中自然存在的微生物发酵而成,其发酵过程往往难以控制,因而具有发酵时间长、产品品质不一致、安全性低等缺点[3]。
近年来,现代生物技术在提升传统发酵产品品质的研究已引起广泛关注。将分离得到的菌种接种到产品中,可以有效缩短产品的发酵周期,并提高产品的品质和安全性。微生物发酵菌种以及发酵工艺条件对产品的风味和食用品质有着重要的影响。本研究室现有研究以淡水鱼为原料,通过接种从传统发酵酸鱼中分离得到的菌种进行发酵,得到了具有独特口感、质构和风味的发酵酸鱼制品[4-9]。张娜[10]研究了不同的干燥条件对腌腊鱼品质的影响,发现经低温干燥的腌腊鱼品质高于热风干燥。现有研究主要针对发酵菌种筛选、发酵过程中产品品质变化等方面,而复合菌种接种对鱼块发酵和成熟的影响还鲜有报道。
因此,本研究以复合菌种(植物乳杆菌120、酿酒酵母152、木糖葡萄球菌135)作为发酵剂,在20℃发酵鲢鱼块,然后在8℃、RH 70%条件下成熟,分析接种复合菌种在发酵鲢鱼成熟过程中对蛋白质、脂肪和挥发性物质的影响,为现代微生物发酵技术在提升传统腌制鱼制品的风味品质的和安全性提供指导。
1 材料与方法
1.1 材料与试剂
鲢鱼:购于无锡市华润万家,2.5±0.2 kg/条,去头、去内脏,清水冲洗干净并切成5 cm×5 cm×2 cm(长×宽×厚)的鱼块。
菌种:植物乳杆菌120、酿酒酵母152和木糖葡萄球菌135从自然发酵酸鱼中分离得到,由江南大学食品学院提供。
丹磺酰氯购于Sigma;甲醇、乙腈为色谱纯,其它试剂均为分析纯,购于国药集团化学试剂有限公司。
1.2 主要仪器设备
紫外分光光度计:UV2100型,上海尤尼柯仪器公司;气质联用仪:QP2010 plus型,日本岛津公司;高效液相色谱仪:1525,美国沃特世公司;其他均为实验室常用仪器。
1.3 测定方法
1.3.1 菌落数的测定 乳酸菌、葡萄球菌及酵母菌分别用MRS培养基、MSA琼脂培养基和PDA培养基。检测方法参照曾[5],结果表示为(log CFU/g)。
1.3.2 pH的测定 称取5 g样品,加入50 mL蒸馏水,高速均质1 min,然后立即测定匀浆的pH值。
1.3.3 总酸含量的测定 参照Lucke F方法[11],称取10 g样品,均质后用150 mL煮沸过的蒸馏水洗入250 mL容量瓶中,摇匀、定容、过滤后,以0.10 mol/L的标准NaOH溶液滴定。总酸度以乳酸表示。
1.3.4 生物胺的测定 参考Ben-Gigirey B[12]方法采用HPLC法测定,并稍有修改。 HPLC条件:进样量:10 μL;色谱柱:Zorbax×CB C18(4.6×250 μm);柱温:30℃;荧光检测器:激发波长 340 nm,发射波长515 nm;流动相:A 50%乙腈 B 90%乙腈;流速:1.0 mL/min,梯度洗脱。
1.3.5 总氮含量的测定 参考国标GB/T 5009.5—2010,采用凯氏定氮法。
1.3.6 游离氨基酸的测定 采用茚三酮比色法。
1.3.7 TBA的测定 取2 g样品,加入20 mL质量分数为10%的三氯乙酸溶液,高速均质30 s后于4℃2 000 g离心5 min。上清液过滤,取滤液5 mL与5 mL 0.02 mol/L的TBA溶液混合,置沸水浴中加热20 min,迅速冷却,在532 nm处测吸光值。TBA值以丙二醛(MDA)的质量分数表示,单位为mg/kg样品。
1.3.8 FFA的测定 游离脂肪酸的甲酯化参照Gandemer G[13]方法,FFA组成采用GC-MS分析。色谱柱:石英毛细管柱(30 m×0.32 mm);升温程序:初温为120℃,保持3 min后以10℃/min升温至190℃,再以2℃/min升温至220℃,保持15 min;进样口和检测温度均为250℃;载气 (N2)的流速为3 mL/min;分流比为 1∶8;进样量:1 μL。
1.3.9 挥发性风味化合物的测定
1)挥发性风味物质的提取:采用固相微萃取法(SPME),萃取温度为50℃,萃取时间为60 min。将萃取头插入GC进样口,250℃解析3 min。
2)GC-MS测定:气相色谱条件:弹性毛细管柱(30 m×0.25 mm×0.25 μm),载气(He)流量为 0.81 mL/min,进样口温度维持在250℃,不分流进样。升温程序:起始柱温为40℃,维持3 min后以5℃/min升温至120℃,保持5 min后以15℃/min升温至240℃,保持5 min。质谱条件:离子源温度为200℃,四级杆温度为150℃,电子电压为70 eV。
1.4 实验方法
1.4.1 复合菌种的制备 将菌种(植物乳杆菌120,酿酒酵母152,木糖葡萄球菌135)活化后,培养液于4℃、10 000 r/min离心10 min,以无菌生理盐水洗涤两次,重悬于无菌生理盐水中,最后调整菌液的质量浓度至5~6 log CFU/mL,置4℃保存,于24 h内使用。
1.4.2 发酵鲢鱼的制备 将鲢鱼鱼块在20℃条件下,置发酵罐腌制发酵48 h。然后以去离子水洗净,沥干后分为两组:(1)表面涂抹混合发酵剂(比例为1∶1∶1),(2)不做任何处理。 将鱼块置 8 ℃、RH 70%的培养箱中成熟,成熟时间为8 d,每两天进行取样并测定分析。
1.5 数据处理
数据用Origin 8.5统计作图,利用SPASS 22.0软件进行差异显著性分析。
2 结果与讨论
2.1 发酵鲢鱼成熟过程菌落数变化
发酵鲢鱼成熟过程中乳酸菌、木糖葡萄球菌和酵母菌生长情况如图1所示。
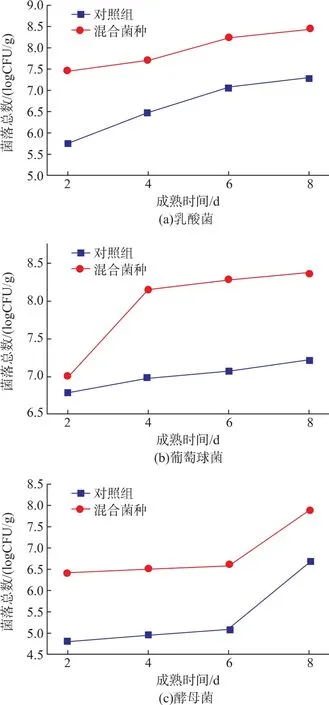
图1 发酵鲢鱼成熟过程中微生物的变化Fig.1 Microbiological changes in silver carp during maturation
由图1可知,混合菌种组的微生物增长显著高于对照组。在混合菌种组,乳酸菌在第2 d到第4 d时增长迅速,从7.01 log CFU/g增长到8.15 log CFU/g,发酵后期增长缓慢;葡萄球菌从第2 d到第6 d时增长缓慢,从第6 d到第8 d数量从6.53 log CFU/g迅速增长到7.87 log CFU/g;而酵母菌的数量一直处于缓慢增长。成熟过程初期鱼肉中的碳水化合物充足,乳酸菌大量生长繁殖,使得鱼肉中的有机酸大量积累,而酵母菌是一种兼性厌氧菌,在无氧条件下可以将葡萄糖分解为二氧化碳和醇类,木糖葡萄球菌中的脂肪酶和蛋白酶活性能将酸和醇结合形成酯和其他风味化合物。酵母菌是许多发酵产品中的主要微生物,可以在乳酸菌创造的酸性环境中大量繁殖[14],具有较强的产香能力。
2.2 发酵鲢鱼成熟过程中的pH和总酸质量分数的变化
pH和总酸是影响发酵鲢鱼肉品质的重要因素,发酵鲢鱼在成熟过程中的pH和总酸质量分数的变化如图2所示。
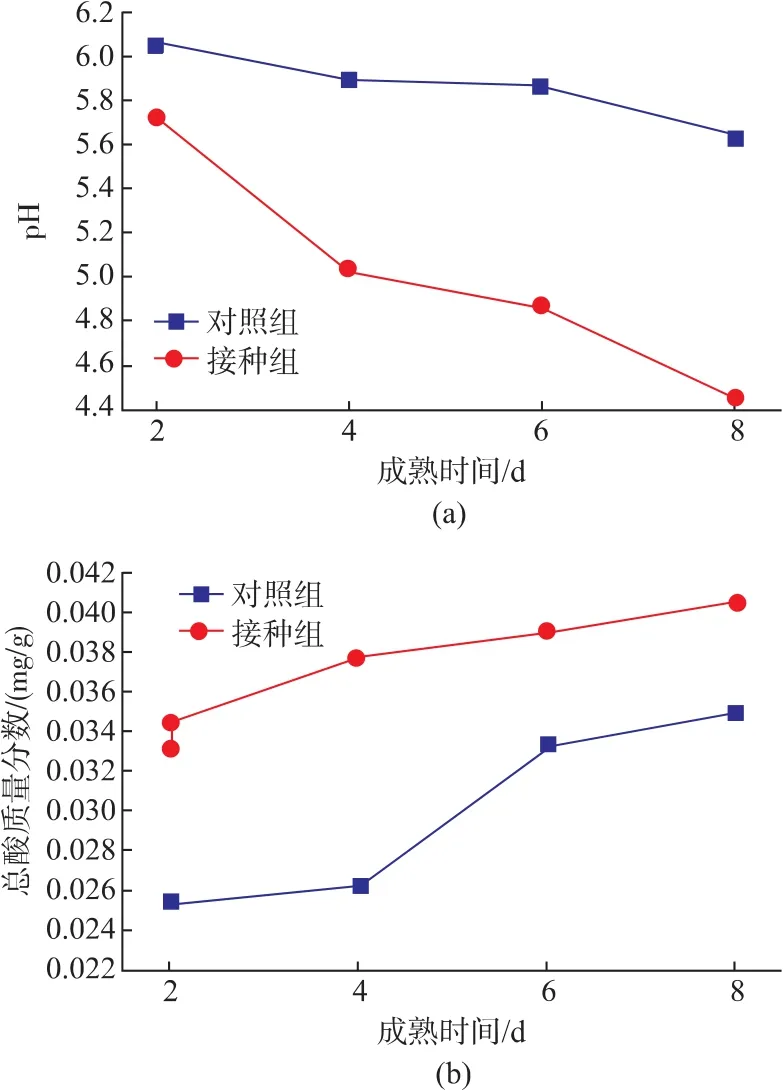
图2 复合菌种对鲢鱼成熟过程中pH和TA的影响Fig.2 Effect of mixed starter cultures on pH and TA of silver carp during ripening process
由图2可知,pH值的变化与总酸质量分数的变化趋势相一致。在发酵鲢鱼成熟过程中,接种组和对照组鱼肉的pH值低于7.0,且均呈现出下降趋势,随着成熟时间的延长,下降速率增大,最终接种组的pH值4.46,对照组pH值为5.63。造成接种组和对照组pH值较低的原因主要是在成熟阶段,乳酸菌在鱼肉中大量繁殖,如图1所示,涂抹混合发酵剂组乳酸菌的数量由最初的6.80 CFU/g增至成熟结束时的8.36 CFU/g;而对照组乳酸菌数量由最初的5.87 CFU/g增至7.21 CFU/g,明显低于涂抹混合发酵组,这也说明了接种组pH值降低的幅度明显大于对照组。乳酸菌能对鱼肉中的碳水化合物进行分解,产生乳酸等物质,从而降低了鱼肉的pH值;同时,成熟过程中的脂肪分解以及FFA的积累也会导致pH值的降低[15],也有报道称鱼肉内源酶或自身携带的微生物酶也会引起pH值的降低[16-18]。研究表明,乳酸菌不仅可以降低发酵过程中的pH值,还可以抑制腐败菌和致病菌的生长繁殖,也能够改变产品的色泽和风味,并加速成熟过程[19-20],达到快速发酵、缩短工艺时间的目的。
2.3 发酵鲢鱼成熟后生物胺质量分数的变化
发酵鲢鱼成熟后的生物胺质量分数如表1所示。由表1可以看出,接种组和对照组中的生物胺质量分数具有明显差异。食品中的肠杆菌和假单胞菌与腐胺、尸胺和组胺的形成密切相关,其所含的高活性脱羧酶使得产品产生生物胺[21]。

表1 发酵成熟后鲢鱼中生物胺的质量分数Table 1 Mass fraction of biogenic amines in curedripening fermented silver carp
组胺、酪胺、尸胺和腐胺是发酵肉制品中的主要生物胺,而精胺和亚精胺质量分数较低,其中,组胺是对人体危害最大的生物胺[22-23]。一般认为,食品中的酪胺质量分数不得高于100~800 mg/kg,组胺质量分数不得高于100 mg/kg[24]。接种组中的组胺和酪胺质量分数远低于这一标准,且低于对照组,可推测微生物在鲢鱼风干成熟过程中可有效抑制组胺和酪胺产生菌的生长。因此,在选择发酵剂时需选择不具有脱羧酶活性、可抑制致病菌生长的菌种,以防止生物胺在发酵和成熟阶段的积累。
2.4 发酵鲢鱼成熟过程中TN质量分数的变化
发酵鲢鱼在成熟过程中TN质量分数的变化如图3所示,随着成熟时间的延长,两组中TN的质量分数均逐渐升高,与对照组相比,接种组中TN的质量分数增加更加明显,其可能是因为在成熟过程中,接种组中的微生物快速生长,所分泌的蛋白酶促使蛋白质等含氮物质转化为风味化合物等物质。在成熟初期,对照组的TN的质量分数高于接种组,其可能是因为成熟初期,接种组中的部分蛋白质渗出引起的。
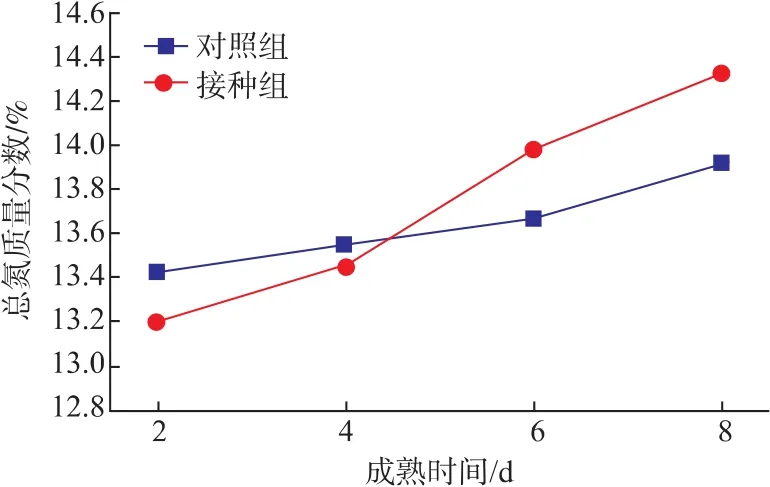
图3 复合微生物对鲢鱼成熟过程中总氮的影响Fig.3 Effect of mixed starter cultures on TN during silver carp ripening process
2.5 发酵鲢鱼成熟过程中FAA质量分数的变化
FAA是蛋白质水解的最终产物,不仅可以直接形成滋味物质,而且是许多挥发性风味物质的前体物质,因此FAA既可以影响产品的滋味又对风味的形成有重要作用[25]。一些游离氨基酸可以通过Maillard反应生成醛类物质,也可以通过Strecker降解生成酮类、醇类和酯类物质,其反应产物均会对腌制鱼风味的形成产生一定影响[26]。发酵鲢鱼在成熟过程中的FAA质量分数的变化如图3所示。
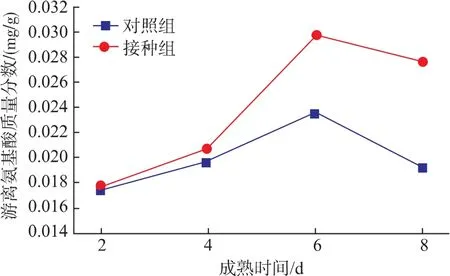
图4 复合微生物对鲢鱼成熟过程中游离氨基酸的影响Fig.4 Effect of mixed starter cultures on FAA during silver carp ripening process
由图4可以看出,FAA在发酵鲢鱼成熟过程中呈现先增加后下降的变化趋势。FAA质量分数的增加主要是蛋白质水解的结果,除了鱼肉中的内源蛋白酶外,微生物还可代谢产生多种外源蛋白酶,两者均可促进鱼肉蛋白的降解[27]。成熟过程中接种的混合微生物均是有利于最终产品品质的菌种,可以提高外源蛋白酶数量,因此接种组中FAA质量分数高于对照组。FAA的变化取决于其形成和降解两个反应的相对速度,随成熟时间的延长,Strecker降解反应使得FAA消耗速度高于了蛋白的水解速度;而且在成熟后期可能产生的FAA质量分数变化不大,而主要产生小肽类物质,导致从成熟第6 d开始FAA质量分数开始减少。但相较于对照组,成熟中期接种组中FAA质量分数不仅增加快速,而且在成熟后期,减少速率也相对缓慢,因此可知,复合微生物代谢产生的外源蛋白酶促进了蛋白质的水解,FAA质量分数增加,提高了产品的风味品质。
2.6 复合微生物对鲢鱼成熟过程中TBA的影响
TBA可以反映脂肪第二阶段的氧化程度。由图5可以看出,随着成熟过程的进行,TBA质量分数呈上升趋势,成熟结束时,对照组TBA值丙二醛由3.24 mg/kg增加至3.89 mg/kg;而接种组由于优势菌种的作用,其TBA明显低于对照组,其可能是复合菌种对不饱和脂肪酸具有抗氧化作用[28]。
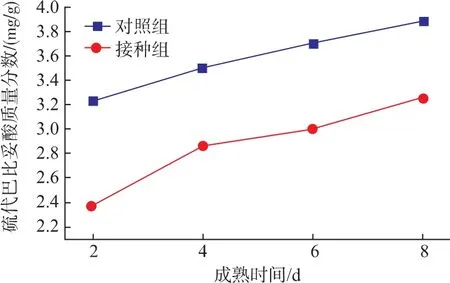
图5 复合微生物对鲢鱼成熟过程中TBA的影响Fig.5 Effect of mixed starter cultures on TBA during silver carp ripening process
2.7 发酵鲢鱼成熟结束后FFA质量分数的变化
发酵鲢鱼成熟结束后接种组与对照组中FFA的组成及质量分数如表2所示。成熟鲢鱼中共检出了14种FFA,其中包括5种饱和脂肪酸(SFA)、3种单不饱和脂肪酸(MUFA)和6种多不饱和脂肪酸(MUFA)。对照组与接种组中的不饱和脂肪酸质量分数分别为56.03%和70.33%,其中,对照组中SFA、MUFA均高于接种组,而接种组中的PUFA则高于对照组。
鲢鱼成熟工艺过程中FFA的变化是动态过程:一方面,脂质经水解生成FFA,FFA增加;另一方面,FFA会被氧化分解生成小分子风味物质,FFA减少。接种组中FFA(4.10 mg/g脂肪)低于对照组(4.75 mg/g脂肪),但接种组中的棕榈酸(C16:0)、硬脂酸(C18∶0)等饱和脂肪酸明显低于对照组,这主要是复合菌种在成熟过程中发挥了重要作用。而且,接种组中的不饱和脂肪酸(UFA)高于对照组,其中EPA与DHA明显增加,这主要是因为pH的降低抑制了脂肪氧化酶的活性,使得不饱和脂肪酸无法进一步降解。
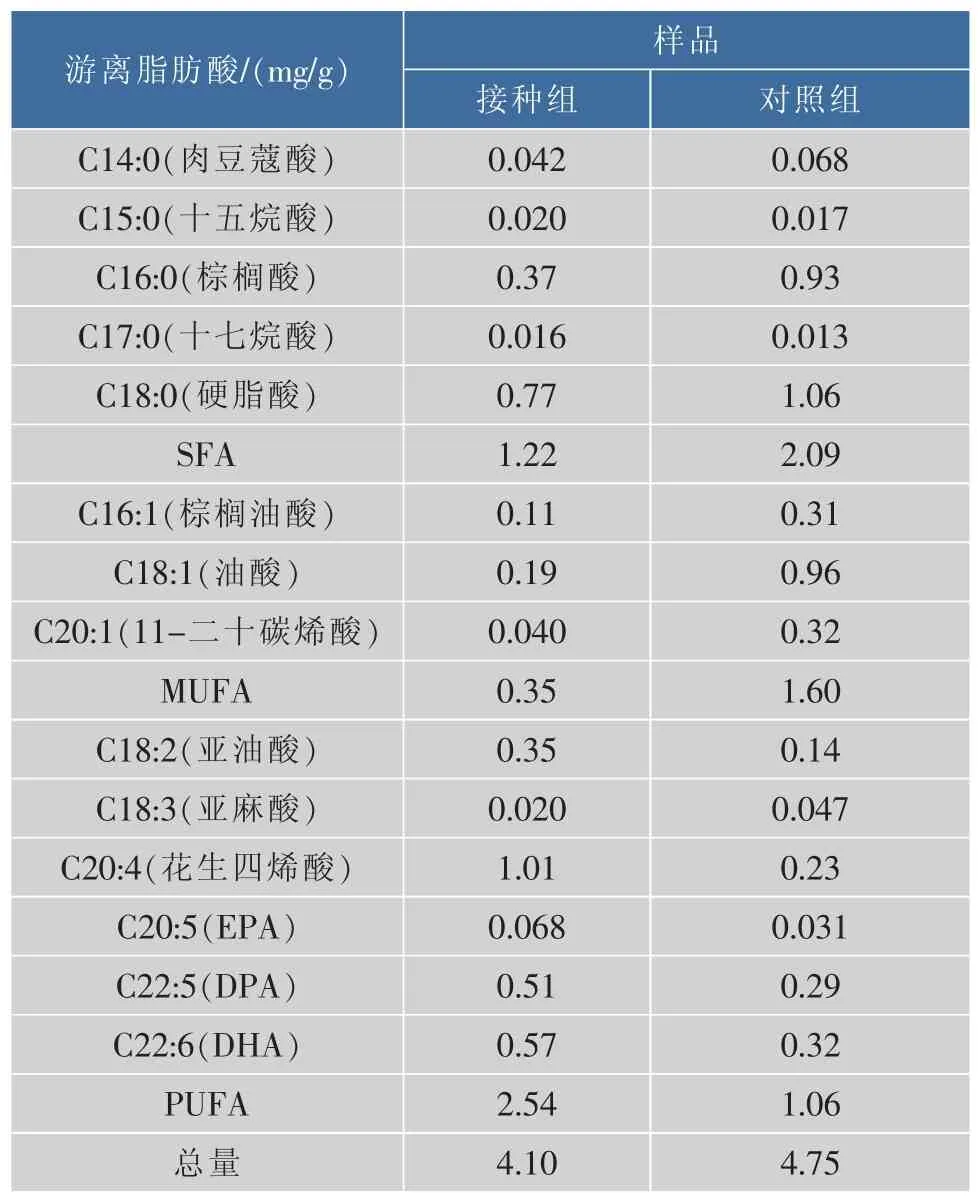
表2 复合微生物对腌制成熟鲢鱼游离脂肪酸的影响Table 2 Effectofmixed starter cultureson FFA concentrations generated from cured-ripening silver carp
2.8 发酵鲢鱼成熟过程中挥发性风味成分的分析
鲢鱼成熟后挥发性风味成分的组成及质量分数如表3所示。成熟鲢鱼中的挥发性风味成分主要包括醛类、酮类、酯类、醇类、酸类、烃类等。其中,对照组共检出了54种风味化合物,其中醛类7种、酮类6种、酯类10种、醇类12种、酸类4种、烃类15种;接种组中共检出了64种风味化合物,其中醛类14种、酮类9种、酯类13种、醇类10种、酸类3种、烃类15种。由表3可以看出,接种组与对照组中的挥发性化合物的质量分数差异明显,尤其是醛类、酮类和酯类化合物。由于醛类、酮类和酯类化合物的阈值较低,且其有良好的感官特性,因此对发酵鲢鱼的风味贡献较大。
烃类是原料鱼中质量分数最高的挥发性风味成分,经腌制和成熟后,对照组中的烃类化合物质量分数为31.83%,而接种组中的烃类质量分数降至9.82%,说明复合菌种对鱼肉蛋白、脂肪和碳水化合物起到了降解作用,生成了新的风味物质而抑制了烃类的积累。
鲢鱼中的酯类化合物的质量分数较低,经过成熟后,醇类与酸类化合物在微生物的作用下生成酯类,因而酯类化合物的质量分数增加,其中接种组中酯类的质量分数发酵结束时的4.4%增长至成熟后的12.23%。
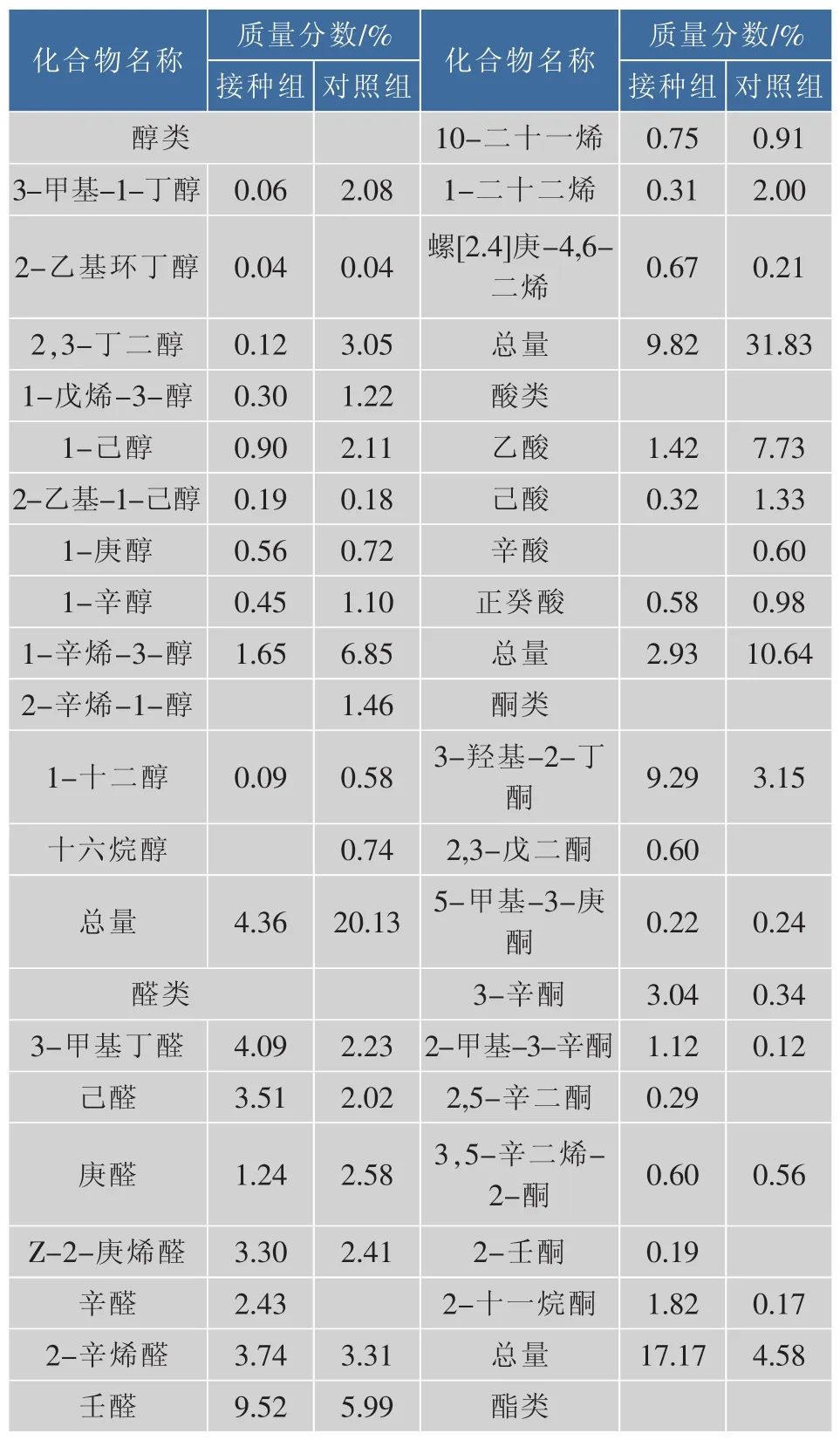
表3 鲢鱼成熟后挥发性风味成分的质量分数Table 3 Mass fraction of volatile compound in curedripening fermented silver carp
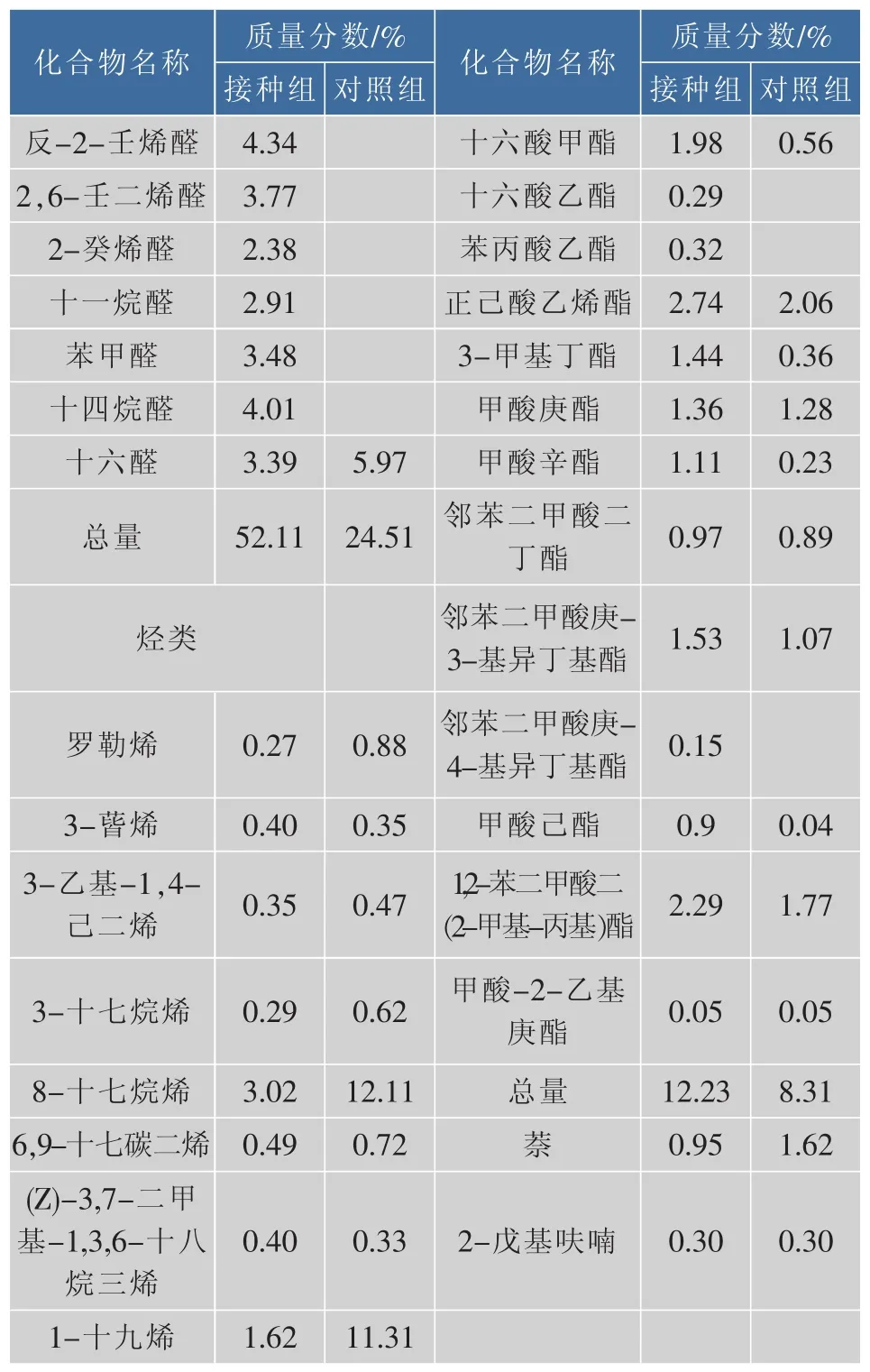
续表3
由表3可以看出,接种组中醛类化合物的质量分数高达52.11%,显著高于对照组的24.51%。醛类化合物主要产生于脂质氧化过程,随着成熟过程的延长,部分醛类化合物会被氧化或还原成相应的酸或醇。醛类物质的阈值较低,并具有脂肪香味,因而对腌腊鱼特征风味的形成具有重要作用。一般的,5-9个碳原子的醛类化合物会产生令人愉快的香味。对照组和接种组中壬醛(脂肪族醛)的质量分数最高,具有甜香和果香。
酮类阈值较低,因而对风味的形成具有重要贡献。其中,接种组与对照组中酮类化合物的质量分数分别为17.17%和4.58%。3-羟基-2-丁酮等甲基酮是腌腊鱼中的代表酮类化合物,由饱和脂肪酸的不完全β氧化生成,与酵母菌和葡萄球菌的发酵有关。
接种组和对照组中分别检出了10种和12种醇类化合物,包括饱和醇和不饱和醇,但对照组中的醇类质量分数高于接种组。直链饱和醇类的阈值较高,因而对腌腊鱼风味的贡献并不大。1-辛烯-3-醇等不饱和醇是风干鲢鱼中的主要醇类,其阈值较低,是风干鲢鱼中的特征风味醇类物质之一。另外,3-甲基-1-丁醇等支链醛一般来自碳水化合物的EMP降解或者氨基酸的埃利希降解。
接种组中酸类化合物的质量分数明显低于对照组,其中,乙酸是接种组和对照组中的主要呈酸物质,由乳酸菌和葡萄球菌经脂肪酸丙氨酸代谢产生。
3 结 语
通过接种复合菌种,加快了发酵鲢鱼在成熟过程的蛋白水解速率,提高了总氮和游离氨基酸的质量分数;接种复合菌种也显著提高了成熟后的发酵鲢鱼中的EPA和DHA的质量分数;接种复合菌对于提高发酵鲢鱼的挥发性风味成分中的醛类、酮类和酯类化合物具有重要作用。由此可知,复合菌种对鲢鱼发酵成熟过程蛋白质的水解、脂质水解和氧化、风味的形成具有重要作用。

