脯氨酸氨肽酶枯草芽孢杆菌分泌表达及特性表征
汪克红, 王开道, 田亚平
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
脯 氨 酸 氨 肽 酶 (prolyl aminopeptidase,PAP,EC3.4.11.5)是一类能特异地水解多肽或蛋白N-端脯氨酸残基的氨肽酶,具有严格的底物特异性,在蛋白类食品水解加工产物苦味的去除[1],胶原蛋白水解等方面都有着较好的应用前景[2]。脯氨酸氨肽酶的来源广泛,在动物[3]、植物和微生物中都有存在,但目前大多数报道的脯氨酸氨肽酶都来源于微生物[4-6]。
目前有关脯氨酸氨肽酶的研究主要集中在基因克隆、分离纯化和性质描述方面,而对脯氨酸氨肽酶的异源表达研究较少,表达量较低,无法进行大规模生产[7]。Bacillus subtilis作为食品安全菌种[8],由于其遗传背景清晰,无致病性,蛋白分泌能力强,无密码子偏好性以及发酵周期短等优点已被广泛用于外源基因的表达宿主[9-10]。本研究将前期从日式酱油成品曲中筛选到的米曲霉胞内脯氨酸氨肽酶的cDNA基因克隆到枯草芽孢杆菌中进行表达,并通过优化培养基组成提高胞外分泌量,从而为工业化生产脯氨酸氨肽酶奠定基础。
1 材料与方法
1.1 菌株与质粒
E.coli JM109、枯草芽孢杆菌WB600、穿梭质粒pMA5、含目的基因的载体pMD19-pap。
1.2 培养基
LB培养基:蛋白胨10 g/L,酵母粉 5 g/L,NaCl 10 g/L,pH 7.0。
TB培养基:蛋白胨12 g/L,酵母粉24 g/L,甘油4 g/L,17 mmol/L KH2PO4,72 mmol/L K2HPO4。
分泌培养基:蛋白胨12 g/L,酵母粉24 g/L,甘油 4 g/L,D-山梨醇 50 g/L,2 mmol/L CaCl2,17 mmol/L KH2PO4,72 mmol/L K2HPO4。
1.3 主要试剂
质粒DNA抽提试剂盒、DNA胶回收试剂盒购自上海生工生物工程股份有限公司;所有的底物均购自瑞士Bachem公司;PrimeSTAR®DNA Polymerase、限制性内切酶、T4连接酶、DNA Marker购自宝生物工程(大连)有限公司;蛋白胨、酵母粉购自Oxoid公司;其他试剂均为国产分析纯。
1.4 酶活测定
以L-脯氨酸-对硝基苯胺为底物 (底物储藏液用Tris-HCl 7.5配制,浓度为4.25 mmol/L),反应体系包括2 mL Tris-HCl 7.5缓冲液,1 mL底物储藏液和 1 mL稀释后的酶液,50℃水浴 10 min,在405 nm处测定吸光值。50℃下每分钟分解PropNA产生1 μmol/L对硝基苯胺所需的酶量为一个酶活单位(U)。
1.5 重组菌株的构建
根据脯氨酸氨肽酶基因序列设计一对引物:上游引物 5'CGGGATCCATGGCTGCCAAAC 3'(BamHⅠ);下游引物 5'CGCGACGCGTCTAATCAATAG AGTC 3'(MluⅠ),从载体 pMD19-pap 上扩增含酶切位点的目的基因。将目的基因与质粒pMA5分别用BamHⅠ和MluⅠ进行双酶切,胶回收纯化后按一定比例混合在16℃金属浴下连接12~16 h并转化E.coli JM109感受态,涂布氨苄抗性的LB固体培养基,待长出转化子后先经菌落PCR初步验证,将验证正确的重组子提取质粒双酶切验证后进行测序。将构建成功的重组质粒电转化进Bacillus subtilis WB600中得重组菌。
1.6 重组菌的发酵表达
将重组 Bacillus subtilis WB600(pMA5-pap)接种于50 mL含卡那抗性的TB培养基,37℃,220 r/min振荡培养24 h。发酵结束后在4℃条件下8 000 r/min冷冻离心10 min,上清液进行胞外酶活的测定。菌体沉淀用Tris-HCl 7.5的缓冲液洗涤两遍后用相同体积的缓冲液重悬,菌悬液按照一定倍数稀释超声破碎后进行胞内酶活的测定。重组菌脯氨酸氨肽酶的表达情况用SDS-PAGE进行检测。
1.7 重组菌胞外分泌策略
通过对TB培养基成分的调整,增加胞外重组脯氨酸氨肽酶的分泌量。
1.8 重组脯氨酸氨肽酶分离纯化
重组菌在分泌培养基中发酵结束后离心得到上清液,上清液经硫酸铵盐析后用50 mmol/L Tris-HCl 6.5缓冲液溶解,然后在此缓冲液中4℃透析过夜,透析后过膜(0.22 μm)作为离子交换层析上样样品。
Hitrap Q HP离子交换层析柱经50 mmol/L Tris-HCl 6.5缓冲液平衡后,上样1 mL,流速1 mL/min,控制NaCl的浓度为0.2、0.3和1 mol/L分三步阶段洗脱各洗10个柱体积,每管收集0.5 mL洗脱液。
将酶活最高的几管合并后用超滤管浓缩,浓缩液用于跑SuperdexTM 75 10/300 GL凝胶柱,上样0.5 mL,流速 0.5 mL/min,50 mmol/L Tris-HCl 6.5 缓冲液进行洗脱,每管收集0.5 mL。上述各部收集液进行SDS-PAGE验证其纯度。
1.9 重组脯氨酸氨肽酶酶学性质
将分离纯化所得脯氨酸氨肽酶于不同pH值下测定其活性,以酶活最高者定义为100%,分别考察其最适pH和pH稳定性。在不同的温度下对重组脯氨酸氨肽酶的酶活进行测定以确定其最适反应温度,将其在系列温度下保温1 h后用1.4节所述方法测定剩余酶活力,以4℃保温的为100%以确定其温度稳定性。
将纯酶液与相应浓度的金属离子MnCl2、MgCl2、ZnSO4、CuSO4、CoCl2、NiSO4及 蛋 白 酶 抑 制 剂PMSF、DTT、β-巯基 乙醇 和 EDTA 在 50 mmol/L Tris-HCl 7.5缓冲液中30℃温浴30 min后用标准方法测定剩余活性以考察金属离子及蛋白酶抑制剂对重组脯氨酸氨肽酶的影响。
将纯酶液分别与 0.5 mol/L 的 NaCl,KCl,Na2SO4和K2SO4(溶于50 mmol/L Tris-HCl 7.5缓冲液中)30℃温浴30 min后用标准方法测定酶活以考察盐的种类对重组脯氨酸氨肽酶的影响,在0~4.36 mol/L NaCl下考察其耐盐性。
分 别 配 置 Lys-pNA,Leu-pNA,Ala-pNA,Met-pNA,Ile-pNA,Val-pNA,Arg-pNA 和 Pro-pNA以考察其底物特异性,以酶活最高者为100%。以不同浓度的L-脯氨酸-对硝基苯胺为底物 (0.2~1.4 mmol/L),用标准方法测定酶活,利用双倒数作图法计算重组脯氨酸氨肽酶的米氏常数Km及其最大反应速率Vmax。
2 结果与讨论
2.1 重组菌株的构建
根据脯氨酸氨肽酶cDNA序列设计引物,将脯氨酸氨肽酶基因从载体pMD19-pap上扩增了下来,两端分别带上了BamHⅠ和MluⅠ酶切位点。按1.5节所述方法构建重组质粒,其双酶切验证结果如图1所示,重组质粒切出了大、小两条带,其大小分别与空质粒和脯氨酸氨肽酶PCR产物相对应,表明重组质粒构建成功。将重组质粒送上海生工测序,测序结果与脯氨酸氨肽酶cDNA序列一致,表明序列没有发生突变。将重组质粒用电转仪在12.5 kV/cm,25 μF,200 Ω,4.5~5.0 ms 条件下电转化进Bacillus subtilis WB600,并在卡那抗性的LB固体培养基上挑选重组子,重组子经PCR快速验证和双酶切验证后表明已构建成功,该重组菌用于脯氨酸氨肽酶发酵表达。
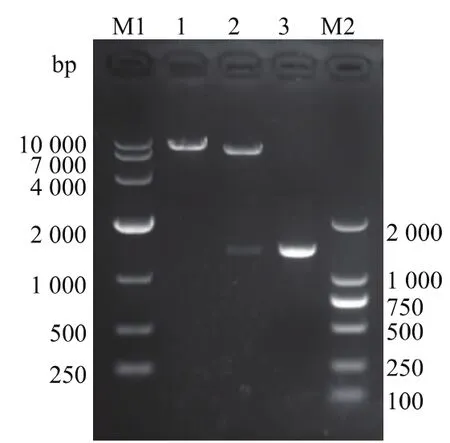
图1 重组质粒双酶切验证Fig.1 Identification of the recombinant plasmid by BamH I and Mlu I
2.2 重组菌发酵表达
重组 Bacillus subtilis WB600(pMA5-pap)按 1.6节所述方法进行发酵表达后,测得其胞外酶活的值为7.5 U/mL,胞内酶活为40.0 U/mL,SDS-PAGE验证结果见图2,由图可以看出在50 kDa处出现了明显的蛋白条带,表明脯氨酸氨肽酶在枯草芽孢杆菌中成功实现了表达。由表达结果看出,虽然有一部分脯氨酸氨肽酶分泌到了胞外,但分泌量较少,大多数还集中在胞内,不利于工业化生产和制备,因此后续将采用一定的手段提高胞外表达量从而简化纯化步骤。
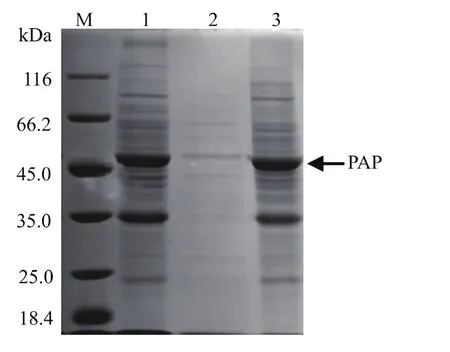
图2 重组脯氨酸氨肽酶表达SDS-PAGE验证Fig.2 SDS-PAGE analysisofrecombinantprolyl aminopeptidase expression
2.3 重组脯氨酸氨肽酶胞外分泌
由于该脯氨酸氨肽酶自身为胞内酶,前期也尝试过加信号肽,但信号肽的添加导致其不能正常表达,因此本研究采用在培养基中添加渗透剂的方法改变细胞膜的通透性以提高胞外分泌量。前期通过实验探索发现D-山梨醇和CaCl2对胞外分泌有促进作用,因此进一步对该两种物质的添加量做了研究,其结果如表1所示,综合考虑对细胞生长的影响确定5%为D-山梨醇的最适添加量,当CaCl2的最终浓度为2 mmol/L时脯氨酸氨肽酶的胞外分泌量达到最大为36.0 U/mL,相比于TB培养基时(7.5 U/mL)提高了4.8倍。
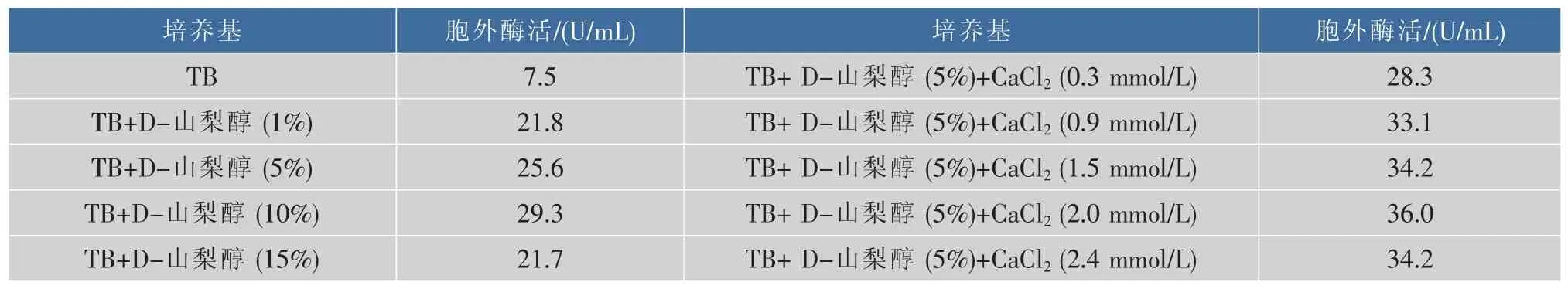
表1 培养基组成对胞外酶活的影响Table 1 Effect of medium composition on extracellular enzyme activity
2.4 胞外脯氨酸氨肽酶的纯化
采用分泌培养基对重组菌进行发酵培养后离心得上清发酵液,发酵液按1.8节所述方法进行纯化,所用硫酸铵盐析的饱和度为40%~50%,纯化结果如表2所示,由表可知,最终纯化所得脯氨酸氨肽酶的比酶活为247.3 U/mg,纯化倍数为8.8倍,收率为1.7%。各步纯化的SDS-PAGE验证结果如图3所示,由图可以看出经superdex纯化后重组脯氨酸氨肽酶达到了电泳纯。
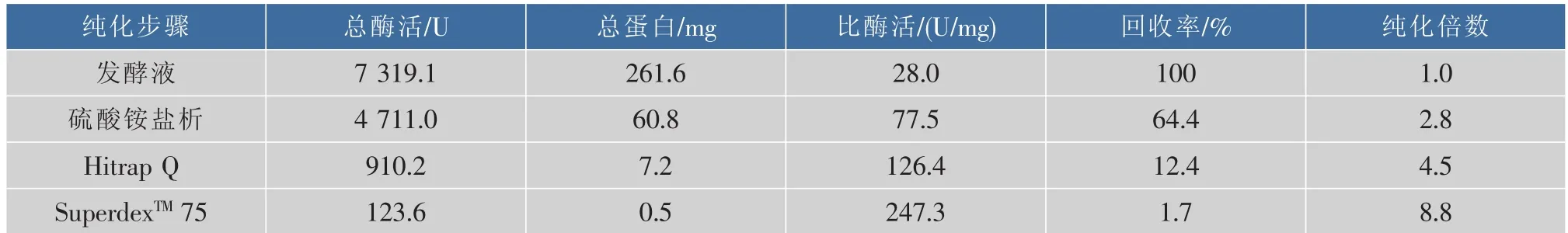
表2 重组脯氨酸氨肽酶纯化结果Table 2 Purification of recombinant prolyl aminopeptidase
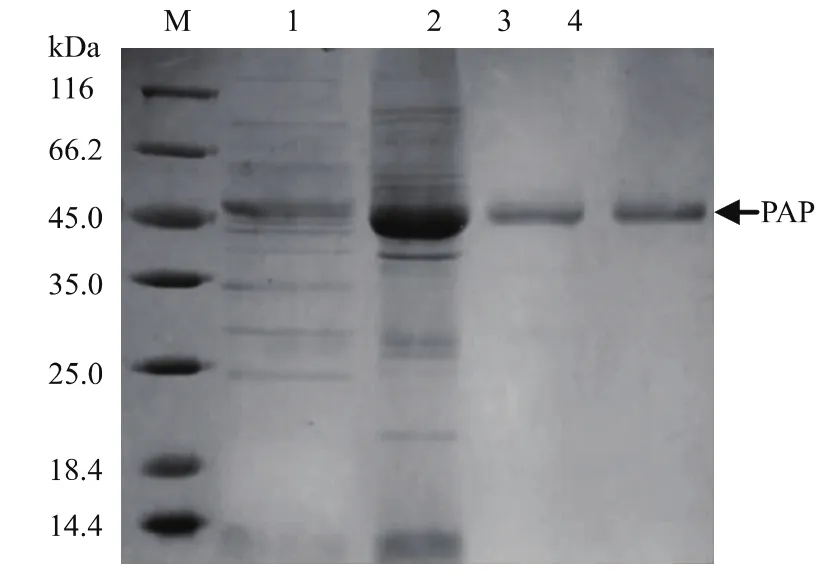
图3 重组脯氨酸氨肽酶各步纯化SDS-PAGE验证Fig.3 SDS-PAGE analysis of purified prolyl aminopeptidase
2.5 重组脯氨酸氨肽酶的酶学性质
该脯氨酸氨肽酶在枯草芽孢杆菌中重组表达后其基本酶学性质变化不大,在50℃时表现出最大的催化活性,在50℃及以下保温后剩余酶活仍有75%以上,当60℃保温1 h后活性基本丧失,说明该酶对高温的耐受性还有待提高[11]。该酶的最适pH值为7.5,与来源于Debaryomyces hansenii(pH 7.5),Penicillium camemberti(pH 7.0)和 Arthrobacter nicotianae 9458(pH 8.0)的脯氨酸氨肽酶的最适pH相近[5,12-13],在 pH 6~11 之间稳定,在酸性环境中酶活丧失严重。在金属离子当中,只有ZnSO4和CuSO4对该酶有较强的抑制作用,在1 mmol/L的浓度下30℃保温30 min后相对酶活仅为2%和5%。该酶为非金属依赖型酶,也不含二硫键,因此EDTA和β-巯基乙醇对酶活性均没有影响。
研究发现该酶具有一定的耐盐性,首先考察了几种盐类对酶活性的影响,结果如图4所示,由图可以看出一定浓度的盐不但对该酶没有抑制作用,反而还有一定的激活作用,且这种激活作用与盐的种类关系不大。进一步用NaCl考察了该酶的耐盐性,发现当NaCl的浓度达到4.36 mol/L时仍有109.5%的相对酶活,说明该酶能耐受较高的盐浓度。脯氨酸氨肽酶的这种耐盐性在别的菌株里也有过报道,Uraji等人[14]发现来源于 Streptomyces aureofaciens TH-3的脯氨酸氨肽酶能耐受4 mol/L的NaCl,且推测脯氨酸氨肽酶的这种耐盐机制可能与其N端氨基酸残基的疏水作用有关,Matsushita-Morita等人[15]报道的米曲霉脯氨酸氨肽酶也具有一定的耐盐性,其盐浓度也能达到4 mol/L,Fukuuchi等人[16]对嗜盐菌里蛋白的氨基酸组成进行了研究,指出蛋白表面的酸性残基可能有助于其适应高盐环境,且过多的具有较小pKa值的天冬氨酸的存在会导致其在高盐浓度下带电形式的酸性残基增加。利用该特性在一些酶解过程中可适量提高盐浓度以更好地发挥酶活性[17]。另外由于米曲霉自身产的脯氨酸氨肽酶只存在于胞内且含量甚微,如果额外添加适量氨肽酶与酱油曲复合使用可提高酱油中氨基酸含量并获得更好的风味。
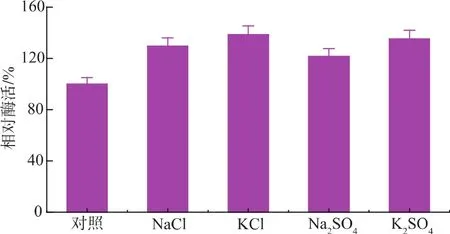
图4 盐种类对重组脯氨酸氨肽酶的影响Fig.4 Effects of several salts on recombinant prolyl aminopeptidase activity
通过对8种AA-pNA进行水解,其结果如图5所示,说明该酶只对Pro-pNA有水解作用,而对其他几种底物均无水解作用,说明该酶对脯氨酸具有严格的底物特异性。用L-脯氨酸-对硝基苯胺为底物,重组脯氨酸氨肽酶的动力学方程如图6所示,根据图中方程计算得米氏常数Km和最大反应速率Vmax分别为 0.171 mmol/L 和 55.99 μmol/(L·min),与大肠杆菌表达的重组脯氨酸氨肽酶(Km和Vmax分别为 0.06 mmol/L 和 28.70 μmol/(L·min)) 相比[18],虽然其对底物亲和力有所降低,却表现出更高的催化效率。
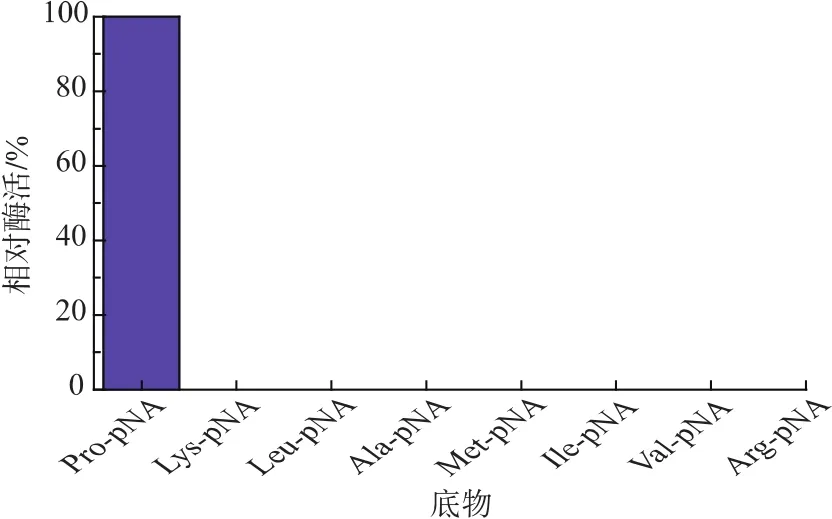
图5 重组脯氨酸氨肽酶的底物特异性Fig.5 Substrate specificity of recombinant prolyl aminopeptidase
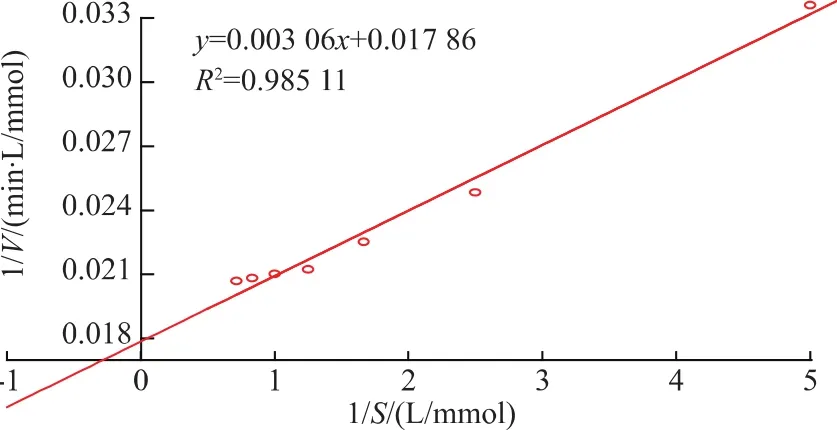
图6 重组脯氨酸氨肽酶Lineweaver-Burk双倒数图Fig.6 Lineweaver-Burk plot of recombinant prolyl aminopeptidase
3 结 语
本研究成功实现了脯氨酸氨肽酶基因在枯草芽孢杆菌中的表达,并通过分泌培养基大大提高了胞外表达量,相比于大肠杆菌其安全性、胞外分泌能力、以及表达量均有所提高。随着生物技术的发展,各种不同类型的氨肽酶的应用和需求也越来越广泛,除了用于蛋白水解和改善风味之外,在医疗诊断与检测、蛋白测序等领域也发挥着日益重要的作用。后续通过带标签表达简化纯化过程,优化放大发酵条件可实现脯氨酸氨肽酶的生产。

