糖蜜对重组谷氨酸棒杆菌产L-丝氨酸的影响
姚丽萍, 陈紫薇, 张晓梅, 许正宏*, 陆茂林
(1.江南大学 药学院,江苏 无锡 214122;2.江苏省微生物研究所有限公司,江苏 无锡 214063)
L-丝氨酸 (L-serine)是人类非必需氨基酸之一,主要应用于医药、化工及食品等多种相关领域。此外,L-丝氨酸作为生物体内重要的一碳单位,是嘧啶、嘌呤等有机物的主要供体[1-2]。L-丝氨酸具有广泛的市场前景及开发潜力[3]。
目前,L-丝氨酸生产方法主要有化学合成法、蛋白水解法及微生物发酵法等[4-8]。其中,微生物发酵法与化学合成法及蛋白水解法相比,具有绿色环保、高效、产物易分离提取等优点[3]。近年来,微生物直接发酵法生产L-丝氨酸的研究主要集中在大肠杆 菌 (Escherichia coli) 及 谷 氨 酸 棒 杆 菌(Corynebacterium glutamicum)上[9-12]。 谷氨酸棒杆菌SYPS-062 33a ΔSSA-PS是本实验室经代谢改造构建的能发酵蔗糖高产L-丝氨酸的菌株,其利用全合成培养基摇瓶发酵120 h,L-丝氨酸产量达25.31 g/L。利用廉价原料发酵一直是生物工程领域的研究热点[13-14],糖蜜作为制糖工业的副产物,含有大量可发酵糖类,同时含有大量的微生物生长所需的微量营养物质,且价格低廉,可作为微生物发酵的替代原料。Wang等[15]利用Bacillus sp.XZL9发酵糖蜜可以获得74.7 g/L的乳酸;Kotzamanidis等[16]以糖蜜为原料,利用Lactobacillus delbrueckii NCIMB 8130发酵生产乳酸,产量达88.0 g/L;Xu等[17]以糖蜜为原料,利用Corynebacterium glutamicum发酵产L-赖氨酸,产量达34.5 mmol/L。但在将糖蜜作为微生物发酵原料时,需进行预处理,以去除其中可能影响微生物发酵的胶体、钙质、灰分等[18-19]。
本文考察了不同的糖蜜预处理方法、添加量对谷氨酸棒杆菌SYPS-062 33a ΔSSA-PS生长及产L-丝氨酸的影响,并初步探讨了糖蜜对丝氨酸合成相关途径中关键酶基因转录水平的影响,为该菌株高效发酵生产L-丝氨酸奠定基础。
1 材料与方法
1.1 材料
甘蔗糖蜜:由山东正信集团提供,总糖量48.20%。
重组谷氨酸棒杆菌(Corynbacterium glutamicum SYPS-062 33aΔSSA-PS)为江南大学药学院制药工程研究室构建并保藏。
1.1.2 培养基 种子培养基(g/L):
A:无水葡萄糖 20,115℃,7 min进行灭菌。
B:BHI 37, (NH4)2SO410,MgSO4·7H2O 0.5,K2HPO40.2,NaH2PO40.3,自然 pH,115 ℃,7 min 进行灭菌。
A+B混匀使用。
发酵全合成培养基(g/L):蔗糖 100,(NH4)2SO430,KH2PO43,MgSO4·7H2O 0.5,FeSO4·7H2O 0.02,MnSO4·H2O 0.02,原儿茶酸 0.03,生物素 0.5×10-3,硫酸硫胺素 4.5×10-3。灭菌条件:115 ℃,7 min。添加糖蜜时,通过换算随后替代蔗糖加入或者添加一定量的糖蜜,定容,分装,灭菌。
1.2 糖蜜预处理方法
1.2.1 EDTA法 糖蜜预先加水稀释成质量比为1∶1的混合溶液,用1 mol/L的HCl调pH至7.0,于沸水中加热30 min,加入质量分数100×10-6的EDTA以加速重金属物质的沉积。将混合物于室温下静置24 h,然后12 000 r/min离心20 min,取上清进行下一步实验。
1.2.2 硫酸法 糖蜜预先加水稀释成质量比为1∶1的混合溶液,用1 mol/L的H2SO4调pH至3.0。将混合物于室温下静置24 h,然后12 000 r/min离心20 min,取上清。将上清用10 mol/L的NaOH调pH至5.5,取上清进行下一步实验。
大部分互联网汽车金融公司规模较小,业务范围难以全面铺开,所以更多地是针对汽车金融的细分市场,如二手车买卖中涉及的贷款。专注细分市场可以有效地满足客户的不同需求,提高客户体验感,有助于深层次地挖掘客户。
1.2.3 磷酸法 糖蜜预先加水稀释成质量比为1∶1的混合溶液,用1 mol/L的H2PO4调pH至3.0。于沸水中加热30 min,将混合物于室温下静置24 h,然后12 000 r/min离心20 min,取上清。将上清用10 mol/L 的 Ca(OH)2调pH 至 5.5,12 000 r/min 离心30 min,取上清进行下一步实验。
1.2.4 活性炭法 糖蜜预先加水稀释成质量比为1∶1的混合溶液,于60℃下静置24 h,经活性炭吸附处理后,12 000 r/min离心30 min,上清进行抽滤,除杂,滤液进行下一步实验。
1.2.5 澄清法 糖蜜预先加水稀释成质量比为1∶1的混合溶液,利用聚丙烯酰胺(PAM)作为糖蜜预处理的澄清剂,于100 mL的糖蜜溶液中分别加入5 mL的21.9 g/L乙酸锌溶液和10.6%的亚铁氰化钾,于室温下静置过夜,促进澄清剂沉积。混合物于12 000 r/min离心20 min,取上清进行下一步实验。
1.2.6 阳离子交换树脂法 糖蜜预先加水稀释成质量比为1∶1的混合溶液,100 mL糖蜜溶液中加入20 g阳离子交换树脂,混合体系于恒温振荡器中,250 r/min,30 ℃振荡 6 h,12 000 r/min离心 20 min,上清用10 mol/L NaOH调pH至5.5,取上清进行下一步实验。
1.3 培养方法
1.3.1 发酵前处理 分别测定原糖蜜及不同预处理后的糖蜜的总糖含量,调总糖含量至10%。
1.3.2 谷氨酸棒杆菌活化 甘油管接种划线于固体种子培养基平板,30℃培养3~4 d。
1.3.3 种子培养 接种一环平板种子于液体种子培养基,30℃,120 r/min培养 28 h,使其 OD562=25。
1.3.4 发酵培养 将种子液接入发酵培养基中,使其初始 OD562=1,30 ℃,120 r/min培养 120 h,每 12 h取一次样,进行数据测定。
1.4qRT-PCR
RNA提取采用RNA抽提试剂盒 (上海生工生物有限公司);逆转录和qRT-PCR分别采用RayScriptcDNA SynthesisKit和 PowerqPCR PreMix试剂盒(上海捷瑞生物公司)。
选择16s(RNA)作为内参基因,并设计相应的扩增引物。根据C.glutamicum ATCC 13032的基因序列,使用DNAMEN软件设计EMP途径相关基因的引物,如表1所示。
1.5 分析方法
生物量测定:取100 μL发酵液用1 mol/L HCl稀释到适宜质量浓度,利用分光光度计于波长562 nm处测定。
氨基酸含量和糖浓度的测定:将不同时间的发酵液于4℃、14 000 r/min离心10 min,上清液用于氨基酸含量和糖浓度的测定。发酵液中蔗糖和果糖及氨基酸含量均采用HPLC测定[20-21]。糖蜜中总糖和葡萄糖含量采用菲林试剂法测定[19]。

表1 相关基因的引物Table 1 Primers list
2 结果与分析
2.1 预处理方法对糖蜜中总糖含量的影响
糖蜜作为制糖工业的副产物,可作为微生物发酵的替代原料[19]。作为微生物发酵原料时,糖蜜需进行预处理,去除其中的胶体、钙质、灰分等。不同的预处理方法使得糖蜜组分及含量具有一定的差异。采用不同方法对糖蜜进行预处理,预处理前后糖蜜中的总糖和葡萄糖含量如表2所示。糖蜜采用硫酸预处理后,促使多糖水解形成单糖形式,菌体可直接利用葡萄糖含量比预处理前增加了4.51倍。采用活性炭法、澄清法和阳离子交换树脂法对糖蜜进行预处理后,总糖及葡萄糖含量与未处理时变化不大。采用磷酸预处理糖蜜可去除大量的灰分和胶体成分,去除杂质较彻底,但同时也损耗了大量的糖类物质,与余炜等[18]研究结果一致。
2.2 糖蜜代替蔗糖为碳源对重组谷氨酸棒杆菌生长及L-丝氨酸生产的影响
摇瓶发酵考察糖蜜对重组菌生长及生产L-丝氨酸的影响,以总糖为10%的糖蜜代替全合成发酵培养基中的蔗糖为碳源进行发酵性能测定,实验结果如表3所示。采用硫酸法、EDTA法和澄清法预处理的糖蜜对重组菌的菌体生长较为有利,而磷酸法和树脂法处理的糖蜜则对其生长不利。但所有预处理后的糖蜜作为唯一碳源时均不利于该重组菌积累L-丝氨酸。总体而言,硫酸法处理的糖蜜对重组菌生长和产酸较好。以糖蜜为原料时,谷氨酸棒杆菌发酵产赖氨酸也有相似的结果[19]。
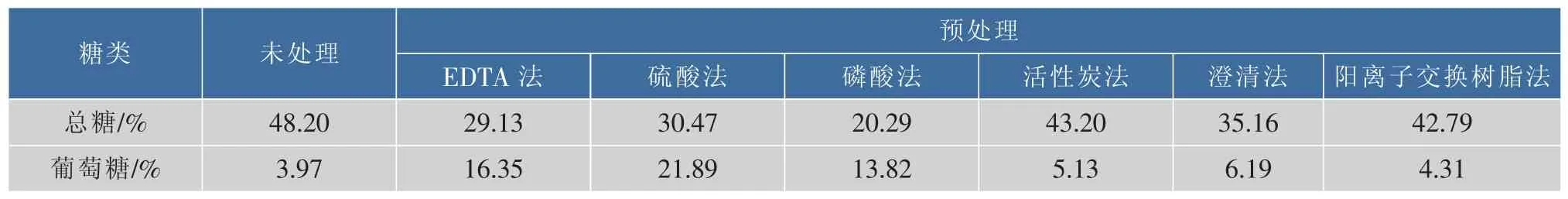
表2 不同方法处理后糖蜜中糖类含量变化Table 2 Concentration of sugar by different methods of molasses
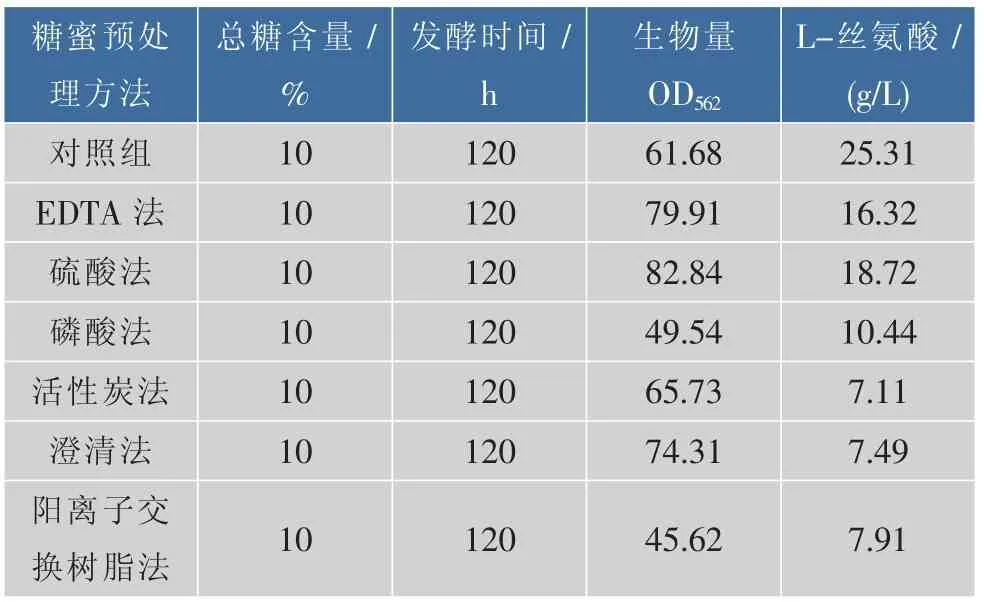
表3 不同预处理方法对重组菌株生长及L-丝氨酸产量的影响Table 3 Effects of different methods of molasses on cell growth and L-serine production
2.3 糖蜜的添加量对重组菌株谷氨酸棒杆菌生长及L-丝氨酸生产的影响
进一步考察了硫酸法预处理的糖蜜的不同添加量对重组菌生长及L-丝氨酸生产的影响,结果如表4所示。蔗糖中添加少量糖蜜有利于菌株生长和产物积累,当培养基中糖蜜的糖量为1%,蔗糖量为9%时为最好。这可能是由于糖蜜中含有的多种营养因子(生物素、维生素等可在一定的质量分数范围内促进微生物生长和产物合成。
进一步考察了低质量分数糖蜜对重组菌生长和L-丝氨酸生产的影响,结果如图1所示。当全合成培养基中添加糖蜜总糖量为0.24%的硫酸预处理糖蜜时,重组菌生物量最高,OD562可达76.37,且L-丝氨酸产量最高,可达32.76 g/L,糖酸转化率为0.33 g/g(表5),比对照组提高了29.44%。上述结果充分说明了糖蜜在该重组菌生长和产物合成中更多发挥了促进剂的作用,而非作为碳源。

表4 糖蜜和蔗糖为混合碳源对菌株生长和L-丝氨酸产量的影响Table 4 Effects of the carbon of molasses and sucrose on cell growth and L-serine production
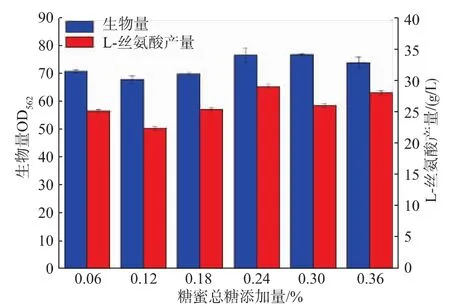
图1 低质量浓度糖蜜添加对菌体生长和L-丝氨酸产量的影响Fig.1 Effects of different molasses addition on cell growth and L-serine production

表5 糖蜜添加量对菌体糖酸转化率和生产强度的影响Table 5 Effects ofdifferentmolassesaddition on productivity and yield of L-serine
在全合成培养基和添加总糖为0.24%的硫酸预处理糖蜜后的发酵过程结果表明(图2),添加少量的糖蜜对菌株生长的迟滞期无明显影响,发酵至84~120 h时,菌株的生长速度较对照组好,发酵至120 h时,实验组OD562可达76.37,较对照组提高了23.82%;L-丝氨酸产量可达32.76 g/L,较对照组(25.31 g/L)提高了 29.44%。
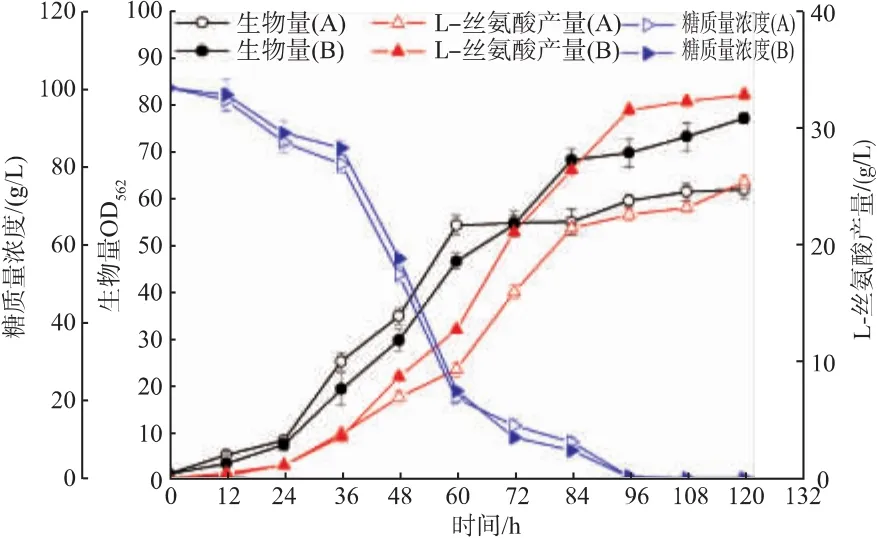
图2 重组菌在不同发酵培养基中的发酵过程Fig.2 Fermentation process of different mediums by the recombinant strain
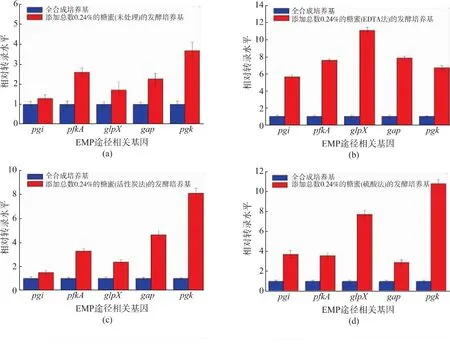
2.4 糖蜜对EMP途径相关基因转录水平的影响
谷氨酸棒杆菌以蔗糖为碳源,经糖酵解(EMP)途径,以3-磷酸甘油酸为前体合成L-丝氨酸。EMP途径与菌体生长有密切关系,实验表明微量糖蜜的添加对菌体生长和积累L-丝氨酸均有促进作用,为此考察了添加总糖量为0.24%的糖蜜 (不同预处理方法)对EMP途径相关基因转录水平的影响,结果如图3所示。添加少量添加糖蜜可促进EMP途径中相关酶基因的转录水平,这可能是促进产物积累的主要原因之一。在实验组(糖蜜处理方法:未处理、活性炭法、硫酸法)中,甘油酸激酶的编码基因pgk的转录水平提高最显著,分别提高了2.68、7.11和9.83倍。在实验组(糖蜜处理方法:澄清法、磷酸法、阳离子交换树脂法)中,甘油醛-3-磷酸脱氢酶的编码基因gap的转录水平提高最显著,分别提高了5.67、7.05和3.34倍。EMP途径的上调可能是由于糖蜜中含有大量的有机酸(柠檬酸、苹果酸和琥珀酸等)、吡啶、金属离子(Ca2+、K+、Mg2+、Zn2+、Fe3+、Mn2+)[22]。吡啶衍生物是维生素、酶的重要组成部分,金属离子可参与酶促反应,提高酶活,增加蛋白表达,蛋白质表达量与基因转录水平在全局层面上有较高的相关性[23-24]。添加糖蜜提高EMP途径相关基

图3 qRT-PCR分析糖蜜对EMP途径相关基因转录的影响Fig.3 Analysis of the effect of molasses on transcription of genes encoding in EMP by qRT-PCR
3 结 语
本文考察了糖蜜预处理方法及糖蜜添加量对C.glutamicum SYPS-062 33a ΔSSA-PS 发酵产 L-丝氨酸过程的影响。以质量分数为9%蔗糖和1%糖蜜总糖为混合碳源有利于菌体生长及产L-丝氨酸。在以10%蔗糖作为碳源时,添加总糖为0.24%的硫酸法预处理糖蜜时,对重组菌株的生长及产L-丝氨酸最有利。同时,低质量分数糖蜜的添加提高了EMP途径关键基因(pgi、pfkA、glpX、gap 及 pgk)的转录水平。在优化的发酵条件下,发酵120 h,菌体生物量OD562、L-丝氨酸产量和糖酸转化率分别为76.37、32.76 g/L和0.33 g/g蔗糖,较对照组分别提高了23.82%、29.44%和29.44%。

