索拉非尼治疗转移性肾癌的临床疗效与安全性
秦 军,武国军,王福利,秦卫军,袁建林
(空军军医大学西京医院泌尿外科,陕西西安 710032)
肾癌发病率占全部肿瘤的3%~5%,在泌尿系统肿瘤中排第3位[1]。其中25%~30%肾癌患者就诊时已有远处转移[2],即使行根治性肾切除术后,30%患者也会出现转移复发[3]。而且,肾癌对传统细胞毒性药物和激素治疗均不敏感。近年来,由于分子靶向药物的临床应用,转移性肾癌患者无进展生存期(progression free survival,PFS)显著提高,其总体生存期(overall survival,OS)从细胞因子治疗时代的12个月提高到分子靶向治疗时代的26个月[4]。
索拉非尼是第一个治疗转移性肾癌的多激酶抑制剂,目前用于一线治疗及免疫治疗失败患者的二线治疗,其疗效主要体现在良好的疾病控制率和显著延长的无进展生存期。本文回顾性分析索拉非尼治疗38例转移性肾癌患者的临床疗效和安全性,同时分析了患者无进展生存期和肿瘤缩小之间的关系,旨在为转移性肾癌临床治疗提供可借鉴的经验。
1 资料与方法
1.1病例资料本研究对2012年8月至2014年9月在西京医院泌尿外科确诊的38例转移性肾癌患者临床资料进行回顾性分析。其中男性14例,女性24例;年龄27~78岁,中位年龄55岁。38例均经病理证实为肾透明细胞癌,肿瘤TNM分期均为IV期;肿瘤远处转移至肺32例,肝3例,骨8例,腹腔淋巴结5例;转移淋巴结数目1个3例,2个10例,3个22例,4个及以上9例。美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分0分者10例,1分者15例,2分者8例,3分者5例。
1.2治疗方案38例患者中,12例既往接受过干扰素治疗;另有18例行原发肿瘤切除术。治疗方案为索拉非尼口服400 mg,2次/d,间隔12 h。给药前后2 h禁止患者食用高脂食物。根据药物不良反应等级调整剂量,必要时剂量减少到400 mg/d,然后降至每隔400 mg/2d(隔日),直至停药。如出现疾病进展,剂量则增至每次600 mg,2次/d。
1.3疗效评价采用实体肿瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)作为疗效判断标准,并通过CT和MRI测量的肿瘤最大直径变化来评价治疗反应和疗效。客观反应率(objective response rate,ORR)用完全缓解(complete response,CR)和部分缓解(partial response,PR)二者总和占全部患者比例评价。疾病控制率(disease control rate,DCR)用CR、PR和疾病稳定(stable disease,SD)三者总和占全部患者比例评价。以首次服用索拉非尼时间为研究起点,研究终点为死亡或末次随访时间,记录分析OS和PFS。治疗后的不良反应事件依据不良事件通用术语标准(Common Terminology Criteria Adverse Events,CTCAE)v3.0对其进行分级。数据统计截止时间内尚存活或中途失访的患者,以最后一次随访日期记录为截尾数据。
1.4统计分析采用SPSS16.0进行统计分析。用Kaplan-Meier法描述患者生存状况。采用t检验对两组数据进行分析,以P<0.05为差异有统计学意义。
2 结 果
2.1临床疗效38例患者总体ORR为21.1%,DCR为52.7%。最佳疗效为PR,有8例(21.1%);其中1例PR患者为干扰素治疗失败后应用索拉非尼治疗12周,胸部CT显示肺转移灶明显缩小,转移灶数目减少。SD患者12例(31.6%),8例患者转移灶数量减少;其转移瘤直径缩小的为中位数11.25%(5%~25%),与治疗前比较有显着性差异(P<0.05)。疾病进展患者18例(47.4%),其中4例原发灶肿瘤直径增大>20%,8例出现腹膜后淋巴结转移,6例发生肺转移;出现淋巴结或肺转移的14例患者最终均进展至死亡。截止数据统计结束,16例患者发生死亡(42.1%),14例死于疾病进展,2例死于心肺疾病。38例患者的中位PFS、中位OS分别为50.5周(95%CI:40.3~59.0)和52.5周(95%CI:43.1~61.4,图1)。进一步分析发现,与20例原发灶未切除患者相比,18例原发灶切除患者口服索拉非尼治疗的PFS和OS均显著延长;而既往使用干扰素治疗则对索拉非尼治疗疗效没有显著影响(图2)。
此外,我们还分析了PFS与肿瘤直径缩小之间的关系,发现16例PR和SD伴肿瘤缩小的患者中,其轻微肿瘤缩小(25%~50%)和显著肿瘤缩小(>50%)间的PFS差异并不显著[(70.58±6.21)dvs.(81.50±2.90)d,P>0.05,图3]。

图1患者疾病无进展生存期(PFS)与总体生存期(OS)
2.2不良反应所有患者在治疗前2周均存在不同程度的不良反应,但经对症治疗和减少剂量后可得到缓解。多数不良反应为1~2级,12例(31.6%)为3~4级(表1)。
最常见不良反应包括:手足皮肤反应(hand-foot skin reaction,HFSR)、高血压、恶心、厌食症、吞咽困难、疲劳、腹泻和口腔溃疡。3~4级毒副反应以高血压(28.9%)、HFSR(13.2%)、吞咽困难(13.2%)、口腔溃疡(10.5%)、腹泻(7.9%)为主。3~4级毒副反应中,高血压和腹泻经对症治疗后缓解,口腔溃疡和吞咽困难症状在整个治疗过程中持续存在,但程度有所减轻。HFSR症状在推荐剂量方案降至400 mg/d后降低,但当剂量调整为400 mg,2次/d时,HFSR又复发;随着治疗的继续,HFSR症状逐渐减轻。实验室异常包括血红蛋白减少(23.7%,3~4级占5.3%)和丙氨酸氨基转移酶水平增加(13.2%);二者变化均是短暂的,很少与临床表现相关,经过适当的对症治疗后可恢复。
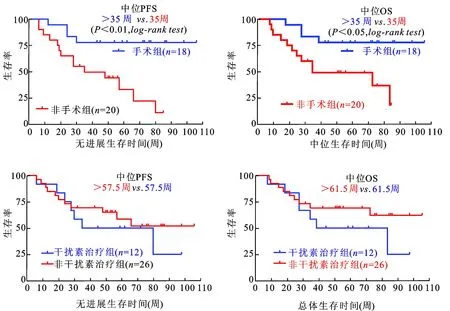
图2患者疾病无进展生存期(PFS)与总体生存期(OS)
表1索拉非尼治疗38例转移性肾癌的不良反应
38例患者中有8例(21.1%)因发生不良事件而减少药物剂量,但未观察到停药和治疗相关的死亡,无住院或治疗相关的持久性或严重残疾。导致剂量减少的最常见不良事件是HFSR(7.9%)、吞咽困难(7.9%)和高血压(5.3%)。
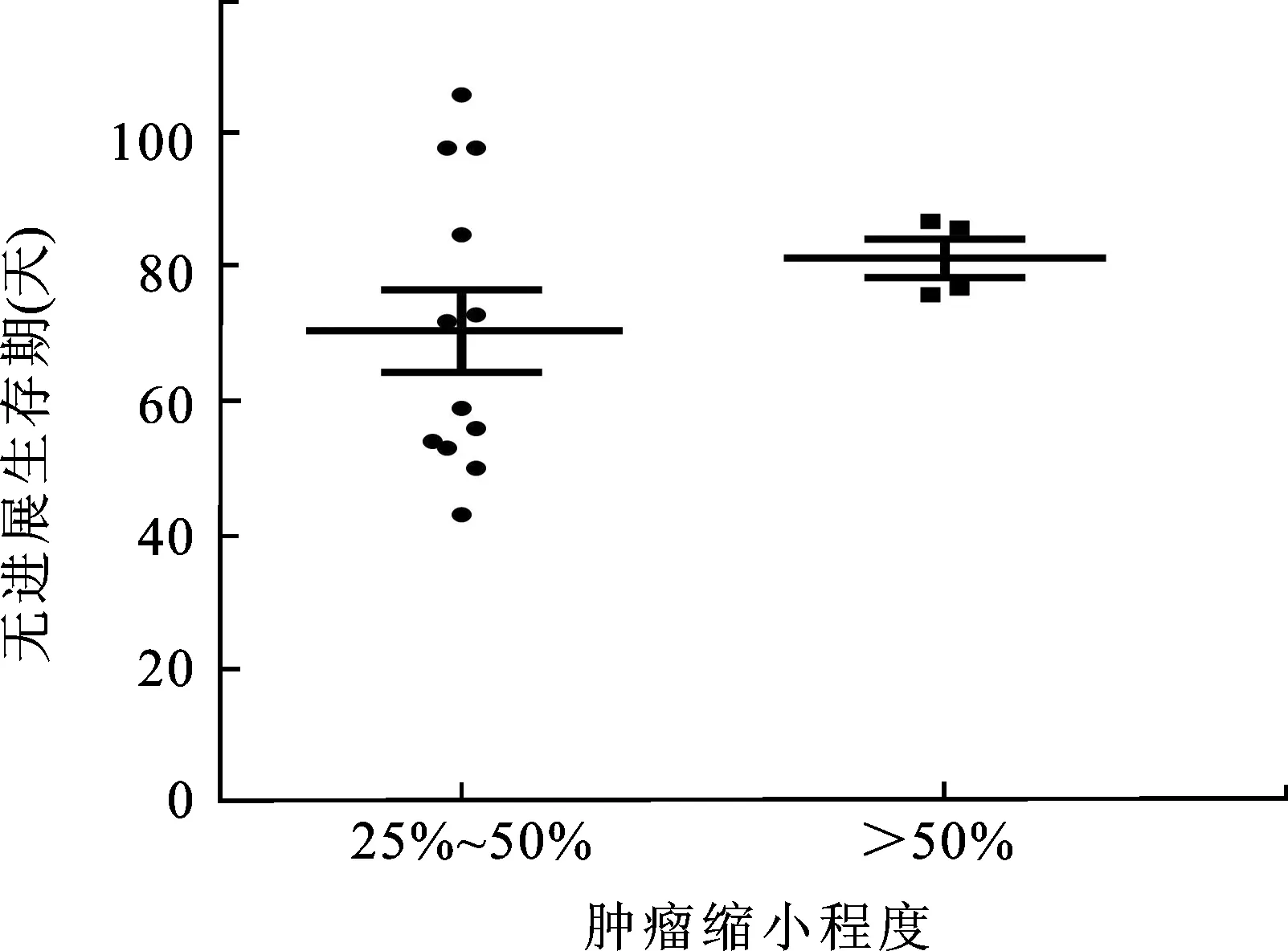
图3 肿瘤轻微缩小(25%~50%)与显著缩小(>50%)的患者PFS比较
3 讨 论
本组研究结果表明,索拉非尼对既往细胞因子治疗失败的转移性肾癌有一定的疗效,患者中位PFS、OS分别为50.5周和52.5周,与ESCUDIER等[5]报道Ⅲ期临床试验和后续扩大准入试验(EU-ARCCS,NA-ARCCS,AUS1)[6]相比,中位PFS显著延长;另外,本研究与以往针对中国肾癌患者的数个单中心及多中心研究结果相一致[7-13],这说明索拉非尼对于中国患者PFS的疗效优于欧美患者。OS方面,本研究结果与欧美及中国多中心报道均一致,中位OS为13.1~17.8月。我们研究结果显示,患者对索拉非尼的ORR 为21.1%,DCR为52.7%,均低于欧美及国内多中心报道的结果(>80%)。这可能和本研究随访时间较短,患者病灶浸润及恶性程度更高等因素有关。根据ESCUDIER等[5]研究结果,索拉非尼开始的治疗标准建议是作为细胞因子治疗失败后的二线治疗 。本研究发现,干扰素治疗失败后进行索拉非尼治疗,并不能显著提高患者的生存期;但是,在手术切除原发灶后使用索拉非尼治疗,其疗效则显著高于未切除原发灶组。随后,索拉非尼又被证明是一种有效的一线治疗,189例患者中,一线索拉非尼与一线干扰素治疗相比,索拉非尼剂量增加至超过400 mg 2次/d时,其疗效显著提高(PFS:79.4%vs.64.1%)[14]。因此,美国和欧洲医学肿瘤学学会(European Society for Medical Oncology,ESMO)建议:索拉非尼作为转移性肾癌的标准二线治疗药物或一线治疗备选药物[3,15]。
本研究结果表明,肿瘤缩小微弱(25%~50%)与缩小显著(>50%)的患者相比,PFS没有显著差异。同样,Ⅱ期随机对照试验也显示肿瘤缩小25%~50%和缩小>50%的患者之间的PFS没有差异[16]。从索拉非尼治疗的分子机制来看,其对疾病进展的控制似乎与肿瘤大小的减少无关,而与抑制肿瘤血管生成和肿瘤细胞坏死有关。另外,本组中有5例患者(13.2%)其原发肿瘤和肺转移瘤对索拉非尼治疗的反应不同,表现为肺转移瘤不同程度缩小和数量减少,而原发肿瘤无明显减少。可能由于原发肿瘤和转移瘤具有不同的基因/蛋白表达谱和细胞生物学特征,导致了治疗反应不同[17]。就索拉非尼治疗靶点血管内皮生长因子(vascular endothelial growth factor,VEGF)和血小板衍生生长因子(platelet derived growth factor,PDGF)而言,其在转移性肿瘤血管中表达明显高于原发灶,故应用索拉非尼治疗时会引起肺转移瘤缩小和数量减少。
我们研究结果中,索拉非尼的安全性与以往国内的多中心研究结果一致,体现为不良事件类型相似,但发生的级别与频率不同[7-11]。例如,高血压发生率高(52.6%vs.21%~36%),腹泻发生率较低(28.9%vs.33%~63%),而HFSR(76.3%vs.58%~80%)和乏力、厌食、恶心等(39.5%~50%vs.15%~68%)的发生率则相似。患者文化差异和疾病进展程度不同可能是导致不良事件发生率差异的原因。研究表明,HFSR的出现与药物疗效呈正相关,可能是治疗效果的相应信号[18]。据报道,肾癌患者中索拉非尼积累越多,HFSR发病率就越高[19]。在我们的临床实践中,1~2级HFSR无需治疗,3级以上HFSR出现影响手部运动时可给予对症治疗,但通常没有必要停药或减少剂量。
高血压是索拉非尼治疗中常见的副作用,发生率在41%~49.7%;且有研究认为,高血压是索拉非尼抗肿瘤疗效的体现[3,20]。因此,索拉非尼治疗过程中需定期监测血压。研究表明,高血压的发生主要是VEGF抑制,内皮细胞释放一氧化氮(nitric oxide,NO)减少,内皮通透性降低,血管收缩以及肾素-血管紧张素-醛固酮系统的改变所致。常规抗高血压治疗如血管紧张素转换酶抑制剂和血管紧张素Ⅱ受体拮抗剂能够长期有效地控制血压,此外降低用药剂量也可恢复血压。本研究的11例(28.9%)3~4级高血压患者中,9例采取常规降压治疗,2例采取了减少剂量的治疗策略。索拉非尼主要由肝脏细胞色素P-450酶家族重要成员CYP3A4代谢清除,其药代动力学会受影响此酶功能的药物影响;索拉非尼与CYP3A4诱导剂共同使用可致其血浆浓度降低,应避免或监测其毒性[20-21]。
本组研究中,5例患者(13.2%)谷丙转氨酶升高,这一副作用在CHENG等[22]的研究试验中亦有报道。经治疗4周后,患者谷丙转氨酶升高,经谷胱甘肽和多烯磷脂酰胆碱肝保护治疗4周后恢复,治疗过程中我们维持了索拉非尼常规剂量。
本研究表明,索拉非尼对于转移性肾癌患者是一种有效的治疗药物。虽然本研究中没有出现完全缓解病例,但肿瘤控制率和PFS均较好。对于低ECOG评分或预后较差患者而言,该治疗方案耐受性好,安全性亦可接受。尽管新型分子靶向药物如贝伐珠单抗、帕唑帕尼、依维莫司、阿昔替尼已逐渐应用于临床,但至少目前索拉非尼仍是不可替代的转移性肾癌治疗药物。肾癌分子靶向治疗药物的未来发展趋势,将是依据预测因子(如HRSF、血压升高)或生物标志物(如血清VEGF水平)选择对索拉非尼有良好反应的患者进行精准医疗,或序贯使用针对VEGF主要信号通路和针对mTORC1、MET、IL-8次要信号通路的抑制剂或抗体药物进行联合治疗。

