某市15家疫苗接种单位第二类疫苗管理现状与对策分析
钱叶梅,林 腾
(铜陵市义安区食品药品监督管理局,安徽 铜陵 244105)
2016年,山东问题疫苗案件暴露了第二类疫苗冷链运输环节的诸多问题,为保证第二类疫苗的配送及质量安全,国家修订了《疫苗流通和预防接种管理条例》(以下简称《条例》)[1]。新修订的条例进一步明确了疫苗在储存、运输、供应、销售、分发和使用等环节中的质量保障要求。为保证疫苗质量安全、掌握第二类疫苗管理现状,2017年7月,安徽省食品药品监督管理局在全省范围内开展了第二类疫苗配送企业、疾病预防控制机构及预防接种单位疫苗质量专项监督检查工作[2]。
安徽铜陵市某区食药监管部门依据工作要求对辖区内15家疫苗接种单位第二类疫苗管理情况进行了监督检查,检查中发现了较多问题。为深入了解该区疫苗接种单位第二类疫苗管理现状,笔者对监督检查资料进行了整理和分析,并从药品监管的角度提出了一些监管建议,旨在供同行参考。
1 资料和方法
1.1 资料来源
2017年8~10月,安徽省铜陵市某区食药监管部门对辖区内15家预防接种单位第二类疫苗管理情况进行了监督检查。本研究以该15家第二类疫苗预防接种单位为基础资料。
1.2 方法
(1)问卷调查:通过自制调查问卷对15家接种单位疫苗管理人员资质、冷链运输设施设备等情况进行调查分析。(2)监督检查:按照《安徽省预防接种单位第二类疫苗监督检查表》[2](以下简称 《检查表》),对15家预防接种单位第二类疫苗管理情况整理、归纳、分析。该验收表共包括4部分10项内容,10项分别为:疫苗供应与分发项共1项检查内容(序号1),疫苗收货与验收共2项检查内容(序号2~3),疫苗储存与养护项共 5 项检查内容(序 4~8),调配与使用项共2项检查内容(序号9~10)。
1.3 统计分析
将问卷调查和监督检查得到的全部研究数据均用Excel表格统计分析。
2 结果
2.1 疫苗接种单位第二类疫苗管理人员情况分析
15家疫苗接种单位中,3家为县级接种单位(二级甲等医院2家,县级疾病预防控制中心1家),其疫苗管理人员数量较少、疫苗管理人员资历较低;12家为县级以下接种单位 (乡镇卫生院),91.7%(11家)的乡镇卫生院仅有1人负责疫苗的质量管理、接种工作,且其学历、资历均较低。详见表1。
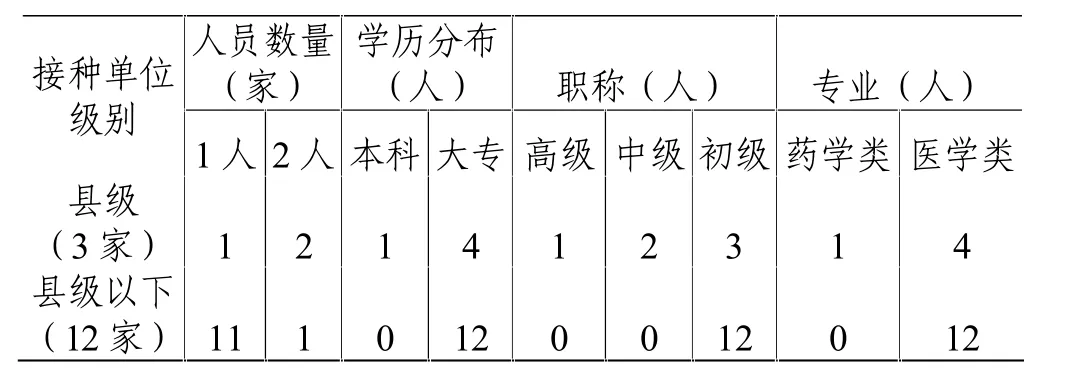
表1 15家疫苗接种单位第二类疫苗管理人员资质一览表
2.2 疫苗接种单位冷链设施设备情况分析
15家疫苗接种单位均配备了疫苗储存用冰箱和运输用冷藏箱,且其配备数量与理论需求量基本相适应[3];除县级接种单位外,乡镇卫生院均未配备发电机,这在疫苗养护方面存在安全隐患。在监督检查中发现,各级接种单位冰箱和冷藏箱均有不同程度损坏、故障或停用现象发生,如在12家乡镇卫生院中,配备的24台冰箱中有12台(50.0%)故障或停用,配备的12个冷藏箱中有5个(41.7%)故障或停用,导致部分疫苗接种单位冰箱内疫苗拥挤。详见表2。
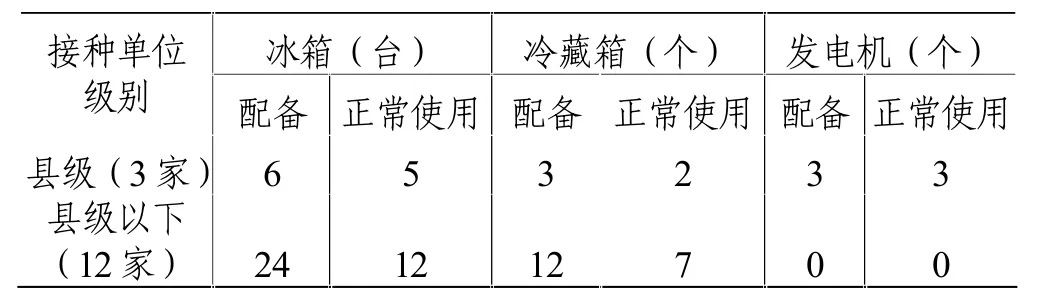
表2 疫苗接种单位冷链设施设备情况一览表
2.3 疫苗接种单位疫苗管理主要缺陷分析
监督检查中,15家疫苗接种单位第二类疫苗管理方面累计存在90项缺陷,其中:(1)疫苗供应与分发项共6项缺陷(6.7%),均为上级机构供应、分发疫苗手续不完整或接种单位未能严格保管疫苗结交凭证;(2)疫苗收货与验收共25项缺陷(27.8%),主要为接种单位在疫苗收货、验收时未索要疫苗在途运输温度记录或记录不完整、疫苗验收记录不完整如未能详细记录疫苗基本信息等;(3)疫苗储存与养护项共42项缺陷(46.7%),主要为未能采用温度计每天上午和下午对冰箱进行温度监测和记录、疫苗养护不符合要求、疫苗储存设施设备不能满足要求等;(4)疫苗调配与使用项共17项缺陷(18.9%),主要为部分接种单位冰箱内可见过期疫苗、未能及时收集并上报疫苗不良反应 (adverse drug reaction,ADR)等。其缺陷分布情况详见图1和表3。
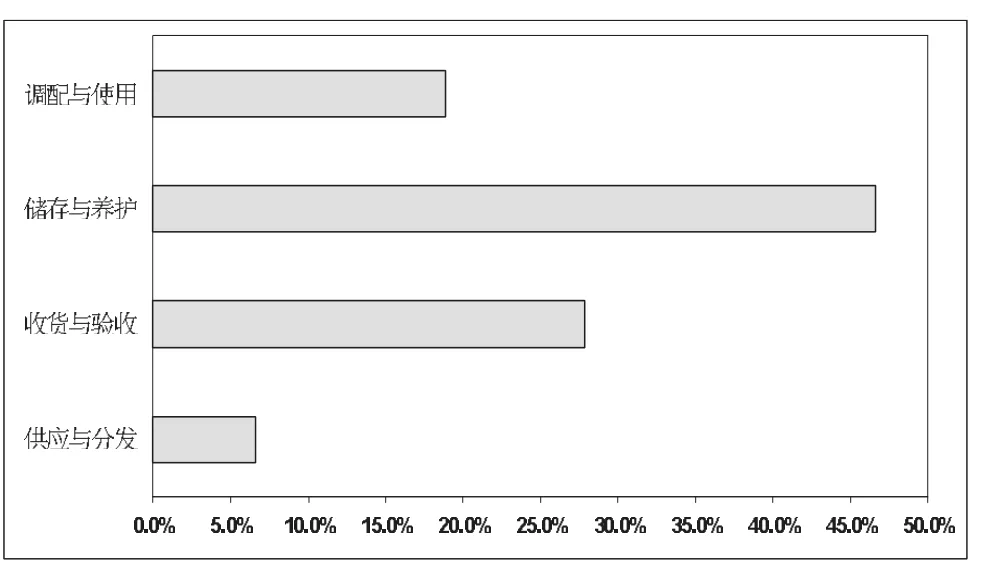
图1 15家疫苗接种单位疫苗管理主要缺陷分布
3 讨论
3.1 疫苗接种单位责任意识不强,管理人员数量不足
本文分析发现,该辖区3家县级接种单位中有1家仅安排了1名初级药学职称的工作人员负责疫苗的质量管理、接种工作,且工作任务内容多、工作任务繁重,凸显了其疫苗管理人员数量较少、疫苗管理人员资历较低的现象。这种现象在乡镇卫生院更为严重。经统计该辖区疾病预防控制中心疫苗采购与分发表,该区乡镇卫生院第一类疫苗数量为12种,第二类疫苗数量为14种,且其疫苗储备量为2个月以上苗量,疫苗种类多、数量大、管理要求高现象十分凸出。而91.7%的乡镇疫苗接种单位均仅有1人负责疫苗的质量管理与日常接种工作,这显然不能满足疫苗日常管理的需求。
导致上述现象发生的一个重要原因是疫苗接种单位责任意识不强,管理者没有正确认识到疫苗管理的重要性、必要性以及接种单位的相关责任,导致管理人员数量不足、资历较低现象普遍发生。为提高接种单位责任意识,缓解其管理人员数量不足现象,笔者认为:首先,疫苗接种单位应认真学习疫苗质量管理相关法律法规,增强责任意识和服务能力;其次,接种单位应创造条件增加疫苗管理人员数量、提高疫苗管理人员资质,从事疫苗管理工作的人员也应注重提升自身素质[4]。

表3 15家疫苗接种单位疫苗管理主要缺陷一览表
3.2 疫苗接种单位质量意识不强,收货验收流于形式
通过分析监督检查结果,笔者发现,15家预防接种单位第二类疫苗管理方面,疫苗收货与验收环节存在25项缺陷(27.8%),提示疫苗接种单位疫苗质量意识不强。主要为:(1)接种单位在疫苗收货、验收时未索要疫苗在途运输温度记录或记录不完整。监管部门和接种单位双方均应高度重视该条缺陷,新修订的《条例》第十六条规定和《疫苗储存和运输管理规范(2017年版)》第十二条均规定,疫苗的储存与运输均应详细填写“疫苗运输温度记录表”[5],但部分接种单位未能严格按照要求记录相关数据或未能提供在途运输温度记录。(2)疫苗收货、验收记录不完整。如11.1%缺陷体现在接种单位疫苗验收记录不完整,具体表现为不能详细记录疫苗基本信息或信息记录不全面,存在质量追溯隐患。(3)疫苗质量相关记录未保存至超过疫苗有效期2年备查。《条例》第十七条和疫苗储存和运输管理规范(2017年版)》第二十一条均对相关记录保存期限作出了明确规定,对于疫苗质量全程追溯具有重要意义[6-7]。但部分接种单位质量意识不强,收货与验收环节的工作流于形式,应高度重视。
3.3 疫苗接种单位管理意识不强,储存与养护条件差
在疫苗储存与养护环节,本文共发现42项缺陷(46.7%),在各类缺陷中位居第一,说明疫苗储存与养护环节仍是影响疫苗质量的关键环节,而疫苗接种单位缺乏足够的管理意识,提示监管部门应特别重视该环节。《中华人民共和国药品管理法》和《条例》规定,疫苗储存应有与实际相适应的储存条件、运输设备,并应有专人负责设施设备的管理和维护。但本调查分析发现,15家疫苗接种单位冰箱和冷藏箱均有不同程度损坏、故障或停用,这在疫苗养护方面存在安全隐患。此外,相关法律法规要求对疫苗做好日常养护,该辖区10.0%的缺陷项目为疫苗管理人员不能按照要求记录冰箱温湿度或温湿度超过规定的要求后不能及时采取有效调控措施。8.9%的缺陷项目为无应急备用方案或设施设备,如15家接种单位均未配备发电机,提示部分接种单位在疫苗管理应急方面存在较大隐患。疫苗接种单位应在疫苗运输、储存冷链设施设备方面增加投入,改善疫苗储存与养护条件。
3.4 监管部门须完善监管体制机制,强化日常监管
综合全文,笔者认为,药品监管部门应完善相关体制机制,从多方面强化日常监督管理。首先,药品监管部门和卫生计生部门应加强对接种单位和社会公众的宣传教育工作[8],一方面从根本上提高接种单位的责任意识、质量意识和管理意识,另一方面提高公众的自我保护能力,增强对接种单位的约束能力。其次,药品监管部门在日常监督检查中应严格按照《条例》和《疫苗储存和运输管理规范(2017年版)》要求,对接种单位质量管理制度、疫苗收发、存储、使用等全环节逐条开展监督检查,应给予疫苗存储环节更多关注,消除或减少该环节的风险。对与检查中发现违反《条例》的,必要时应给予相应的行政处罚或移交卫生计生部门处理。再次,药品监管部门的各类监督检查结果应及时向社会公布,接收社会监督,吸引公众参与监督管理,共同提高辖区内疫苗监督管理水平。

