焦脱镁叶绿酸甲酯介导光动力抑制人乳腺癌细胞MCF-7迁移
黄礼义,林海丹,虞乐华,白定群
(1. 重庆医科大学附属第一医院康复医学科,重庆 400016;2. 重庆医科大学附属第二医院康复医学科,重庆 400010)
乳腺癌是女性最常见的恶性肿瘤,其发病率和死亡率在女性癌症中居首位[1-2]。造成乳腺癌患者死亡的主要原因是肿瘤转移[3],因此,控制肿瘤转移是治疗乳腺癌的主要目标之一。光动力疗法(photodynamic therapy, PDT)是一种结合光敏剂(photosensitizer, PS)和特定波长光的新型疗法,通过活性氧(reactive oxygen species, ROS)的产生发挥光化学作用,其安全性高、副作用小,广泛应用于临床各种肿瘤治疗[4]。焦脱镁叶绿酸甲酯(pyropheophorbide-a methyl ester,MPPa)是一种叶绿素衍生物,属于第二代光敏剂。本课题组前期实验表明,MPPa介导光动力可以诱导人乳腺癌细胞和人卵巢癌细胞凋亡[5-6],从而发挥治疗作用,但是MPPa介导光动力对乳腺癌细胞迁移能力的影响尚未见报道。本研究拟探讨MPPa介导光动力对人乳腺癌细胞MCF-7迁移能力的影响,以期为乳腺癌的治疗提供新的思考。
1 材料与方法
1.1材料
1.1.1细胞与试剂 人乳腺癌细胞MCF-7由重庆医科大学生命科学研究院惠赠。光敏剂MPPa(美国 Sigma-Aldrich 公司),以二甲亚砜(DMSO)溶解至10 mmol·L-1,避光储存于-80 ℃冰箱;LED光源(重庆京渝激光科技有限公司);胎牛血清FBS(德国PAN公司);RPMI 1640培养基(美国Gibco公司); CCK-8(日本同仁公司);DCFH-DA(美国 Sigma-Aldrich 公司);Transwell小室(美国Millipore公司);E-钙黏蛋白(E-cadherin)抗体、PTEN抗体、Akt抗体、p-Akt 抗体(美国CST公司)。
1.1.2仪器 细胞培养箱、全波长酶标仪(美国 Thermo Scientific 公司);高速离心机(美国 Sigma 公司);生物显微镜(日本 Olympus 公司);倒置荧光显微镜(德国Zeiss公司);电泳仪(美国 Bio-Rad 公司);化学发光成像系统(法国Vilber Lourmat公司)。
1.2方法
1.2.1细胞培养及分组 人乳腺癌细胞MCF-7于37 ℃、5% CO2条件下,在含10%胎牛血清和1%双抗的RPMI 1640培养基中培养。将处于对数生长期的MCF-7细胞随机分为对照组、单药组(仅MPPa处理)、单光组(仅光照处理)和MPPa-PDT组(MPPa和光照处理)。细胞贴壁后,单药组和MPPa-PDT组更换为含2 μmol·L-1MPPa 的培养基避光培养,对照组和单光组更换为等体积的完全培养基。24 h后,去除MPPa并接受光照处理,连续输出方式,功率密度30 mW/cm2。
1.2.2CCK-8检测MCF-7细胞活性 MCF-7细胞以5×103个/孔接种于96孔板中,待其贴壁后进行分组,并进行光动力处理,光敏剂浓度为0、0.5、1、2、4 μmol·L-1,光照时间为0、30、60、90、120 s,光照能量为0、0.9、1.8、2.7、3.6 J/cm2(光照能量=光照时间×功率)。24 h后,更换培养基为含10% CCK-8试剂的无血清培养基,将细胞放入孵箱中继续培养,酶标仪检测450 nm波长下各孔的吸光度。按公式计算细胞存活率:存活率=(实验组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值)×100%。空白对照组为含CCK-8培养基而不含细胞的孔,阴性对照组为含CCK-8培养基和细胞的孔,实验组为含CCK-8培养基和细胞且受处理的孔。
1.2.3DCFH-DA染色检测MCF-7细胞内ROS的产生 MCF-7细胞以5×103个/孔接种于96孔板中,待其贴壁后,随机分组进行光动力处理,1 h后去掉原培养基,PBS洗涤细胞2次,加入10 μmol·L-1DCFH-DA无血清培养基,在孵箱中继续培养30 min。弃培养基,PBS洗涤细胞2次,荧光显微镜下观察并拍照。
1.2.4Transwell实验观察MCF-7细胞迁移能力 MCF-7细胞以1×105个/孔接种于6孔板中,随机分组后接受相应处理。Transwell小室放置于24孔板中,光动力处理后12 h消化细胞,无血清培养基重悬,以1×105个/孔接种于Transwell小室中,下室加入750 μL完全培养基,在孵箱中继续培养24 h。取出细胞,PBS洗2遍,棉签刮去上室中未迁移的细胞,多聚甲醛固定上室及下室30 min,三蒸水清洗小室2次,结晶紫染色5 min,三蒸水清洗2次,晾干后于显微镜下观察并拍照。
1.2.5细胞划痕实验观察MCF-7细胞迁移能力 MCF-7细胞以1×105个/孔接种于6孔板中,光照前使用100 μL枪头在孔板中划痕,PBS洗2遍,更换培养基为无血清培养基后接受光照处理。于孵箱中继续培养,并于0、24、48 h在显微镜下观察并拍照。
1.2.6Western blot 检测E-cadherin、PTEN、Akt、p-Akt蛋白的表达变化 MCF-7细胞接受相应处理后,于冰上加入裂解液(RIPA ∶PMSF=100 ∶1)裂解10 min,细胞刮刮下细胞,超声粉碎5次,12 000×g离心15 min,BCA法测定蛋白浓度,最终配平为等浓度、等体积的蛋白样品。SDS-PAGE后,湿转法将蛋白转移至PVDF膜,5% 脱脂奶粉封闭2 h,孵育一抗4 ℃过夜,孵育二抗后显影。

2 结果
2.1MPPa-PDT抑制MCF-7细胞活性如Fig 1所示,低浓度的MPPa(0~2 μmol·L-1)和单纯光照对MCF-7细胞活性无明显影响,高浓度的MPPa(4 μmol·L-1)对MCF-7细胞活性有较明显的影响(P<0.05),因此,选择2 μmol·L-1MPPa 用于后续实验。MPPa联合光照处理对细胞活性有明显的抑制作用,其抑制作用呈剂量依赖性。光能量密度为0.9 J/cm2时,细胞存活率为(52.8±2.20)%,后续实验即采用该能量密度。
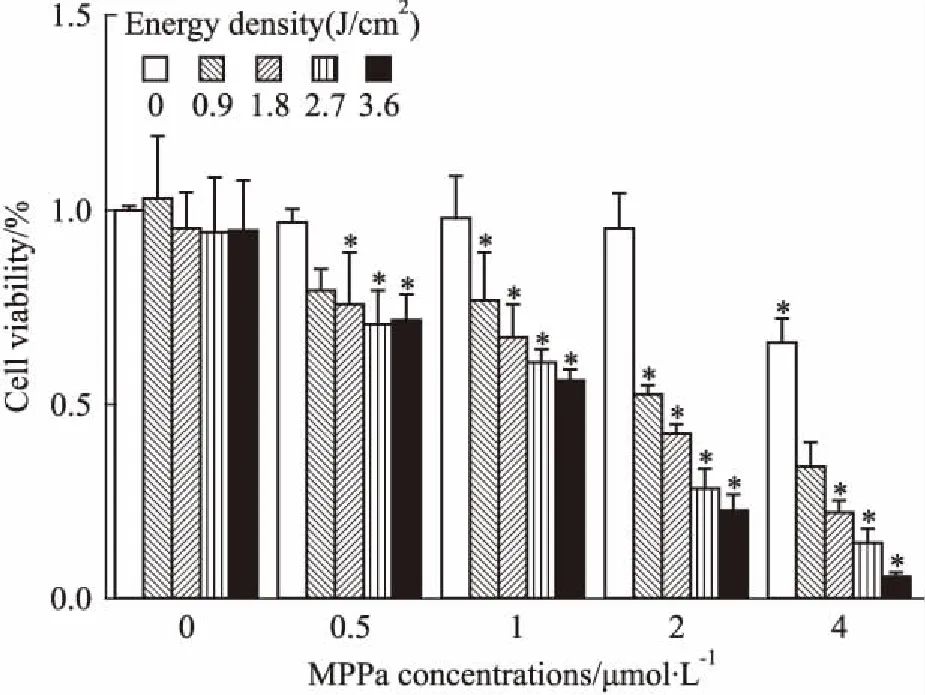
Fig 1 Effect of MPPa-PDT on MCF-7 cell
Energy density(J/cm2)=Power density(30 mW/cm2)×Illumination time(s).*P<0.05vscontrol group.
2.2MPPa-PDT诱导MCF-7细胞内ROS产生如Fig 2所示,ROS可将不带荧光的DCFH-DA氧化为带绿色荧光的DCF,DCF的量可以反映细胞内ROS的量。MPPa-PDT处理后,细胞内ROS明显增加,荧光强度高于对照组、单药组和单光组(P<0.05),三组间差异无统计学意义。上述结果表明,MPPa-PDT可诱导MCF-7细胞产生ROS。
2.3MPPa-PDT抑制MCF-7细胞迁移Fig 3的Transwell结果显示,与对照组、单药组、单光组相比,MPPa-PDT组MCF-7细胞迁移数量明显低于其他3组(P<0.05),三组间差异无统计学意义。Fig 4的划痕实验结果显示,24 h时,MPPa-PDT组与对照组之间细胞迁移差异不明显,48 h时,对照组细胞迁移面积明显大于MPPa-PDT组,差异有统计学意义。上述结果表明,MPPa-PDT可以抑制MCF-7细胞的迁移能力。
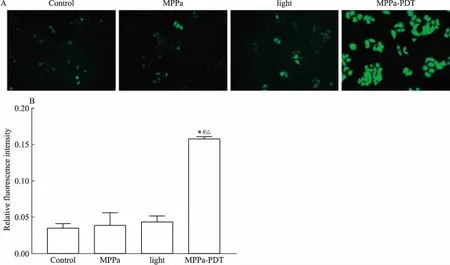
Fig 2 Production of ROS and quantification in MCF-7 cells(×400)

Fig 3 Migration of MCF-7 cells inhibited by MPPa-PDT(×400)
2.4MPPa-PDT对E-cadherin、PTEN、Akt、p-Akt蛋白表达的影响如Fig 5所示,MPPa-PDT组E-cadherin、PTEN蛋白表达高于空白组、单药组和单光组(P<0.05),p-Akt蛋白表达低于空白组、单药组和单光组(P<0.05),且3个对照组间差异无统计学意义,Akt蛋白表达4组间无明显差异。
3 讨论
肿瘤转移是肿瘤治疗效果不佳和肿瘤相关性死亡的主要原因之一[7]。目前,乳腺癌的治疗主要以外科手术和药物为主[8],但外科手术和化疗药物会带来严重的副作用,因此,寻找安全有效、毒副作用低的治疗方法显得尤为重要。研究表明,MPPa-PDT可以诱导肿瘤细胞凋亡、坏死和自噬,但MPPa-PDT对肿瘤迁移的研究尚未见报道。本研究探讨MPPa-PDT对人乳腺癌细胞MCF-7迁移能力的影响及其可能的机制,期望为临床治疗乳腺癌提供思路。实验结果表明,2 μmol·L-1MPPa 联合0.9 J/cm2光能量密度可以明显抑制MCF-7的细胞活性。
单独应用一定浓度的光敏剂或者光照通常对细胞无明显毒性,但当二者结合时所产生的ROS会对细胞造成明显的影响。ROS是PDT治疗效应的核心部分,它参与广泛的细胞信号转导,研究表明,PDT通过ROS产生,抑制肿瘤细胞侵袭迁移[9-10]。本实验结果表明,MCF-7细胞经光动力处理后,ROS水平明显升高,可能抑制乳腺癌细胞的迁移能力。Du等[11]发现,结合藻青蛋白和血卟啉介导光动力治疗,抑制MCF-7细胞的增殖和迁移。本实验Transwell迁移实验和划痕实验结果也表明,MPPa-PDT明显抑制了MCF-7细胞的迁移能力,而单纯使用MPPa或单纯光照对细胞的迁移能力无明显影响。
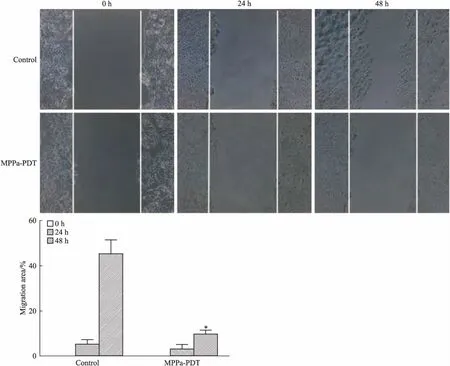
Fig 4 Migration of MCF-7 cells inhibited by MPPa-PDT(×50)
上皮-间充质转化(epithelial mesenchymal transition ,EMT)在肿瘤转移中起重要作用,EMT发生时,细胞-细胞连接和细胞极性消失,肌动蛋白细胞骨架重组失败,纺锤样间质形成,导致细胞运动及迁移能力增强[8]。E-cadherin是EMT中一个关键因子,其功能失调导致肿瘤细胞侵袭、迁移和转移传播。研究发现在乳腺癌病人中,E-cadherin水平与肿瘤转移、不良预后、肿瘤复发有关[8]。本实验结果表明,MPPa-PDT上调MCF-7细胞的E-cadherin水平,表明MPPa-PDT可能通过上调E-cadherin,抑制肿瘤细胞发生EMT,进而抑制肿瘤细胞迁移。
Akt是细胞内重要的信号转导通路,涉及细胞的存活、生长、转移和代谢,发生EMT的细胞中可检测到Akt的激活,Akt激活与肿瘤侵袭迁移密切相关。PTEN作为一种抑癌基因,可使三磷酸磷脂酰肌醇(phosphatidylinositol trisphosphate,PI3P)脱磷酸化,抑制Akt的激活[12],阻碍EMT的发生。实验结果表明,MPPa-PDT处理后,MCF-7细胞中PTEN蛋白表达量增加,p-Akt蛋白表达量降低,提示MPPa-PDT可能通过PTEN/Akt信号通路,降低MCF-7细胞迁移能力。
综上所述,MPPa-PDT可明显降低MCF-7细胞的迁移能力,其作用机制可能与E-cadherin上调和PTEN/Akt信号通路有关。基质金属蛋白酶类(matrix metalloproteinases,MMPs)在肿瘤的侵袭迁移中起关键作用,其中MMP-2和MMP-9可降解胞外基质和Ⅳ型胶原[13],促进肿瘤转移,而且MMP-9可诱导EMT的发生,因此,MMP-2和MMP-9常作为肿瘤进展的标志物[14]。MPPa-PDT是否通过抑制MMP-2和MMP-9表达来抑制肿瘤的侵袭迁移有待进一步研究。
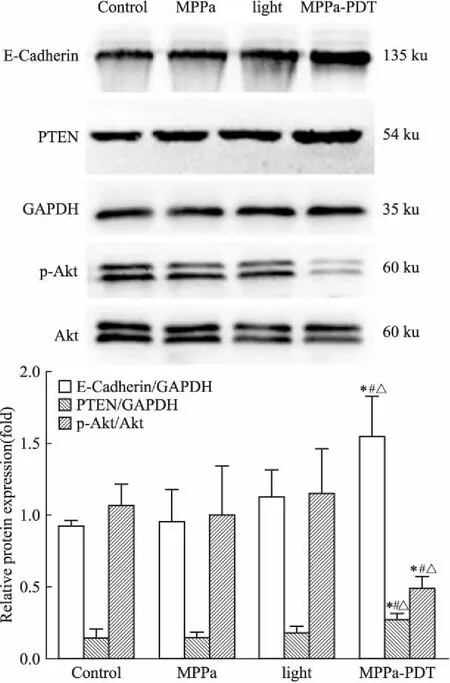
Fig 5 Effect of MPPa-PDT on relativeprotein expression in MCF-7
*P<0.05vscontrol group;#P<0.05vsMPPa group;△P<0.05vslight group
(致谢:本实验在重庆医科大学附属第一医院重大代谢性疾病转化医学重庆市高校重点实验室完成,在此感谢在实验中给予指导和帮助的各位老师和同学。)

