奥曲肽对肝纤维化大鼠自噬相关蛋白LC3和Beclin-1表达的影响
张 超,张 冲,刘雪琪,孟晓明,潘发明
(安徽医科大学1. 第一附属医院肝胆胰外科、2. 第一附属医院肾内科、3. 药学院、4. 公共卫生学院流行病与卫生统计学系,安徽 合肥 230022)
肝纤维化(hepatic fibrosis, HF)是肝脏对慢性肝损伤因素(如酒精性肝炎、非酒精性脂肪性肝炎、病毒性肝炎等)创伤修复应答的结果,以胞外基质合成与分解平衡紊乱为特征。肝星状细胞(hepatic stellate cells, HSCs)在HF进展中起到重要作用。当肝脏受到急性或慢性损伤时,静止的HSC变成活化状态,转变为成纤维细胞,活化的HSC是细胞外基质的主要来源[1]。
自噬是在胞内将受损的细胞器降解,为细胞生存提供可重复利用物质和能量的过程,在维持胞内稳态中起到重要作用。有研究报道[2],在HSC活化过程中,自噬潮增加,通过自噬抑制因子干预自噬可抑制HSC的活化。奥曲肽(octreotide,OCT)是一种生长抑素类似物,前期研究表明,OCT可缓解大鼠HF程度[3],但OCT是否通过调节自噬发挥抗纤维化作用仍未明了。因此,本研究建立CCl4肝纤维化模型,探讨自噬在HF中的作用以及OCT对其的影响。
1 材料
1.1实验动物清洁级♂SD大鼠30只,体质量200~250 g,购于安徽医科大学实验动物中心,常温下自由饮水,普通饲料喂养。
1.2试剂用橄榄油将CCl4配成40%混合溶液;OCT(0.1 mg·mL-1)购于瑞士诺华公司;ECL发光试剂购于美国Thermo Fisher公司;抗Collagen I和α-SMA单克隆抗体,购于Proteintech公司;抗LC3和Beclin-1单抗购于Abcam公司;抗β-actin单抗、二抗,购于北京中杉金桥生物技术公司。
2 方法
2.1动物分组及造模大鼠随机分为对照组、模型组和OCT组,每组10只。除对照组外,均采用皮下注射40% CCl4(3 mL·kg-1),每周2次。OCT组采用皮下注射OCT 10 μg·kg-1,每日2次。同时对照组和OCT组均皮下注射等体积生理盐水。造模8周后处死大鼠,收集待测标本。
2.2血清学检测全自动生化分析仪(安徽医科大学第一附属医院检验科)检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)和白蛋白(ALB)的含量。
2.3HE和Masson染色观察肝组织病理学变化取肝组织置于10%甲醛溶液中固定,脱水,包埋后切片,行HE和Masson染色,拍照并分析。
2.4Westernblot法检测大鼠肝组织CollagenⅠ、α-SMA、LC3和Beclin-1蛋白表达提取蛋白,并用BCA法测定蛋白浓度。蛋白样品经SDS-PAGE电泳、转膜、封闭,一抗4 ℃孵育过夜。次日TBST洗膜3次后,置于相应二抗中,常温孵育1 h。ECL发光试剂盒显影,并用ImageJ软件分析条带灰度值。
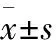
3 结果
3.1大鼠血清学指标变化Tab 1结果显示,与对照组相比,模型组中大鼠ALT、AST和TBIL水平上升,ALB水平明显下降,差异有统计学意义(P<0.01);与模型组相比,OCT组ALT、AST和TBIL均降低,ALB水平增加,差异有统计学意义(P<0.05)。
3.2大鼠肝组织病理学改变HE染色显示,对照组肝小叶结构完整,肝细胞大小、形态正常,呈以中央静脉为中心的辐射状,肝索排列整齐,无胶原纤维增生;模型组出现大量脂肪变性,肝实质、肝小叶和肝索结构被破坏,汇管区及周边组织有大量胶原结缔组织增生;OCT组肝脂肪变性,结缔组织增生程度减轻。Masson染色显示,对照组仅见汇管区有少量蓝色胶原纤维,未见纤维增生;模型组见汇管区及周围有大量蓝色胶原纤维增生,肝小叶结构被破坏形成假小叶;OCT组见增生的胶原纤维明显减少,假小叶数量减少。

Tab 1 Levels of TBIL, AST, ALT and ALB in serum of
**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel

Tab 2 Effects of OCT on protein expression of Collagen Ⅰ,α-SMA, LC3 and Beclin-1 in
**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel
3.3大鼠肝组织CollagenⅠ、α-SMA、LC3和Beclin-1蛋白表达变化Tab 2的Western blot半定量结果显示,Collagen Ⅰ、α-SMA、LC3和Beclin-1蛋白在模型组中的表达水平较对照组升高(P<0.05);相比于模型组,OCT组中Collagen Ⅰ、α-SMA、LC3和Beclin-1蛋白表达水平下降(P<0.05)。
4 讨论
自噬在HF的发生中起两面性作用。一方面,自噬具有促肝纤维化作用。当HSC发生自噬时,消化胞内脂滴为HSC活化提供能量,诱导I型胶原合成,加速HF进程[4]。另一方面,自噬又具有抗肝纤维化作用。通过去除过度沉积的脂滴、异常折叠的蛋白和受损的线粒体,减少氧化应激和脂质过氧化的损伤,从而维持受损肝细胞胞内的能量平衡。自噬又可促使单核细胞分化为巨噬细胞,巨噬细胞自噬能够防止过多的炎症介质释放,而抑制巨噬细胞自噬可促使炎症介质的分泌,炎症介质又可促进单核细胞和中性粒细胞在肝组织中集聚,诱导肝细胞凋亡,从而通过抗炎作用发挥抗纤维化作用[5]。
有研究表明[6],OCT可通过抑制自噬减轻肾损伤的发生,为此我们建立CCl4肝纤维化大鼠模型,并用OCT干预。结果表明,模型组大鼠肝功能异常,HE和Masson染色均显示肝组织有不同程度纤维化,说明HF模型成功建立。模型组中大鼠肝组织LC3和Beclin-1含量高于对照组,表明在CCl4诱导的HF大鼠肝组织中,自噬标志性蛋白LC3和Beclin-1的表达水平上升,证明自噬促进HF的发生。在OCT组中,大鼠HF程度相比于模型组明显减轻,Collagen Ⅰ、α-SMA、LC3和Beclin-1蛋白含量均下降,表明OCT抑制HF可能与其通过下调自噬标志性蛋白LC3和Beclin-1的表达,进而抑制自噬的发生,减少HSC的活化有关。
综上,OCT可通过减轻肝脏病理损伤,下调Collagen I和α-SMA的表达而抑制HF,同时下调LC3和Beclin-1的表达而抑制过度自噬,缓解HF。我们将会在体外实验中进一步探索自噬及其相关蛋白在HF进展中的变化及作用。

