杨桃根提取物对CCl4致小鼠急性肝损伤的预防作用
黄 湘,谢秋巧,叶芳杏,覃陆慧,黄仁彬,张士军
(广西医科大学药学院,广西 南宁 530021)
肝脏是人体最重要的消化器官之一,关系着人体的健康。急性肝损伤是常见的肝脏疾病之一,其病因复杂,病情紧急。目前临床医治方法不断进步及完善,但其治疗方法主要是对症治疗,尚无根治方法。急性肝损伤的预防及治疗仍面临严峻的形势。因此,研究开发疗效肯定的保肝药物成为医药工作者的共识。
杨桃(AverrhoacarambolaL.)为醡浆草科多年生植物,主要入药部位为根。研究表明,杨桃根提取物(extract ofAverrhoacarambolaL. root,EACR)及其单体化合物2-十二烷基-6-甲氧基-2,5-二烯-1,4-环己二酮(2-dodecyl-6-methoxycyclohexa-2,5-diene-1,4-dione)对糖尿病及其并发症[1-2]、乳腺癌[3]等多种疾病具有疗效。本课题组前期研究发现,EACR对糖尿病引起的肝糖代谢紊乱具有明显疗效。因此我们推测,EACR对其他因素引起的肝损伤可能具有疗效,并且尚未有文献报道。本研究旨在初步探讨EACR对四氯化碳(carbon tetrachloride,CCl4)诱导小鼠急性肝损伤的影响及其作用机制。
1 材料与方法
1.1实验动物与试剂昆明种小鼠,SPF级,♂,体质量(20±2)g,购自广西医科大学实验动物中心,实验动物生产许可证:SCXK桂2014-0002,实验动物使用许可证:SYXK桂2014-0003。动物饲养于通风良好环境中,温度(18~25) ℃,相对湿度40%-70%,12 h光照昼夜循环。EACR的提取过程如下:5 kg杨桃根药材经80%乙醇浸泡提取3次(第1次2 h,第2次和第3次各1.5 h),浓缩干燥后得到500 g干膏,低温冷藏保存,临用时用双蒸水稀释成所需浓度。CCl4(天津市光复科技发展有限公司);联苯双酯滴丸(北京协和药厂);谷草转氨酶(aspartate aminotransferase, AST)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、超氧化物歧化酶(superoxide dismutase , SOD)、丙二醛(malondialehyde, MDA)、还原型谷胱甘肽(glutathione , GSH)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、总蛋白定量测定试剂盒(南京建成生物工程研究所);白细胞介素1(interleukin-1, IL-1)、白细胞介素6(interleukin-6, IL-6)ELISA试剂盒(上海源叶生物科技有限公司);肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、核转录因子-κB(nuclear factor-kappa B, NF-κB)、caspase-3抗体(Cell Signaling Technology)。
1.2仪器SpectraMaxPlus384连续光谱扫描式酶标仪(Molecular Devices公司);5810R高速低温离心机(Eppendorf公司);垂直电泳仪、转膜仪(Bio-Rad公司);化学发光成像系统(Sagecreation公司);BX53显微镜(Olympus公司)。
1.3动物分组、给药方法及模型建立取60只♂小鼠,随机分为6组:正常对照组(生理盐水,20 mL·kg-1)、模型组(生理盐水,20 mL·kg-1)、阳性对照组(联苯双酯滴丸,0.02 g·kg-1)、EACR高剂量组(1.2 g·kg-1,相当于12 g生药·kg-1)、EACR中剂量组(0.6 g·kg-1,相当于6 g生药·kg-1)、EACR低剂量组(0.3 g·kg-1,相当于3 g生药·kg-1),每组10只。预防性提前给予相应药物7 d,1 d 1次。末次给药后1 h,正常组注射等剂量橄榄油,其他各组小鼠腹腔注射0.15% CCl4橄榄油(10 mL·kg-1,均一次性注射),建立急性肝损伤模型。
1.4标本采集采用4%水合氯醛麻醉小鼠后,颈椎脱臼处死小鼠,摘除眼球采血,离心后收集上层血清。剖腹取其肝脏,PBS冲洗干净后,拭干,称重,存放于液氮中,备用。
1.5指标检测
1.5.1血清学指标的测定 小鼠麻醉后,摘除眼球采血,4 ℃、3 500 r·min-1离心10 min,收集上层血清。严格按照试剂盒说明检测血清ALT、AST、IL-1、IL-6。
1.5.2肝脏组织指标的测定 取适量肝组织,洗去积血后,按1 ∶9加入生理盐水制备成10%的肝组织匀浆。按照试剂盒的说明测定SOD、MDA、GSH、GSH-Px及蛋白的含量。另取约0.1 g肝脏组织,加入10倍量的RIPA裂解液,提取蛋白。采用Western blot法检测肝脏组织中的TNF-α、NF-κB、caspase-3的蛋白表达水平。
1.5.3肝组织病理学检查 肝组织经10%甲醛固定24 h后,常规脱水,石蜡包埋,进行HE染色,光镜下观察组织形态。

2 结果
2.1小鼠的一般情况小鼠饲养期间,体质量均有所增加,但各组间差异无显著性。建立急性肝损伤模型后,与正常组相比,模型小鼠出现狂躁,继而精神萎蔫,反应迟钝,毛色暗淡。与模型小鼠相比,EACR 3个剂量组小鼠的行为、精神及外观等一般状态均有所改善。
2.2EACR对小鼠肝脏指数的影响由Tab 1可知,与正常组小鼠相比,模型组小鼠的肝脏指数明显升高(P<0.01);与模型组相比,EACR高、中剂量组肝脏指数明显降低(P<0.05或P<0.01),EACR低剂量组差异无显著性。

Tab 1 Effects of EACR on liver index in n=10)
**P<0.01vsnormal;#P<0.05,##P<0.01vsmodel
2.3EACR对小鼠肝脏病理学变化的影响Fig 1肝脏病理染色结果表明,正常组小鼠肝细胞结构清晰,核大而圆,肝索呈星状排列,肝间质无炎症细胞浸润。模型组小鼠肝细胞变性,部分胞质崩解,肝索边界模糊,肝小叶中央区及周边可见大量炎症细胞浸润,局部坏死。EACR低剂量组肝细胞核固缩,肝索排列紊乱,肝间质间有较多炎症细胞浸润,少部分出现坏死。EACR高、中剂量组及阳性组小鼠肝细胞形态结构较清晰,少量炎症细胞浸润,肝索排列较整齐,未见明显充血。
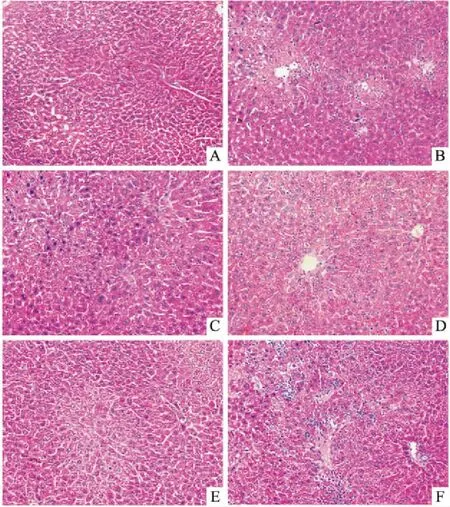
Fig 1 HE staining of liver tissues (×200)
A:Normal;B:Model;C:Positive control;D:EACR high dose group;E:EACR middle dose group;F:EACR low dose group.
2.4EACR对小鼠血清AST、ALT、IL-1、IL-6的影响由Tab 2可知,与正常组小鼠相比,模型组小鼠的AST、ALT、IL-1、IL-6明显升高(P<0.01)。与模型组小鼠相比,EACR 3个剂量组小鼠的AST、ALT、IL-1、IL-6水平明显下降,差异具有统计学意义(P<0.01)。
2.5EACR对小鼠肝脏组织SOD、MDA、GSH、GSH-Px的影响由Tab 3可知,与正常组小鼠比较,模型组小鼠的SOD、GSH、GSH-Px明显降低(P<0.01),MDA明显升高(P<0.01);与模型组小鼠相比,EACR能够明显提高小鼠肝脏SOD、GSH、GSH-Px活性,明显下调MDA水平(P<0.05或P<0.01),EACR低剂量组的GSH虽然有所升高,但差异无显著性。
2.6EACR对小鼠肝脏中TNF-α、NF-κB、caspase-3蛋白表达的影响如Fig 2所示,与正常组小鼠相比,模型组小鼠肝脏中的TNF-α、NF-κB、caspase-3蛋白表达明显增加(P<0.01);与模型组相比,EACR 3个剂量组小鼠的TNF-α、NF-κB、caspase-3蛋白的表达明显降低(P<0.01)。
3 讨论
CCl4是亲肝毒物,被认为是化学性肝损伤模型的经典诱导剂[4]。化学性肝损伤是保肝药物筛查常用的模型[5]。正常情况下,AST、ALT主要存在于胞质内,极少存在于血清中。CCl4进入机体后,在肝微粒体酶的作用下代谢为三氯甲基,三氯甲基可破坏肝细胞膜结构,增加肝细胞膜的通透性[6],导致胞内酶AST、ALT从胞内大量释放到血液中,引起血液中的AST、ALT升高。因此,血清中的AST、ALT可以直接反映肝脏的损伤程度[7]。本研究结果表明,模型组小鼠的AST、ALT明显升高,说明造模成功。联苯双脂滴丸阳性对照组及EACR各给药组的AST、ALT明显降低,说明预防性给予EACR能减轻CCl4对小鼠肝脏造成的损伤。CCl4在体内经过氧化还原反应产生大量的自由基,这些自由基可攻击细胞膜上的不饱和脂肪酸,诱发脂质过氧化反应[8]。MDA是脂质过氧化反应的终产物之一,在CCl4诱导肝损伤的过程中逐渐积累,并与生物大分子结合成醛,进一步破坏肝细胞膜的结构和功能[9]。SOD作为有效的金属酶,能够催化超氧化物阴离子歧化为H2O2和O2。GSH-Px催化毒性过氧化物还原成无毒的羟基化合物,同时还能将H2O2和氢过氧化物还原成水,从细胞膜上除去脂质过氧化氢,从而终止脂质过氧化反应[10]。GSH是细胞内主要的抗氧化剂,能与细胞色素P450的代谢产物结合,达到清除自由基的作用,进而保护肝脏。本研究结果表明,阳性对照组及EACR 3个给药组能有效降低MDA水平,提高SOD、GSH、GSH-Px的水平,表明EACR的保肝作用可能与其参与氧化应激反应有关。
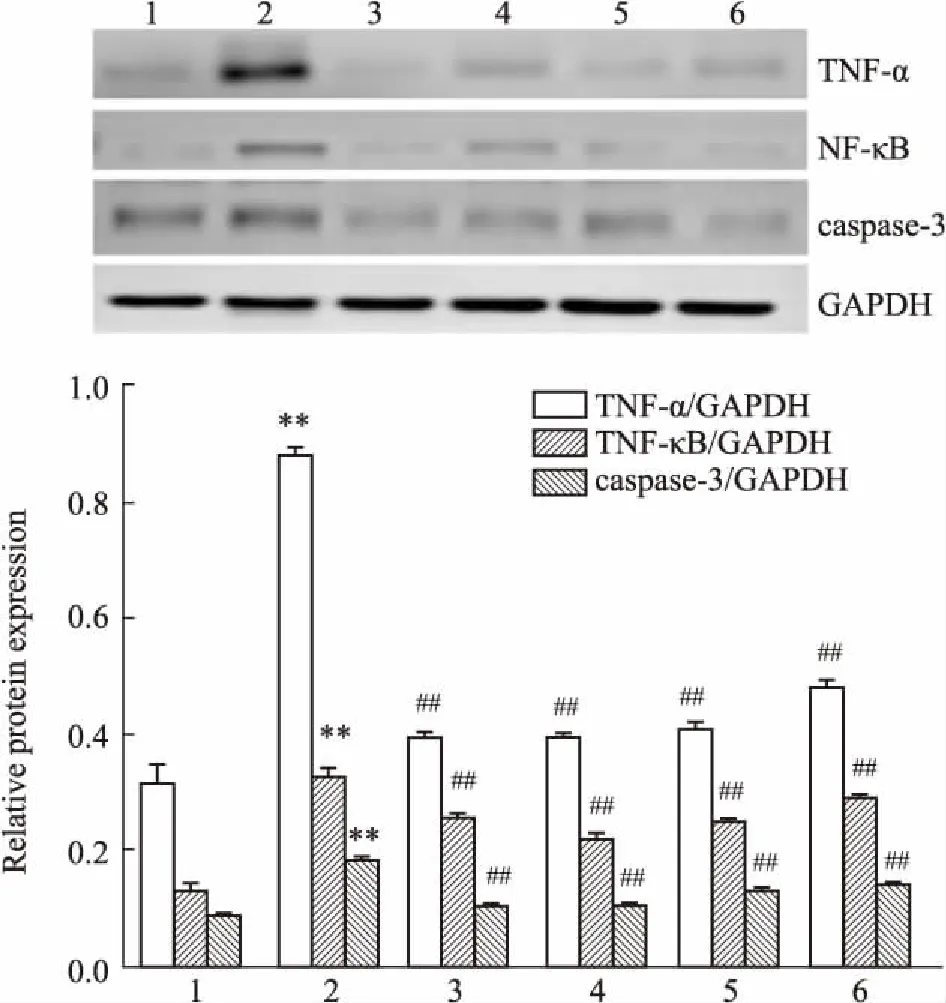
Fig 2 Effects of EACR on expressions of TNF-α, NF-κB and caspase-3 in liver tissues of n=4)
1:Normal;2:Model;3:Positive control;4:EACR high dose group;5:EACR middle dose group;6:EACR low dose group.**P<0.01vsnormal group;##P<0.01vsmodel group.

Tab 2 Effects of EACR on levels of AST, ALT, IL-1 and IL-6 in serum of n=10)
**P<0.01vsnormal;#P<0.05,##P<0.01vsmodel

Tab 3 Effects of EACR on levels of SOD, MDA, GSH and GSH-Px in tissues of n=10)
**P<0.01vsnormal;#P<0.05,##P<0.01vsmodel
研究表明,细胞凋亡及炎症反应可能参与CCl4诱导的急性肝损伤。IL-1、IL-6通常被认为是炎症反应的生物标志物。CCl4进入机体后,刺激枯否细胞分泌IL-1、IL-6,使得IL-1、IL-6的分泌增加,加速炎症反应[11]。TNF-α是由单核巨噬细胞分泌的内源性细胞因子,它通过激活细胞内的通路以调节炎症因子和细胞增殖,加速炎症反应的进程[12]。NF-κB参与调控炎症因子的转录,抑制其表达能够抑制炎症反应的进行[13]。凋亡是由多个基因控制的细胞生理自我灭亡的过程[14]。caspase-3是caspase家族中一种重要的促进细胞凋亡的蛋白酶,是细胞凋亡的中心效应物,它能在裂开它的基底物的同时改变细胞的形态及生化特性,促进炎症细胞的凋亡[15]。本实验结果表明,阳性对照组及EACR各给药组能降低IL-1、IL-6的水平,下调TNF-α、NF-κB、caspase-3的蛋白表达。表明EACR的保肝作用可能与其参与抑制炎症因子有关。
综上所述,EACR通过清除氧自由基及抑制炎症因子释放,从而减轻CCl4对小鼠肝脏的损害。

