丹酚酸B对糖尿病大鼠肾纤维化的改善作用及其机制
张 旭,朱元美,唐保露,任尤楠,陶善珺,杨解人,郑书国,3,4
(皖南医学院 1. 药理学教研室、2. 解剖学教研室、3. 定量药理研究所、4. 药物研发中心,安徽 芜湖 241002)
糖尿病肾病是糖尿病最严重和最常见的并发症之一,也是导致终末期肾病的最重要原因之一,若不及时采取措施,可最终发展成为慢性肾衰竭或尿毒症,从而危及患者生命[1]。糖尿病肾病的主要病理特征是肾纤维化,表现为成纤维细胞的异常增殖及由此导致的细胞外基质的过度堆积[2]。大量研究表明,氧化应激在糖尿病肾病发生发展过程中起着重要作用[3],而转化生长因子β1(transforming growth factor β1, TGF-β1)/Smad信号通路的异常激活是糖尿病肾病肾纤维化的主要分子机制[4]。因此,有效改善糖尿病氧化应激状态和调控TGF-β1/Smad信号通路,成为防治糖尿病肾病肾纤维化、改善糖尿病预后的重要措施之一。
丹酚酸B(salvianolic acid B,Sal B)是丹参的主要成分之一,具有较强的抗氧化活性,能明显抑制间歇性高糖诱导的c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)活化和INS-1细胞凋亡[5]。Sal B可有效抑制高糖诱导的肾小管上皮细胞向间质细胞转分化,减少胶原蛋白等细胞外基质合成与分泌[6],但对其能否抑制糖尿病肾脏纤维化目前研究较少。本研究采用高糖高脂饮食,合并腹腔注射链脲佐菌素(streptozotocin, STZ)的方法建立糖尿病大鼠模型,观察Sal B对糖尿病大鼠肾纤维化的改善作用,并从TGF-β1/Smad信号通路探讨其可能的作用机制。
1 材料
1.1实验动物Sprague-Dawley(SD)大鼠50只,SPF级,♂,体质量(220±20)g,购于浙江省实验动物中心,合格证号:SCXK(浙)2014-0001。
1.2药物与试剂Sal B(纯度80%),西安文竹生物科技有限公司;STZ,Sigma公司;血糖仪及血糖试纸,三诺生物传感股份有限公司;尿微量白蛋白(urine micro-albumin,UAlb)检测试剂盒,上海生物科技有限公司;I型和III型胶原蛋白检测试剂盒、血尿素氮(blood urea nitrogen, BUN)、肌酐(serum creatinine, SCr)检测试剂盒,南京建成生物科技有限公司;β-actin抗体、辣根过氧化物酶标记抗体、总抗氧化能力(total antioxidant capacity, TAC)测定试剂盒、超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒、丙二醛(malondialdehyde, MDA)测定试剂盒及BCA蛋白浓度测定试剂盒(增强型),碧云天生物技术研究所;TGF-β1抗体、p-Smad2、Smad2抗体,北京博奥森生物技术有限公司;Smad7 抗体,武汉博士德生物工程有限公司。
1.3仪器高速冷冻离心机(Eppendorf公司);M200 PRO多功能酶标仪(Tecan公司);电泳、转印系统(Bio-Rad公司);FluorChem FC3化学发光成像系统(Proteinsimple公司);Axio Vert.A1显微成像系统(Carl Zeiss公司)。
2 方法
2.1糖尿病模型的建立与给药SD大鼠50只,适应性喂养1周,自由进食和饮水。随机选取10只作为正常对照组,普通饲料喂养。其余大鼠喂饲高糖高脂饲料(10%猪油、10%蔗糖、5%蛋黄粉、1%胆固醇和 74%普通饲料)4周后,禁食12 h,腹腔注射1% STZ溶液(40 mg·kg-1,0.1 mmol·L-1柠檬酸缓冲液配制,pH 4.4)诱导糖尿病,1周后以随机血糖≥16.7 mmol·L-1作为糖尿病模型建立成功。将糖尿病大鼠随机分为模型组、Sal B低剂量组(Sal B 80)、Sal B高剂量组(Sal B 160),Sal B各组每天灌胃给予Sal B(80、160 mg·kg-1·d-1),正常对照组和模型组大鼠给予等体积蒸馏水,连续6周。其间每周称量体质量1次,根据体质量调整给药剂量。
2.2生化指标检测实验结束时,用代谢笼收集大鼠24 h尿液,按试剂盒说明检测尿微量蛋白含量;大鼠禁食12 h,血糖试纸测定空腹血糖水平;1%戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉,腹主动脉取血,分离血清,按试剂盒说明测定SCr、BUN、MDA、TAC水平及SOD活力。
2.3肾纤维化检测腹主动脉取血后,摘取大鼠肾脏,切取部分肾组织以4%多聚甲醛固定,常规石蜡包埋、5 μm厚切片,梯度乙醇脱水,按试剂盒说明进行Masson染色,镜下观察肾组织胶原纤维水平。取肾组织,制取10%组织匀浆,ELISA法测定肾组织I型和III型胶原含量,定量分析肾脏纤维化水平。
2.4Westernblot检测取肾组织,RIPA 裂解液(含磷酸酶和蛋白酶抑制剂)裂解组织,12 000×g、4 ℃离心10 min后收集上清液,BCA法测定蛋白浓度,聚丙烯酰胺凝胶电泳后转膜、5%脱脂牛奶封闭,分别加入TGF-β1、Smad2、p-Smad2、Smad7和β-actin 抗体,4 ℃孵育过夜,TBST洗涤后加入辣根过氧化物酶标记的二抗,室温孵育2 h,ECL发光显色,凝胶图像分析仪分析目的条带光密度,结果以p-Smad2/Smad2或TGF-β1/β-actin、Smad7/β-actin表示。

3 结果
3.1SalB对糖尿病大鼠BUN、UAlb、SCr的影响由Tab 1可见,糖尿病大鼠BUN、SCr和UAlb水平均明显高于正常对照组(P<0.01),说明糖尿病大鼠出现明显肾功能损害。给予Sal B能明显降低糖尿病大鼠BUN、SCr和UAlb水平(P<0.05,P<0.01),提示Sal B可有效改善糖尿病大鼠肾功能损害。
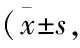
Tab 1 Effect of Sal B on BUN, UAlb and SCr in diabetic rats n=7~8)
**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel
3.2SalB对糖尿病大鼠肾纤维化的影响Fig 1的Masson染色结果显示,正常组大鼠肾组织细胞间隙清晰可见,肾间质胶原纤维分布极少,染色较淡。而糖尿病模型组大鼠肾小球系膜基质增多,肾间质胶原组织增多,细胞间质有明显蓝色深染的胶原纤维。与模型组相比,Sal B各组大鼠肾组织胶原染色均明显较少。

Fig 1 Effect of Sal B on renal fibrosis (Masson staining×400)
A: Control group; B: Model group; C: Sal B 80 group; D: Sal B 160 group.
为了定量分析Sal B对糖尿病大鼠肾纤维化的影响,本研究又检测了大鼠肾组织胶原蛋白含量。如Tab 2所示,模型组大鼠肾组织I型和III型胶原蛋白含量均明显高于正常对照组(P<0.01),而给予Sal B可明显减少肾组织胶原蛋白沉积(P<0.05,P<0.01),这一结果与Masson染色结果一致。提示Sal B可明显改善糖尿病大鼠肾纤维化,减少肾组织胶原蛋白沉积。

Tab 2 Effect of Sal B on renal contents of type Ⅰ and type Ⅲ
**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel
3.3SalB对肾组织TGF-β1、Smad7蛋白水平及Smad2磷酸化的影响如Fig 2所示,与正常对照组相比,糖尿病大鼠肾组织TGF-β1蛋白水平和Smad2磷酸化水平均明显升高(P<0.01),而Smad7蛋白水平则明显降低(P<0.01)。给予Sal B可明显降低TGF-β1和磷酸化Smad2蛋白水平,而Smad7蛋白水平则明显升高(P<0.05,P<0.01)。这一结果与Sal B改善糖尿病大鼠肾脏纤维化作用一致,提示Sal B降低肾组织胶原沉积与调节TGF-β1/Smad信号通路有关。

Fig 2 Effect of Sal B on protein levels of TGF-β1,
**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group
3.4SalB对血清TAC、SOD和MDA水平的影响由Tab 3可见,与正常对照组相比,模型组大鼠血清TAC和SOD水平明显降低,而MDA水平则明显升高(P<0.01),提示糖尿病诱发了明显氧化应激状态。给予Sal B后,血清TAC和SOD水平明显升高,MDA水平明显下降(P<0.05,P<0.01),说明Sal B可有效改善糖尿病大鼠氧化应激状态。

Tab 3 Effect of Sal B on serum levels of TAC, SOD and
**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel
4 讨论
糖尿病肾病的主要病理特征是肾小球硬化和肾小管间质纤维化,表现为肾小球基底膜增厚和肾小管间质胶原蛋白等细胞外基质过度沉积[2]。随着病情的不断发展,肾脏组织结构破坏并形成瘢痕组织,肾单位逐渐减少,肾功能呈进行性下降,并最终发展为终末期肾衰竭。因此,有效抑制肾纤维化成为阻止或延缓糖尿病肾病发展进程、改善糖尿病预后的重要措施之一。本研究分别采用Masson染色和ELISA法检测了大鼠肾脏纤维化水平,结果显示,糖尿病大鼠出现了明显肾纤维化,表现为肾组织胶原纤维染色加深,肾组织I型和III型胶原蛋白含量增加,而给予Sal B可明显减轻糖尿病大鼠肾纤维化,同时受损的肾功能也明显改善,提示Sal B可能有助于临床减轻或延缓糖尿病肾病肾纤维化、改善糖尿病预后。
近年来研究发现,TGF-β1/Smad信号通路的异常激活是糖尿病肾病肾纤维化发生发展的主要机制,抑制TGF-β1/Smad信号通路可有效减轻糖尿病大鼠肾纤维化,改善肾功能[7]。TGF-β1是TGF-β超家族一员,广泛参与纤维化、炎症及自身免疫性疾病等多种病理过程,是介导肾小球硬化和肾间质纤维化的关键细胞因子[8]。TGF-β1既可趋化并活化炎性细胞,促进成纤维细胞增殖和细胞外基质合成,又可抑制细胞外基质降解而促进组织纤维化[9]。Smad蛋白是TGF-β1信号转导最重要的下游蛋白和效应分子,是TGF-β1信号从细胞表面受体传至胞核的关键因子[9]。Smad蛋白家族分为受体活化型Smad(Smad2、Smad3)、共同通路型Smad(Smad4)和抑制型Smad(Smad6、Smad7)。当TGF-β1与其受体TβRII结合后,活化的TβRII可磷酸化TβRI,并激活其激酶活性,后者进而磷酸化Smad2/3。活化的Smad2/3与Smad4形成复合物进入胞核,调控I、III型胶原等靶基因转录。Smad6/7可直接与TβRI结合,抑制其对Smad2/3的磷酸化作用[9]。本研究结果显示,糖尿病大鼠肾组织TGF-β1/Smad信号通路明显激活,表现为TGF-β1和p-Smad2水平均明显升高,而Smad7水平明显下降。给予Sal B可明显减少TGF-β1和p-Smad2水平,上调Smad7蛋白水平,说明Sal B可有效抑制糖尿病大鼠肾组织TGF-β1/Smad信号通路活化,这一结果与前期报道Sal B抑制肺成纤维细胞和肾小球系膜细胞TGF-β1/Smad信号通路活化作用一致[10-11],提示Sal B改善糖尿病大鼠肾纤维化与抑制TGF-β1/Smad信号通路活化有关。
此外,氧化应激也是糖尿病肾病肾纤维化的重要因素之一[12]。长期高血糖一方面可增加机体活性氧(reactive oxygen species, ROS)的产生,另一方面可损伤机体抗氧化防御体系,诱导氧化应激状态,导致氧化损伤[13]。本研究结果显示,糖尿病大鼠血清抗氧化能力明显下降,而氧化损伤标志物MDA水平则明显升高,提示糖尿病大鼠出现了明显氧化应激状态。肾脏是对氧化应激损伤比较敏感的器官之一,ROS可通过多种途径促进糖尿病肾病肾纤维化的发生、发展[13-14],如激活TGF-β1/Smad信号通路和丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路,导致肾小管上皮细胞向肌成纤维细胞转化,合成大量细胞外基质。ROS还可影响细胞外基质降解,促进纤维化的发生、发展。大量研究表明,补充抗氧化剂可有效提高机体抗氧化能力,减轻糖尿病肾病肾纤维化[15]。本研究也显示,补充Sal B可明显提高糖尿病大鼠血清抗氧化能力,降低氧化损伤标志物血清MDA水平,说明Sal B可明显改善糖尿病大鼠氧化应激状态,提示Sal B减轻糖尿病大鼠肾纤维化与其改善氧化应激状态也有关。
综上所述,Sal B可明显改善糖尿病大鼠肾纤维化,改善肾功能,其机制与改善氧化应激状态、调控TGF-β1/Smad信号通路有关。
(致谢:本研究在皖南医学院中药药理三级实验室完成,在此对实验室全体工作人员表示感谢。)

