血清C3、C4和β2-MG水平变化与脓毒症病情程度相关性分析
沈培奇
(河南省泌阳县人民医院检验科 泌阳463700)
脓毒症是一种由感染诱发的全身性炎症反应,是外科术后、重度感染或严重烧伤等危急重症患者临床常见并发症之一。近年来,随着医疗技术的快速发展,脓毒症的病理及生理过程被逐渐阐明,有效的治疗措施及治疗药物也被陆续开发出来,但脓毒症累及全身多个器官及系统,仍是导致ICU病房和急诊科患者死亡的首要因素之一。早期脓毒症患者的生理和病理变化往往具有可逆性[1]。因此,临床对病情程度的及时和准确判断,可降低病死率,改善预后。本研究选取我院收治的354例脓毒症患者作为研究对象,分析脓毒症患者血清C3、C4和β2-MG水平变化与其病情程度的相关性。现报道如下:
1 资料与方法
1.1 一般资料 选取2014年3月~2017年11月在我院诊断为脓毒症的患者354例,根据脓毒症临床诊断标准[2]分为轻症组196例和重症组158例。轻症组:男104例,女92例;年龄29~74岁,平均年龄(48.61±13.50)岁。重症组:男86例,女72例,年龄 28~75岁,平均年龄(49.70±13.26)岁。另选取160例同期健康体检者作为对照组,其中男89例,女 71例;年龄 28~76岁,平均年龄(49.86±14.05)岁。三组的一般资料相比较,差异无统计学意义,P>0.05,具有可比性。本研究经我院医学伦理委员会审批通过。
1.2 仪器与方法
1.2.1 仪器 TD3WS全自动离心机(上海曙新科技开发有限公司);7600-020全自动日立生化分析仪(株式会社日立制作所);试剂盒(上海西唐生物科技有限公司,室内质控结果“在控”)。
1.2.2 研究方法 用红头管抽取354例脓毒症患者和160例健康对照者的肘静脉血,离心30 min,采用免疫透射比浊法检测血清C3和C4;采用酶联免疫吸附试验检测血清β2-MG;比较三组的血清C3、C4和β2-MG水平。本研究中68例脓毒症患者入院26 d后死亡,归病死组,286例存活者归生存组,比较病死组和生存组的血清C3、C4和β2-MG水平;分析血清C3、C4和β2-MG水平与脓毒症病情程度间的相关性。
1.3 统计学处理 数据处理采用SPSS21.0统计学软件,计数资料以%表示,采用χ2检验,计量资料以(±s)表示,组间比较用独立样本t检验,多组间比较用单因素方差分析,两两比较采用LSD-t检验,采用Spearman分析法进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 三组血清C3、C4和β2-MG水平比较 经单因素方差分析,不同病情程度患者血清C3、C4和β2-MG水平比较,差异均有统计学意义,P<0.05;重症组血清C3和C4水平均低于轻症组,轻症组血清C3和C4水平均低于对照组,差异均有统计学意义,P<0.05;重症组血清β2-MG水平高于轻症组,轻症组血清β2-MG水平高于对照组,差异均有统计学意义,P<0.05。见表 1。
表1 三组血清C3、C4和β2-MG水平比较(±s)
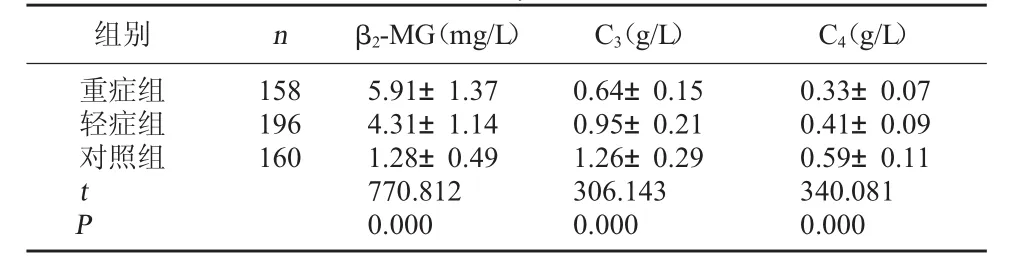
表1 三组血清C3、C4和β2-MG水平比较(±s)
组别nβ2-MG(mg/L)C3(g/L)C4(g/L)重症组轻症组对照组158 196 160 t P 5.91±1.37 4.31±1.14 1.28±0.49 770.812 0.000 0.64±0.15 0.95±0.21 1.26±0.29 306.143 0.000 0.33±0.07 0.41±0.09 0.59±0.11 340.081 0.000
2.2 病死组和生存组的血清C3、C4和β2-MG水平比较 经单因素方差分析,病死组血清C3和C4水平均低于生存组,生存组血清C3和C4水平均低于对照组,差异均有统计学意义,P<0.05;病死组血清β2-MG水平高于生存组,生存组血清β2-MG水平高于对照组,差异均有统计学意义,P<0.05。见表2。
表2 病死组和生存组的血清C3、C4和β2-MG水平比较(±s)
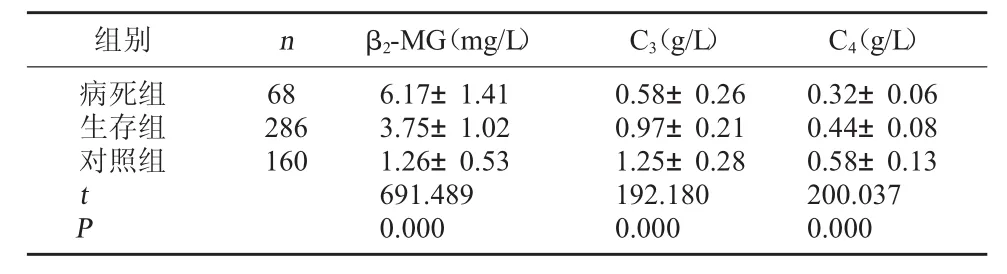
表2 病死组和生存组的血清C3、C4和β2-MG水平比较(±s)
组别nβ2-MG(mg/L)C3(g/L)C4(g/L)病死组生存组对照组68 286 160 t P 6.17±1.41 3.75±1.02 1.26±0.53 691.489 0.000 0.58±0.26 0.97±0.21 1.25±0.28 192.180 0.000 0.32±0.06 0.44±0.08 0.58±0.13 200.037 0.000
2.3 血清C3、C4和β2-MG水平变化与脓毒症患者病情程度的相关性分析 经Spearman分析,患者血清 C3水平(r=-4.813,P=0.020) 和 C4水平(r=-0.581,P=0.019)与病情程度呈负相关,P<0.05;患者血清 β2-MG水平(r=0.610,P=0.025)与病情程度呈正相关,P<0.05;联合血清C3、C4和β2-MG水平评价脓毒症患者预后的ROC面积是0.93,优于单独检测,差异有统计学意义,P<0.05。
3 讨论
血清C3和C4是人体和动物组织液及血清中补体的重要组成成分,可通过介入体液免疫反应,在内环境维持、机体免疫调节和抗病原菌等各种生理过程中发挥重要作用。李鑫鑫等[3]研究证实,机体C3缺乏可引起严重感染。C4重点介入免疫识别,于旁路途径和经典途径中发挥关键作用。相关文献显示,脓毒症患者血清C4表达水平明显降低[4]。本研究结果显示,重症组患者血清C3和C4水平均低于轻症组,轻症组患者血清C3和C4水平均低于对照组,差异均有统计学意义,P<0.05,提示脓毒症患者血清C3和C4水平变化与其病情严重程度有关。经Spearman分析,患者血清 C3水平(r=-4.813,P=0.020)和 C4水平(r=-0.581,P=0.019)与病情程度呈负相关,P<0.05,与雷伟健[5]研究结果一致。
β2-MG是一种小分子球蛋白,普遍分布在内皮细胞和间质细胞表面,在CD8+细胞毒T淋巴细胞反应中发挥着关键作用,其恒定分布于血液系统中,并在肾小管重吸收过程中被降解,因此,血清中表达水平相对稳定,但机体发生代谢异常或炎症反应时,β2-MG合成分泌增多。临床报道称,危重症患者血清β2-MG表达水平变化显著,其水平变化与急性生理学与慢性健康(APACHEⅡ)评分呈正相关[6]。本研究结果显示,重症组患者血清β2-MG水平高于轻症组,轻症组患者血清β2-MG水平高于对照组,差异均有统计学意义,P<0.05。说明脓毒症患者血清β2-MG表达水平与其病情程度密切相关,且经Spearman分析,患者血清β2-MG水平(r=0.610,P=0.025)与病情程度呈正相关,P<0.05。可能在炎症作用下,内皮细胞破裂释放大量β2-MG至血液系统,若肾小管功能正常,则降解β2-MG效用依然存在,血清中β2-MG表达水平可维持正常;若肾小管功能被损坏,降解β2-MG效用丧失,则血清中β2-MG表达水平急剧上升。因此,血清中β2-MG表达水平升高意味着肾小管及微循环内皮细胞严重损伤,累及多器官,提示病情危重。
综上所述,脓毒症患者病情严重程度与其血清C3、C4和β2-MG水平密切相关,检测血清C3、C4和β2-MG水平有助于患者的治疗与预后评估,为临床制定相应治疗方案提供重要依据。

