重组4-α-糖基转移酶转化淀粉制备大元环糊精的条件优化
朱 荣 , 宿玲恰 , 吴 敬 *
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
环糊精 (cyclodextrin,CD)是葡萄糖单元通过α-1,4糖苷键连接而成的环状糊精,常见的是聚合度为 6、7、8 的环状糊精,即 α-环糊精、β-环糊精和γ-环糊精,而大元环糊精(cycloamylose,CA)是指聚合度在9至几百的环状糊精[1]。大元环糊精具有大小不一、结构各异的疏水空穴,其环状结构存在不稳定性和多变性,可随客体分子、溶剂的变化发生改变,可用于包合成分复杂、分子大小各异的混合物[3]。大元环糊精的结构具有多样性,其固体状态和在溶剂里的状态可能具有不同的立体结构。它对蛋白质有重折叠作用,能促使变性的酶重新正确折叠,并恢复其活性[3]。在食品领域,大元环糊精可作为食品的回生抑制剂、风味物质的缓释剂。在化学工业中,其高水溶性、低黏度等特性使其能和乙醇、去垢剂等分子更好地形成包合物。在医药领域,大元环糊精可以与布洛芬等药物发生相互作用,稳定药物。因此,大元环糊精在生物、食品、化学、医药等领域都有着广泛的应用前景[1]。
4-α-糖基转移酶 (4-α-glucanotransferase,EC 2.4.1.25)是一种多功能酶,具有环化、偶合、歧化和水解四种活力,它通过分子内转糖基作用(环化反应)生产大元环糊精[4]。该酶可分为两大类,一类是来源于微生物的4-α-糖基转移酶,如酿酒酵母中的糖原脱支酶[5],芽孢杆菌中的环糊精葡萄糖基转移酶[6]以及麦芽糖转糖基酶[4]。另一类是来源于植物的4-α-糖基转移酶,如马铃薯组织中的D-酶[6]。国外对4-α-糖基转移酶的研究主要集中在克隆表达新的基因,并研究其酶学性质和晶体结构[8]。Terada等在E.coli中成功克隆表达了来自Thermus aquaticusATCC33923的麦芽糖转糖基酶基因(MalQ基因),将获得的酶作用于直链淀粉,证实了该酶能催化分子内的糖基转移而生成大元环糊精[4],并研究了该基因中与水解活性相关的位点,探究其对环化活性及转化率的影响[8]。而国内的研究工作起步比较晚,王兴水教授等已在大肠杆菌中克隆表达来自于Streptomyces ssp.ST66的麦芽糖转糖基酶基因,并优化了其产酶条件[13]。目前大元环糊精的生产仍处于利用直链淀粉为底物的实验室少量制备阶段,而直链淀粉价格昂贵,不利于大规模的生产及其在相关领域的应用。许燕以1 g/dL高直链玉米淀粉为底物,经异淀粉酶脱支预处理后,在二甲亚砜反应体系中,用Thermus aquaticusATCC 33923来源的4-α-糖基转移酶与脱支后的底物进行转化反应,将大元环糊精的最大转化率由24.55%提高到45.58%[14]。由于高直链玉米淀粉价格相对于普通淀粉较贵,研究出以天然淀粉原料为底物制备大环糊精,能大大降低生产成本,具有重要实际应用价值。作者以普通马铃薯淀粉为底物,经过异淀粉酶脱支预处理,利用Aquifex aeolicus来源的4-α-糖基转移酶制备大元环糊精,显著提高了转化率。
1 材料与方法
1.1 菌株、质粒
超嗜热菌 (Aquifex aeolicus)基因组、E.coliJM109、E.coliBL21(DE3):为作者所在实验室保存;克隆载体pMD18-T®Simple vector:购自TaKaRa公司;表达载体 pET-24a(+):购自 Novagen公司。
1.2 培养基
LB 种子培养基(g/L):酵母粉 5,蛋白胨 10,氯化钠 10;卡那霉素(Kan)终质量浓度为 30 μg/mL。
TB 发酵培养基(g/L):酵母粉 24,蛋白胨 12,磷酸二氢钾2.31,磷酸氢二钾12.54,甘油5;卡那霉素(Kan)终质量浓度为 30 μg/mL。
1.3 试剂与仪器
异淀粉酶、普鲁兰酶粗酶液:由作者所在实验室制备并保存,酶活力分别为3 000、1 200 U/mL。大元环糊精标样、根霉Rhizopus sp.来源糖化酶Amyloglucosidase:购买于sigma公司,酶活力约为36 U/mg。
酵母粉、蛋白胨:购自英国Oxoid公司;玉米淀粉、木薯淀粉、马铃薯淀粉:均为市售食品级淀粉;PCR产物纯化试剂盒、胶回收试剂盒和质粒抽提试剂盒:购于天根生化科技有限公司;卡那霉素、氨苄霉素:购于生工生物工程有限公司;PrimeSTAR®HS DNA聚合酶、核酸限制性内切酶、T4 DNA连接酶、核酸相对分子质量标准、琼脂糖、蛋白质相对分子质量标准:购自宝生物工程(大连)公司;其他试剂:购自国药集团化学试剂有限公司。
PCR仪、凝胶成像仪和蛋白质电泳仪:购自美国Bio-Rad公司;DYY-6C型核酸电泳仪:购于北京六一仪器厂;细胞破碎仪:购自浙江宁波新芝生物科技股份有限公司;紫外可见光分光光度计:购于日本Shimadzu公司;高效液相色谱仪:购自美国Agilent公司;TSKgel凝胶色谱柱 SuperMultipore PW-N:购自日本TOSOH公司。
1.4 工程菌的构建
1.4.1 AaAM基因的克隆 以实验室保存的Aquifex aeolicus基因组为模板,设计引物,正向和反向引物序列分别为 5′-GCCGCCATATGAGATTG GCAGGTATTTTA-3′和 5′-GGCCCAAGCTTAAAC TTCTCTTCCGTAAAT-3′,酶切位点分别为Nde I和Hind III,通过PCR扩增获得目的基因AaAM。
PCR 反应体系(50 μL):蒸馏水(已灭菌)33.5 μL,5×PS Buffer 10 μL,dNTPs 4 μL, 模板 1 μL,正反引物各 0.5 μL,DNA 聚合酶 0.5 μL。
PCR 反应条件:94 ℃ 4 min;98 ℃ 10 s,55 ℃5 s,72 ℃ 110 s,循环 30 次,72 ℃ 10 min。
1.4.2 表达载体pET-24a(+)-AaAM的构建 PCR产物纯化后连接至载体pMD18-T®,连接产物转化入E.coli JM109感受态细胞,在LB琼脂平板 (含100 μg/mL Amp)上于37℃恒温培养箱培养过夜。挑取单克隆在LB液体培养基(含100 μg/mL Amp)中培养8~10 h,抽提质粒得pMD18-T®-AaAM,并双酶切和测序鉴定。序列测定由上海生工生物工程有限公司完成。
pMD18-T®-AaAM与表达达载体pET-24a(+)分别经Nde I和Hind III双酶切和胶回收后,用T4连接酶在 16℃过夜连接,连接产物转入E.coli JM109,在 LB 琼脂平板(含 30 μg/mL Kan)上于 37℃恒温培养箱培养过夜。挑取单克隆在LB液体培养基(含 30 μg/mL Kan)中培养 8~10 h,抽提质粒pET-24a(+)-AaAM并进行双酶切验证,验证正确后转入 E.coli BL21(DE3)中,37 ℃培养 8 h,保存菌种,即得到重组基因工程菌E.coli BL21/pET-24a(+)-AaAM。
1.5 摇瓶发酵生产4-α-糖基转移酶AaAM
将于-80℃保藏的重组菌E.coli BL21/pET-24a(+)-AaAM以2%的接种体积分数接种至LB培养基,37℃、200 r/min培养8 h后,以5%的接种体积分数转接至TB培养基,37℃、200 r/min培养2 h后加入0.05 mmol/L IPTG诱导,降温至25℃进行重组蛋白的诱导表达,每隔5小时取样、离心收集菌体,用50 mmol/L Na2HPO4-柠檬酸缓冲液(pH 6.6)悬浮菌体,超声破碎后离心得破壁上清液,即为4-α-糖基转移酶AaAM粗酶液。
1.6 4-α-糖基转移酶AaAM活性测定
分别取0.25 mL的底物 (0.5%可溶性淀粉溶液)、0.05 mL的 1 g/dL麦芽糖溶液和 0.6 mL、0.05 mol/L Na2HPO4-柠檬酸缓冲液(pH 6.6)于试管中,70℃水浴预热10 min。加入0.1 mL稀释的酶液,振荡混匀,反应10 min,沸水浴15 min终止反应[10]。向上述反应体系中加入10 mL碘液 (0.2%KI+0.02%I2),混匀,在 620 nm下测量其吸光值。酶活单位定义:在酶活测量体系下,每分钟降解1 mg/mL淀粉所需的酶量[15]。
1.7 淀粉脱支反应
用 0.05 mmol/L、pH 6.6 Na2HPO4-柠檬酸缓冲液配制1 g/dL马铃薯淀粉溶液70℃加热糊化10 min;加入一定量的脱支酶,充分混匀后在适宜温度下于水浴摇床反应一段时间;反应结束后,沸水浴30 min灭酶。
1.8 大元环糊精的制备以及含量测定[14]
用 0.05 mmol/L、pH 6.6 Na2HPO4-柠檬酸缓冲液配制1 g/dL马铃薯淀粉溶液70℃加热糊化10 min;加入一定量的4-α-糖基转移酶AaAM,充分混匀后在70℃水浴摇床中200 r/min反应一段时间;反应结束后,沸水浴30 min灭酶,在反应液中加入50 U/g糖化酶、50 U/g异淀粉酶和50 U/g普鲁兰酶[19],充分混匀后在40℃水浴摇床中反应10 h;反应结束后,沸水浴30 min灭酶,将反应液12 000 r/min离心 10 min,取上清液,经过滤膜过滤(0.45 μm)后用HPLC分析。
绘制大元环糊精标准曲线:称取大元环糊精标准品, 配制成相应的质量浓度(0.01、0.025、0.05、0.075、0.1、0.15、0.2 g/dL) 溶液, 经过超滤膜过滤(0.45 μm)备用。根据大元环糊精质量浓度和峰面积之间的关系得大元环糊精标准曲线,用于后续制备的大元环糊精的定量分析。

1.9 HPSEC体积排阻色谱法定量分析大元环糊精
利用HPSEC体积排阻色谱法测量大元环糊精的色谱条件是[14]:日立 Hitachi色谱仪,Super Multipore PW-N(6.0 mm × 150 mm)凝胶色谱柱,日立L-2490示差检测器,流动相0.05 mmol/L pH 6.6 Na2HPO4-柠檬酸缓冲液,流速0.3 mL/min;柱温设定为50℃。
2 结果与分析
2.1 重组菌 E.coli BL21/pET-24a (+)-AaAM 的构建
2.1.1 重组质粒pET-24a(+)-AaAM 的构建 以实验室保存的Aquifex aeolicus基因组为模板,通过PCR扩增获得AaAM基因片段,其大小经凝胶电泳验证为1.5 kb。将所得基因片段与克隆载体相连得到重组质粒pMD18-T®-AaAM,测序获取基因序列,所得AaAM基因编码的氨基酸序列与NCBI中Aquifex aeolicus来源的4-α-糖基转移酶基因序列同源性100%[16]。将表达载体pET-24a(+)和重组质粒pMD18-T®-AaAM双酶切、纯化回收后连接,转入E.coliJM109,培养重组菌并抽提质粒进行双酶切验证。如图1所示,在5 300 bp和1 500 bp附近有明显条带,条带大小与预期相符,表明重组表达载体pET-24a(+)-AaAM构建成功。

图1 重组质粒pET-24a(+)-AaAM酶切验证Fig.1 Restriction analysis of recombinant plasmid pET-24a(+)-AaAM
2.1.2 重组菌E.coliBL21/pET-24a(+)-AaAM 的构建及培养 将重组质粒pET-24a(+)-AaAM转化入宿主菌E.coliBL21(DE3),构建重组菌E.coliBL21(DE3)/pET-24a(+)-AaAM。 重组菌经 LB 培养后转接至TB培养基,并加入IPTG诱导,每隔5小时取样离心收集菌体,经超声破碎后得粗酶液测定酶活,酶活随时间变化的曲线见图2。随着时间的推移,重组4-α-糖基转移酶AaAM酶活不断增加,诱导27 h达到最高酶活0.99 U/mL,继续增加诱导时间,酶活呈下降趋势。蛋白质电泳SDS-PAGE结果见图3。在4-α-糖基转移酶AaAM理论相对分子质量60 000处出现一条蛋白质条带,AaAM在E.coliBL21(DE3)中成功表达。
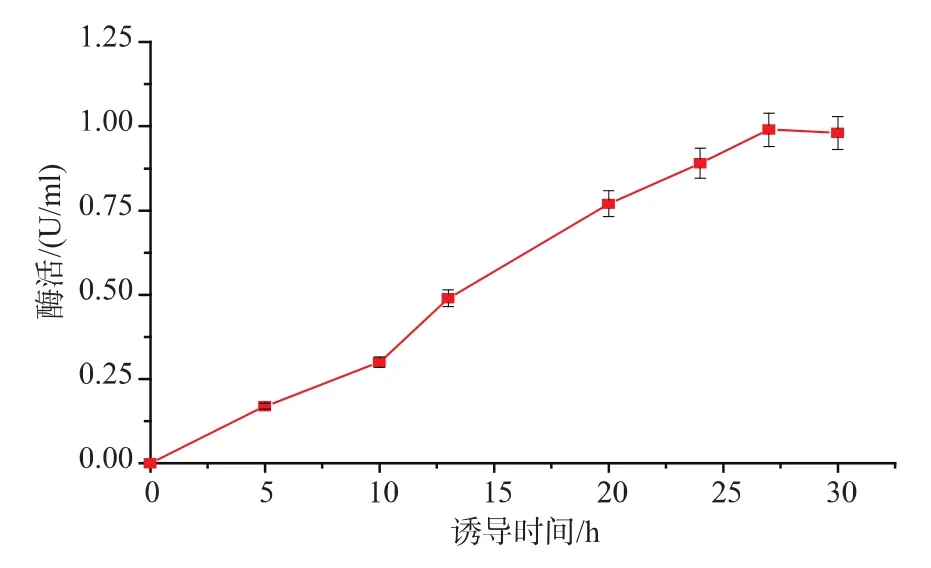
图2 重组菌在摇瓶发酵中的产酶曲线Fig.2 Fermentation process of the recombinant E.coli BL21(DE3) in shake flask
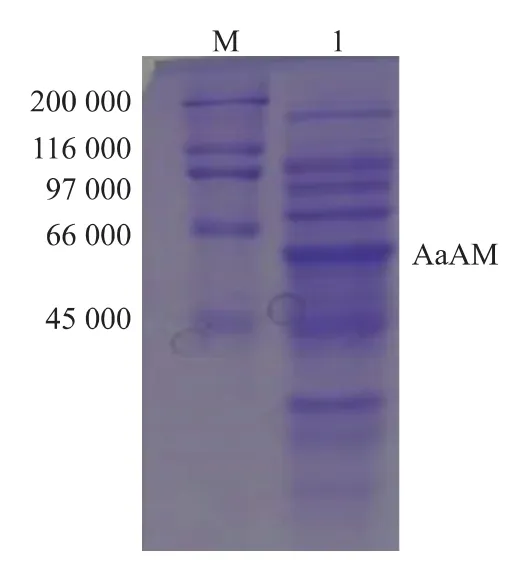
图3 4-α-糖基转移酶SDS-PAGE分析Fig.3 SDS-PAGE analysis of the AaAM
2.2 重组4-α-糖基转移酶制备大元环糊精工艺优化
2.2.1 4-α-糖基转移酶加酶量对大元环糊精转化率的影响 4-α-糖基转移酶是一种多功能型酶,具有环化、偶合、歧化和水解四种活力,其相互作用与反应体系中的加酶量有关,因此大元环糊精的转化率会受加酶量的影响[17]。作者以1 g/dL的马铃薯淀粉为底物,用pH 6.6 Na2HPO4-柠檬酸缓冲液对淀粉在70℃加热糊化10 min,加入不同量的AaAM,加酶量分别为 1、5、10、20、50、80、100 U/g 底物,探究其对大元环糊精转化率的影响。反应完成后,加入根霉来源的糖化酶、异淀粉酶、普鲁兰酶处理未反应的底物,产物用HPSEC法进行定量检测。如图4所示,随着加酶量的增大,大元环糊精转化率也逐渐增大,在加酶量20 U/g底物时转化率达到最大,为14.8%,之后加酶量增加,转化率呈下降趋势。分析可能的原因是,加酶量增大,水解和偶合反应加剧,已生成的大元环糊精转化为其他产物,因此转化率降低。考虑到经济性因素,选择加酶量为20 U/g。

图4 加酶量对酶转化的影响Fig.4Effectofenzymedosageontheenzymaticconversion
2.2.2 不同底物利用不同脱支酶先脱支再加入4-α-糖基转移酶对大元环糊精转化率的影响 作者以1 g/dL的四种常见淀粉:马铃薯淀粉、可溶性淀粉、玉米淀粉、木薯淀粉为底物,并采用50 U/g异淀粉酶、50 U/g普鲁兰酶分别先对淀粉进行脱支预处理,脱支反应完成后灭活脱支酶,再加入20 U/g的4-α-糖基转移酶AaAM制备大元环糊精。从图5可以看出,经脱支处理的淀粉底物酶转化效率提高,异淀粉酶脱支预处理后转化效率优于普鲁兰酶。其中以脱支处理后的可溶性淀粉为底物时,反应转化率最高达到25.8%,而未经脱支处理的可溶性淀粉转化率为15.6%,提高了1.65倍;脱支后的马铃薯淀粉转化率为23.6%,相对于未经脱支处理的可溶性淀粉转化率为14.8%,提高了1.59倍,脱支后的木薯淀粉和玉米淀粉的转化率相对较低,为19%左右。造成这种现象可能的原因是不同淀粉的空间结构以及直链和支链淀粉的组成比例不同[18]。考虑到马铃薯淀粉价格低廉,为降低生产成本,选择其作为底物。
2.2.3 初始pH对大元环糊精转化率的影响 pH变化可以影响酶活性中心基团的解离程度,进而影响酶分子与底物分子的结合,使转化效率发生改变。作者用pH 6.6 Na2HPO4-柠檬酸缓冲液对淀粉在70℃加热糊化10 min,加入50 U/g异淀粉酶脱支预处理,灭活脱支酶后,用NaOH和稀盐酸调节pH 分别为 4.0、5.0、6.0、7.0、8.0、9.0,加入 20 U/g 的4-α-糖基转移酶AaAM制备大元环糊精。从图6可以看出,在pH为4.0时,大元环糊精的转化率只有10.9%,可能是在偏酸性条件下,相当一部分酶失活;随着pH的升高,大元环糊精的转化率逐渐升高,当pH为7.0时,大元环糊精转化率最高,达到24.2%,与文献报道4-α-糖基转移酶AaAM最适pH 6.6接近[16];当pH继续升高时,大元环糊精的转化率下降。
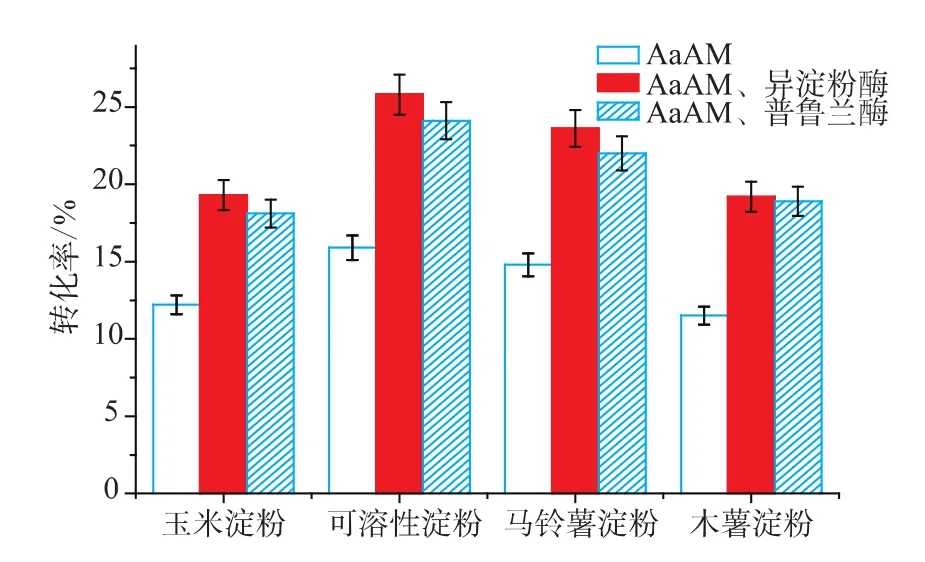

图6 反应pH对酶转化的影响Fig.6 Effect of pH on the enzymatic conversion
2.2.4 反应温度对大元环糊精转化率的影响 温度对酶的稳定性及催化速率有显著影响,本研究考察了不同温度对AaAM制备大元环糊精的影响。脱支后调节淀粉溶液pH为7.0,AaAM加酶量为20 U/g,分别在 60、65、70、75、80、85 ℃反应制备大元环糊精,结果见图7。在60℃时,转化率较低为11.9%,随着温度的升高,大环糊精转化率逐渐提高;在75℃下,大元环糊精的转化率达到最大值24.8%;温度继续升高,大元环糊精的转化率下降,在85°C时转化率降为19.6%。根据文献报道,AaAM最适温度为90℃,但在此温度下,转化率降低,这可能是由于温度较高时,酶的热稳定性变差[16]。综合以上因素,选用75℃的作为后续研究的反应温度。

图7 反应温度对酶转化的影响Fig.7 Effect of temperature on the enzymatic conversion
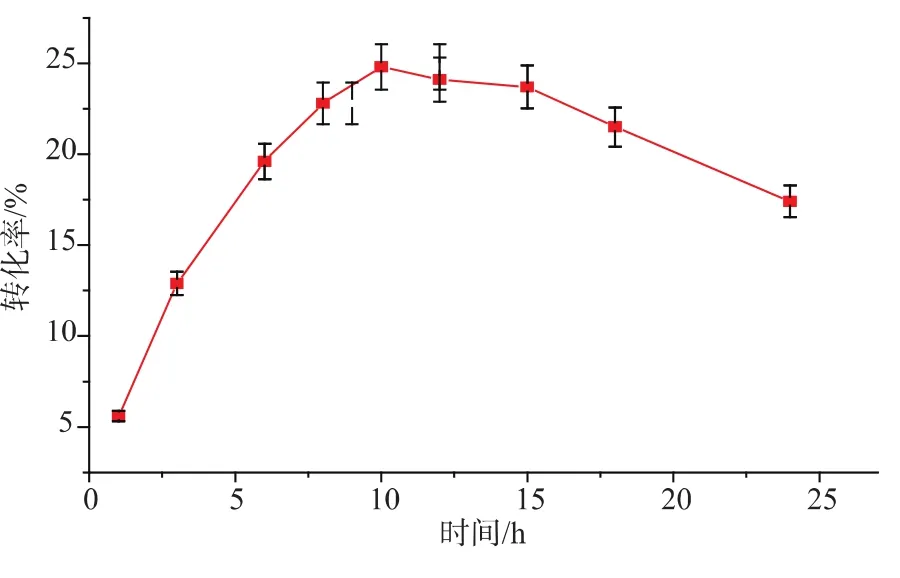
2.2.5反应时间对大元环糊精转化率的影响 在利用4-α-糖基转移酶制备大元环糊精过程中,随着反应时间的延长,酶反应体系内的小分子糖类物质增加,促进了4-α-糖基转移酶偶合作用而减弱了其环化活性,使得大元环糊精的转化率降低[12]。本研究在脱支后调节淀粉溶液pH为7.0,AaAM加酶量为20 U/g,在75℃下反应制备大元环糊精。每隔3小时取样测定生成的大元环糊精产量。在酶转化反应前期,随着反应时间的增加,大元环糊精转化率一直上升至10 h左右达到最高转化率24.8%,之后转化率呈明显下降趋势,见图8。为节约成本,增加生产强度,反应时间应定为10 h。
3 结语
目前大元环糊精的制备仍处于实验研究阶段,多以直链淀粉为底物,价格昂贵,并未实现商品化。关于利用天然淀粉制备大元环糊精的研究,许燕等使用经异淀粉酶脱支处理的1 g/dL高直链玉米淀粉,在二甲亚砜反应体系中与Thermus aquaticusATCC 33923来源的4-α-糖基转移酶进行转化反应,将大元环糊精的最大转化率由24.55%提高到45.58%[14]。本研究中将来源于超嗜热菌Aquifex aeolicus的基因AaAM在大肠杆菌中经过克隆表达,成功构建了表达4-α-糖基转移酶AaAM的重组菌E.coliBL21(DE3)/pET-24a(+)-AaAM,摇瓶发酵酶活最大为0.99 U/mL。作者使用价格低廉的马铃薯淀粉,经过优化加酶量、与不同脱支酶复配、优化初始pH、反应温度、反应时间,在底物质量浓度为1 g/dL时,先经过50 U/g底物异淀粉酶脱支预处理,灭活脱支酶后,调节初始pH为7.0,在75℃下加入20 U/g底物的4-α-糖基转移酶AaAM时,在10 h时大元环糊精的转化率达到最高24.8%,为大元环糊精的工业生产奠定了基础。

