贵州小麦糯性基因多重 PCR 体系的优化
,,, , ,,,
(1.贵州省农业科学院旱粮研究所,贵阳 550006; 2.贵州大学生命科学院,贵阳 550025)
普通小麦(TriticumaestivumL.)胚乳中含有直链和支链2种淀粉。其中颗粒结合淀粉合成酶Ⅰ(Granules-bound starch synthaseⅠ,GBSS Ⅰ),又称Wx蛋白,由蜡质基因控制合成,是禾谷类作物控制直链淀粉合成的关键酶。普通六倍体小麦(Triticum aestivum L.,AABBDD)含有3个蜡质基因位点:位于染色体7 AS的Wx-A1、4 AL的Wx-B1和 7 DS的Wx-D1[1-2]。后来研究发现了3种Wx基因的缺失型Wx-A1b、Wx-B1b和Wx-D1b,则相对的野生型基因型则为Wx-A1a、Wx-B1a和Wx-D1a。小麦中Wx蛋白控制着小麦籽粒中直链淀粉的合成,其Wx基因的缺失使小麦胚乳中直链淀粉的含量下降,因此,小麦胚乳表现出糯性[3-4]。研究发现,任何一种Wx蛋白亚基的缺失都能改变小麦的直链淀粉合成,3个Wx基因蛋白亚基全缺失的小麦称为全糯小麦,1个或2个Wx基因蛋白亚基缺失,会造成直链淀粉的合成受到影响,支链淀粉含量升高,称为部分糯小麦[5]。而全糯小麦几乎不含直链淀粉或者含量极低(<1%)[6]。
目前国内外学者已开发出鉴定3个糯质基因的STS标记和SSR标记,并且Wx-A1基因的STS标记已成功用于澳大利亚优质面条[7-10]。刘迎春等[11]在扬麦10与关东107的杂交后代中,利用引物MAG 264和MAG 269分别筛选出Wx-A1、Wx-D1缺失型的部分糯性小麦,并得出MAG 264、MAG 269分别是Wx-A1、Wx-D1两者的专一性PCR标记。任丽娟等[12]用SSR标记,同时对小麦的3个Wx基因位点进行检测,在杂交后代中获得4株全糯小麦。邓万洪等[13]利用序列标志位点标记技术,对中国核心小麦种质品种进行分析,并用SDS-PAGE进行验证,筛选出了Wx-B1基因缺失型小麦。近年来,利用基于PCR的多重PCR技术对基因进行检测的分子标记技术不断被应用在小麦的糯性检测中,卢龙斗等[14]通过在一个PCR体系中加入2对引物,分别对3个糯质基因进行扩增,成功在矮抗与糯麦1902的后代群体中,分离得出Wx-A1、Wx-D1突变型各2株,Wx-B1突变型3株,同时缺失Wx-B1,Wx-D1基因的2株,Wx-A1,Wx-B1两者都缺失的1株,3个基因都缺失的1株。这些利用多重PCR检测小麦糯质基因的实验。为后来学者采用多重PCR检测小麦糯质基因奠定了基础。
表1 引物序列及其扩增片段大小

基因名称引物名称引物序列(5'→3')扩增片段大小(bp)参考文献Wx-D1a/bMAG269FCGAGCGGCTACTCAAGAGCMAG269RGGCGGTCATCTGTCATTTCC1400/800刘迎春[11]Wx-B1a/bBRDCTGGCCTGCTACCTCAAGAGCAACTBFDLCTGACGTCCATGCCGTTGACGA-/425Nakamura et al[20]Wx-A1a/bMAG264FCCAAAGCAAAGCAGGAAACCMAG264RTACCTCGGAGATGACGCTGG336/317刘迎春[ 11]
糯小麦中支链淀粉含量高,糊化起始温度低,黏度大,具有良好的抗老化特性,制作耐冷藏的速冻食品,以及延长面包类制品的货架寿命[15];糯小麦淀粉凝胶表面酥脆、淀粉糊透明度、冻融稳定性好[16];糯小麦淀粉比普通小麦淀粉具有高含量的蛋白质和湿面筋,而且糯小麦淀粉还具有延伸性好、持水性能力强、其面团的粘性大等优点[17];在造纸业和食品工业中具有很大的应用前景[18]。糯小麦不仅可以作为主食食用,而且在酿酒上也有很大的应用前景,赵国军等[21]对糯小麦的酿酒特性进行研究,得出糯小麦的出酒率比普通小麦和高粱的出酒率都高,因此具有很高的经济价值[16-19]。
本研究利用多重PCR结合田间农艺性状调查的方法对渝糯麦5号、自育品系4 th 6008以及杂交F3代的72个单株的糯性蛋白基因进行鉴定,利用与小麦糯质基因(Wx-A1a,Wx-B1a和Wx-D1a)连锁的3个特异分子标记MAG 264、BDFL/BRD、MAG 269对其小麦品种(系) 中Wx 蛋白亚基分布的多态性;验证贵州小麦品种(系)Wx基因特异分子标记的有效性;利用有效的分子标记构建Wx基因多重 PCR 体系,为分子标记辅助选择提供快速有效的方法,提高小麦淀粉品质评价和糯小麦选育的效率。
1 材料与方法
1.1 供试材料
本实验采用小麦系为实验材料,由贵州省农业科学院小麦课题组提供。
1.2 多重PCR引物
通过搜索文献,筛选MAG 269、MAG 264和BRD/BFDL对Wx基因位点进行标记,其引物序列和PCR预期扩增条带如表1,引物序列由上海生物工程科技有限公司合成。
1.3 DNA的提取
种子发芽进行幼苗培养,取新鲜叶片,采用CTAB法提取总基因组,略做修改,提取的DNA 样品稀释到100 ng/μL备用。
1.4 Wx-A 1、Wx-B 1、Wx-D 1位点的单重PCR鉴定
PCR反应体系(20μL):10×Buffer 2.0μL,2.5 mM dNTP Mixture 0.4μL,每种引物各0.2,0.5,0.7μL,Template DNA 2.2μL,rTaqDNA Polymerase 0.11μL,补ddH2O 20μL。PCR扩增程序:94 ℃ 预变性5 min,94 ℃变性45 s,退火温度每个循环降低0.4 ℃,35个循环,即从第1次循环时的66 ℃降到最后1次循环的52 ℃,然后72 ℃延伸10 min,4 ℃保存。 PCR扩增在MJ Research PTC-200型PCR仪上完成。取4μL扩增后的产物在8%的非变性聚丙烯酰胺凝胶电泳进行检测,l×TBE缓冲液,100 W恒功率下,电泳1 h分离PCR产物,银染,银染后凝胶成像系统检测、照相。
1.5 多重PCR扩增及电泳检测
3个Wx蛋白亚基基因标记的多重PCR体系及反应条件参照张晓科设定的条件,进一步进行优化,反应体系及条件如表2所示。PCR扩增程序采用touchdown体系,退火温度每个循环降低0.2 ℃,44个循环,即从第2次循环时的66 ℃降到最后1次循环的57.4 ℃,然后72 ℃延伸7 min,4 ℃保存。PCR扩增在MJ Research PTC-200型PCR仪上完成。取4μL扩增后的产物在8%的非变性聚丙烯酰胺凝胶电泳进行检测,l×TBE缓冲液,160 V恒压下,电泳1~1.5 h分离PCR产物,银染,银染后凝胶成像系统检测、照相。
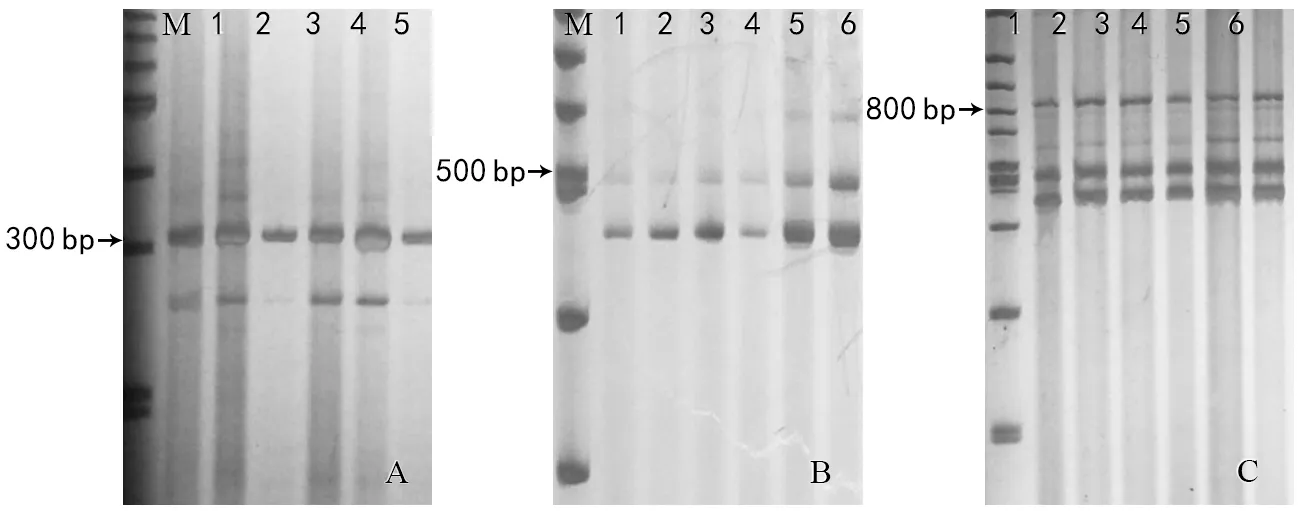
图1 MAG 264、BRD/BFDL、MAG 269单重PCR图
表2 多重PCR反应和电泳条件

项目名称多重PCR体系基因标记Wx-A1、Wx-B1、Wx-D1PCR反应体系25μLrTaq DNA Polymerase0.5μL2.5mM dNTP Mixture2.3μL10μmol/μL引物浓度0.68/0.5/0.68PCR扩增条件预变性94℃,5min,变性94℃,50s退火66~57.4℃(-0.2℃/第2个循环),50s延伸72℃,1min 20s循环数44最后延伸72℃,7min电泳条件Native-PAGE(%)8电压(V)160时间(h)1~1.5
2 结果与分析
2.1 单重PCR的检测
野生型Wx-A1a基因序列比突变型Wx-A1b的核酸序列多19 bp。利用 Wx-A 1位点特异性引物在随机选取的样本中仅扩增出317 bp带,不能扩出 336 bp条带。从图1-A可看出,在8%非变性聚丙烯酰胺凝胶中,条带较清晰,分辨率较好。
Wx-B 1位点特异性引物BRD/BFDL,从野生型材料Wx-B 1 a 位点扩增出425 bp条带,却不能从突变型材料Wx-B1b基因型中扩增出 425 bp条带。从图1-B可看出,虽然PCR反应条件简单,但未扩增出425 bp的条件,说明该材料为Wx-B 1的缺失型植株。
由于刘迎春设计的突变型Wx-B 1 b 基因的3′序列缺失位置设计引物,因此,在野生型Wx-B 1 a植株中扩增片段为1 400 bp,在突变型Wx-B 1 b植株中扩增片段大小为800 bp。从图1-C可看出,在随机选取的样本中均能扩增出800 bp的条带,且条带清晰,说明该植株为Wx-D 1的缺失型植株。
2.2 多重PCR检测结果
Wx-A 1位点在野生型(Wx-A1a) 中扩增出336 bp 条带,在突变型(Wx-A1b)中扩增出317 bp 条带;Wx-B 1位点扩增结果会出现多个条带,425 pb条带是判断是否含有Wx-B 1突变的糯质基因Wx-B1b,在突变型(Wx-B1b)中Wx-B1基因扩增出425 bp条带,而在野生型中扩增不出该条带。若扩增出1 400 bp条带,则为Wx-D 1野生型,800 bp条带则为Wx-D 1突变型(图3);Wx-D 1位点标记在野生型(Wx-D1a)中扩增出1 400 bp 的条带,在突变型(Wx-D1b)中扩增出 800 bp 条带。在图3多重PCR体系随机检测的 10个材料中(图 2),1,3,5,6,8,9号泳道都扩增出了800 bp 条带,说明Wx-D 1 位点为Wx-D1b等位基因,其余产生1 400 bp条带,为野生型Wx-D1a。同时,1,3,5,6,8,9号材料都能扩增出371 bp、425 bp、800 bp三条带,为缺失型的全糯小麦。2,4,7,10号泳道同时扩增出317 bp、425 bp的条带,为Wx-A 1、Wx-B 1的缺失型。
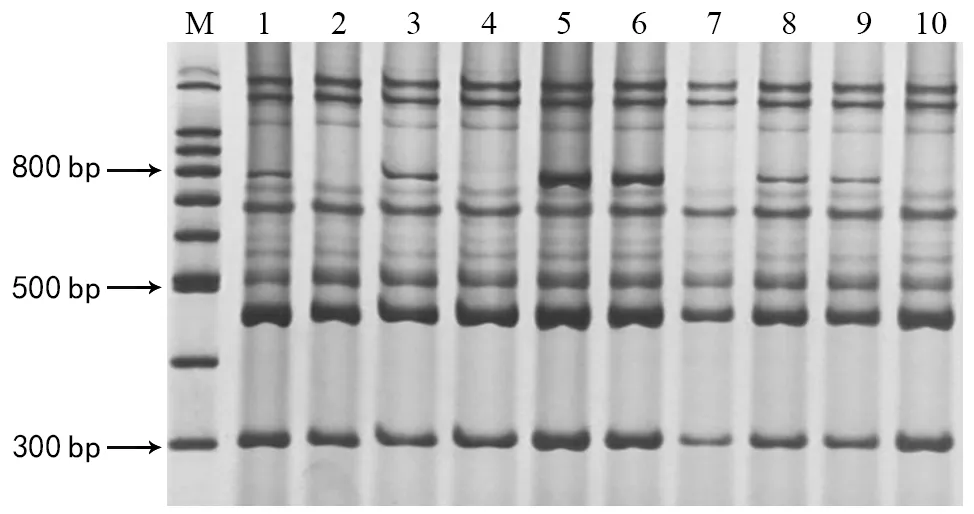
图2 糯性基因多重PCR体系优化图
2.3 小麦基因位点
a为野生型,b为突变型;Wx-A 1野生型的基因型:A- ,Wx-A 1野生型的基因型为aa ;Wx-B 1野生型的基因型:B-,Wx-B 1突变型的基因型:bb;Wx-D 1野生型的基因型:D-,Wx-D 1突变型的基因型:dd。
表3 F3代72株基因位点统计结果

编号Wx-A1Wx-B1Wx-D1基因型表现型1bbbaabbdd全糯2bbbaabbdd全糯3bbaaabbD-部分糯4abbA-bbdd部分糯5abbA-bbdd部分糯6bbaaabbD-部分糯7bbbaabbdd全糯8bbaaabbD-部分糯9aabA-B-dd部分糯10bbbaabbdd全糯11bbbaabbdd全糯12bbaaabbD-部分糯13bbaaabbD-部分糯14bbbaabbdd全糯15abbA-bbdd部分糯16abbA-bbdd部分糯17bbbaabbdd全糯18abbA-bbdd部分糯19bbaaabbD-部分糯20bbaaabbD-部分糯21bbbaabbdd全糯22bbaaabbD-部分糯23bbaaabbD-部分糯24bbbaabbdd全糯25bbbaabbdd全糯26abbA-bbdd部分糯27abaA-bbD-部分糯28abbA-bbdd-部分糯29bbbaabbdd全糯30bbbaabbdd全糯31bbbaabbdd全糯32bbbaabbdd全糯33bbbaabbdd-全糯34abbA-bbdd部分糯35abbA-bbdd部分糯36bbaaabbD-部分糯37abaA-bbD-部分糯38abbA-bbdd部分糯39abbA-bbdd部分糯40bbbaabbdd全糯41abaA-bbD-部分糯42abbA-bbdd部分糯43abbA-bbdd部分糯
续表3
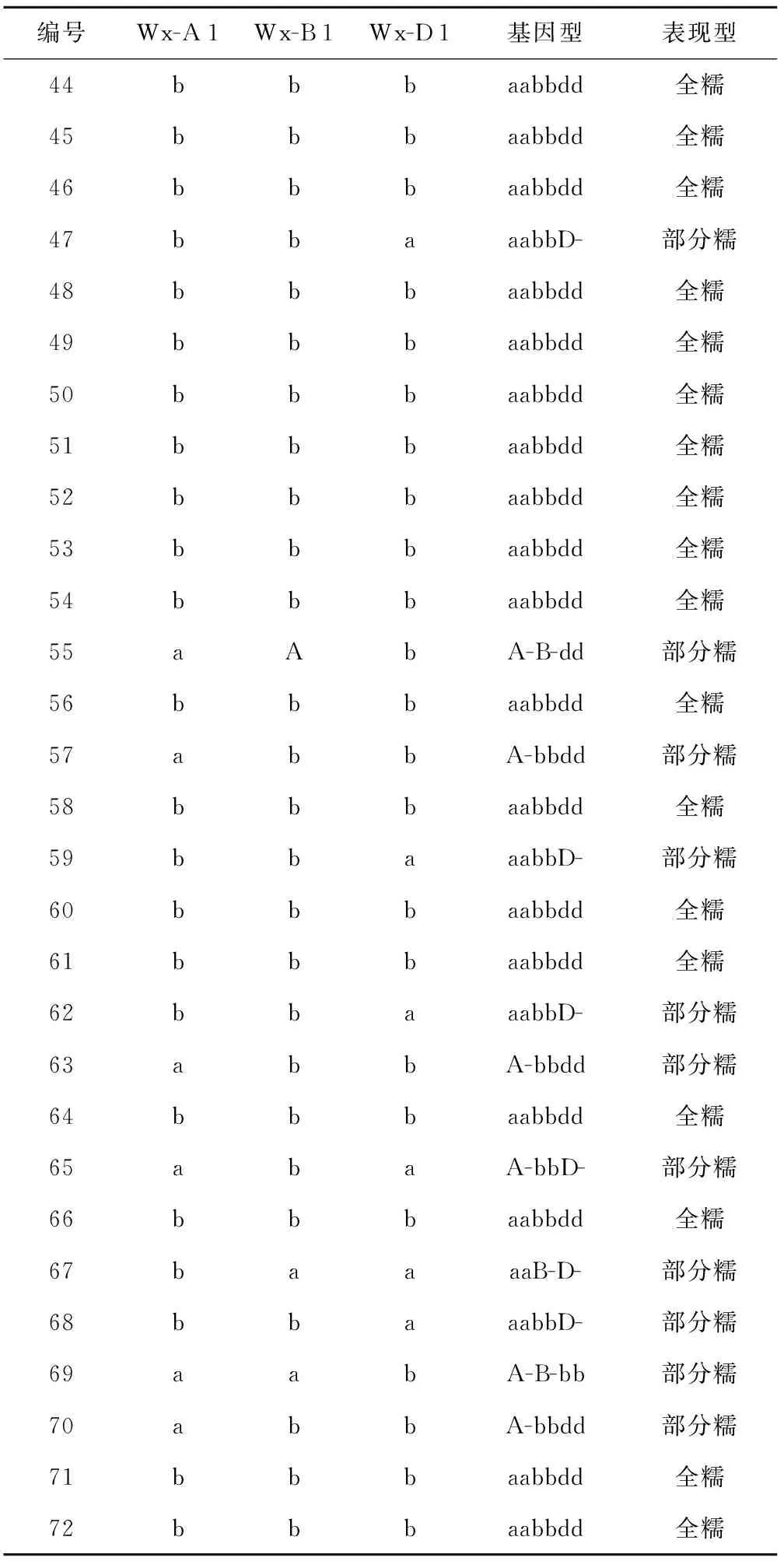
编号Wx-A1Wx-B1Wx-D1基因型表现型44bbbaabbdd全糯45bbbaabbdd全糯46bbbaabbdd全糯47bbaaabbD-部分糯48bbbaabbdd全糯49bbbaabbdd全糯50bbbaabbdd全糯51bbbaabbdd全糯52bbbaabbdd全糯53bbbaabbdd全糯54bbbaabbdd全糯55aAbA-B-dd部分糯56bbbaabbdd全糯57abbA-bbdd部分糯58bbbaabbdd全糯59bbaaabbD-部分糯60bbbaabbdd全糯61bbbaabbdd全糯62bbaaabbD-部分糯63abbA-bbdd部分糯64bbbaabbdd全糯65abaA-bbD-部分糯66bbbaabbdd全糯67baaaaB-D-部分糯68bbaaabbD-部分糯69aabA-B-bb部分糯70abbA-bbdd部分糯71bbbaabbdd全糯72bbbaabbdd全糯
2.4 F3代群体中糯质小麦频率
对72个F3代分离群体中有34(47.22%)株小麦在800 bp、425 bp、317 bp同时扩增出三条带,即Wx-A1、Wx-B1、Wx-D1同时缺失型的全糯小麦;扩增出317 bp、425 bp片段的有14株(19.44%)Wx-A1、Wx-B1缺失型;同时扩增出800 bp、425 bp的Wx-B1、Wx-D1缺失型的有16株(22.22%);只扩增425 bp的Wx-B1基因缺失型的4株(5.56%)和只扩增800 bp的Wx-D1基因缺失型的3株(4.17%)以及只扩增出316 bp的Wx-A1基因缺失型的1株(1.39%)。
3 讨 论
普通小麦中直链淀粉含量为22%~25%,籽粒中直链淀粉和支链淀粉含量的比例受不同的Wx蛋白亚基的影响,Wx 蛋白亚基通常采用2 D-SDS-PAGE 和1 D-SDS-PAGE进行电泳检测分离,但操作繁琐,难度大。后续出现改良后的1 D-SDS-PAGE 分离并分析 Wx 蛋白的亚基构成,简便、快速,适用于小麦育种中对 Wx 蛋白类型的初步筛选。同时,由于Wx-B 1 和 Wx-D 1 亚基的分子量、等电点相近,运用SDS-PAGE不易区分。Wx蛋白分子标记的开发与应用,不仅提高育种效率,而且使分子标记辅助育种在小麦育种中得到应用。目前国内外已开发了大量的SSR、STS- PCR和分别检测WxA1和Wx-D1a的 CAPS 和 dCAPS标记,梁荣奇等[21]应用SSR标记对江苏白火麦回交改良群体中个体进行辅助选择,得到了含Wx-D1b的7 D单体,为将来进一步改良糯性小麦的农艺性状提供广泛的遗传材料。
宋建民等[22]根据Wx-A1、Wx-B1和Wx-D1的3个位点基因序列和变异情况分别设计了PCR引物,但设计的 Wx-B 1位点引物,以及刘迎春等[11]建立专一检测Wx-A 1位点和Wx-D 1位点的PCR标记MAG 264和MAG 269。
本研究利用与小麦糯质基因(Wx-A1a,Wx-B1a和Wx-D1a)连锁的3个特异分子标记MAG 264、BDFL/BRD、MAG 269,对F3代分离群体进行分子标记,扩增产物条带清晰易辩,操作简单,效率高,并且,由于Wx-A 1和 Wx-D 1采用的是共显性标记,能够清晰的明确杂交后代的基因型,避免了显引物扩增中出现的假阴性问题。而鉴定Wx-B 1位点采用的是显性标记,避免因片段缺失出现误差。并且,Wx基因在对应的标记位点都有相对应的扩增产物。因此,适用于Wx基因共分离的分子标记技术,结合传统育种手段,对杂交后代材料中的糯性基因进行跟踪选择,选育综合性状优良、适合贵州生态气候、可用于生产推广的糯性小麦新材料,加快新品种选育效率。

