艰难梭菌毒素A适配子的筛选和鉴定*
刘红菊,苏 恒,吴爱武
(广州医科大学金域检验学院,广州 510182)
艰难梭菌(Cd)在临床上可引起抗生素相关性腹泻等诸多感染性疾病,统称为艰难梭菌感染(CDI),其引起感染的主要毒力因子是产生毒素A(TcdA)和毒素B(TcdB),TcdA为肠毒素,可引起肠壁分泌大量液体和出血性坏死,临床通过检测Cd是否产生上述毒素而辅助诊断CDI。TcdA的羧基末端(C端)为重复的寡肽结合区(CROP),CROP既是TcdA与易感宿主细胞受体结合的区域,同时也是相应抗体阻断TcdA结合宿主细胞表面的位点[1]。适配子是一种可以通过指数富集配体系统进化(SELEX)技术筛选得到的具有识别功能的新型寡核苷酸链,其本质为单链DNA(ssDNA)或RNA片段,它们可以形成各种二级结构折叠成稳定独特的三维空间结构,与靶分子配体进行高亲和力和特异性结合,与特异性抗体识别相应抗原表位过程类似,具有库容量大、靶分子范围广、亲和力高、特异性强等优点,已成为实验室诊断最热门的研究领域之一[2-3]。本研究以重组TcdA蛋白为靶分子,采用SELEX技术,拟筛选与重组TcdA特异性结合的寡核苷酸适配子,以期为临床实验室快速诊断和治疗CDI提供一定参考依据,现报道如下。
1 材料与方法
1.1材料 艰难梭菌产毒素A菌株为纯化分离自临床并保存于广州医科大学检验系实验室的菌株[4],pET-28b为广州医科大学检验系实验室保存质粒;E.coli-DH5α和E.coli-BL21感受态细胞购自北京天根生化科技有限公司。
1.2主要试剂 抗艰难梭菌毒素A抗体购自Abcom公司;UNIQ-10寡核苷酸纯化试剂盒购自上海生工科技有限公司;T4 DNA连接酶、DNA Ladder、Premix Taq 聚合酶均购自Takara公司;羊抗鼠IgG-辣根过氧化物酶(HRP)购自Thermo Scientific公司;双排磁力架、链霉亲和素磁珠购自Invitrogen公司;tRNA购自Sigma公司;HRP标记-抗地高辛抗体购自美国Jackson公司;TMB检测试剂盒购自北京鼎国生物有限公司。所有试剂均在有效期内使用。
1.3构建ssDNA文库 构建长度为80 bp的随机DNA文库,引物和ssDNA文库合成及测序由上海英潍捷基有限公司完成,文库中所有ssDNA碱基序列从5′→3′的构成如下:5′-AGT CAG TAG TTC AGG CAG CG-40N-CAC AGC ACA CTC ACA CGC AC-3′,若中间为n个碱基的随机序列,则ssDNA文库量可达4n,本研究文库中所有ssDNA序列中间为40个随机碱基序列,意味着本研究的DNA随机文库容量可达440。用于链霉亲和素磁珠筛选的生物素标记物放在下游引物和中间的40个随机碱基序列之间,即5′-AGT CAG TAG TTC AGG CAG CG-40N-biotin-CAC AGC ACA CTC ACA CGC AC-3′。
1.4方法
1.4.1艰难梭菌毒素A羧基末端序列的克隆、表达与纯化 对纯化获得的重组TcdA蛋白采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分析,并进行蛋白免疫印迹法(Western blot)鉴定[5]。
1.4.2聚合酶链反应(PCR)扩增优化反应条件摸索 以合成的ssDNA随机文库作为模板,采用上下游引物进行PCR扩增获得双链DNA(dsDNA),以ddH2O作为模板设立阴性对照。根据引物的解链温度设置不同退火温度,分别进行经5、8、12、16、20、24、28个循环数的PCR。经4%琼脂糖凝胶电泳分析,观察试验结果,确定对称PCR的最优退火温度和循环次数。
1.4.3SELEX筛选 根据文献[6]操作流程进行TcdA适配子的SELEX筛选,取预定量纯化重组蛋白TcdA包被于96孔板,同时用ddH2O设空白对照,4 ℃包被过夜,洗涤3次,空白对照孔和蛋白包被孔分别用3%牛血清清蛋白(BSA)封闭2 h。用10 pmol/μL的ssDNA先与空白对照孔结合45 min,反筛去除与BSA结合的ssDNA,并测定此时ssDNA浓度,再与蛋白包被孔结合45 min,洗涤6次,加入洗脱缓冲液在80 ℃下加热15 min,洗脱下与TcdA结合的ssDNA,回收ssDNA并测定其浓度,每轮筛选所用量见表1。采用下游引物5′端标记生物素引物,PCR扩增ssDNA成dsDNA后,用0.1 mol/L的NaOH解离dsDNA成ssDNA,再采用链霉亲和素包被磁珠分选并获得反义ssDNA作为下一轮筛选的模板文库,如此重复直至ssDNA文库与TcdA结合率不再增加为止。
1.4.4ssDNA文库与TcdA结合率测定 筛选纯化后所得ssDNA文库的总量与反筛后ssDNA文库总量比值,即每轮文库与蛋白的结合率。

表1 不同筛选轮数重组蛋白TcdA及ssDNA用量
1.4.5文库的克隆和测序 将第12轮获得的ssDNA扩增为dsDNA后,与pMDTM 19-T载体进行连接,导入DH5α感受态细胞于LB/氨苄青霉素/X-Gal/异丙基硫代β-D-半乳糖苷(IPTG)平板培养基37 ℃培养24 h。挑取60个转化阳性菌落进行测序。
1.4.6适配子同源性和二级结构分析 根据测序结果,分别选择DNA MAN软件和mfold软件进行序列同源性和二级结构分析。
1.4.7适配子-A22(Apt-A22)亲和常数(KA)测定
1.4.7.1重组TcdA包被浓度确定 96微孔板每孔加入200 μL浓度分别为2、1、0.5、0.25、0.125、0.062 5、0.031 25 μg/mL TcdA重组蛋白,同时设立空白对照孔,4 ℃包被过夜,洗涤3次后,空白对照孔和蛋白包被孔均加入200 μL封闭液,37 ℃封闭2 h。去除封闭液,洗涤缓冲液洗涤4次。在各蛋白孔中分别加入200 μL的40 ng/μL的Apt-A22溶液,37 ℃孵育2 h,洗涤缓冲液洗涤4次,向各反应孔中加入200 μL HRP标记的地高辛抗体稀释液(稀释度为1∶10 000),37 ℃孵育45 min,磷酸盐缓冲液洗涤5次,加入100 μL 3,3′5,5′-四甲基联苯胺(TMB)显色剂后37 ℃孵育30 min,后加入100 μL终止液终止反应,测定其光密度(OD)450值。
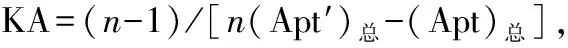
2 结 果
2.1TcdA在大肠埃希菌中的表达与鉴定 pET-28b-TcdA重组表达质粒的最佳表达条件为菌液600 nm波长OD值选择0.6,诱导温度为25 ℃,IPTG诱导终浓度取1.0 mmol/L,诱导时间取10 h,在35×103处出现了目的蛋白(泳道4)。按照此条件诱导重组质粒,收集细菌裂解液上清液和沉淀进行SDS-PAGE,目的蛋白表达量高,见图1。Western blot结果显示,TcdA抗体可识别目的蛋白,不能识别pET-28b菌株蛋白,见图2。
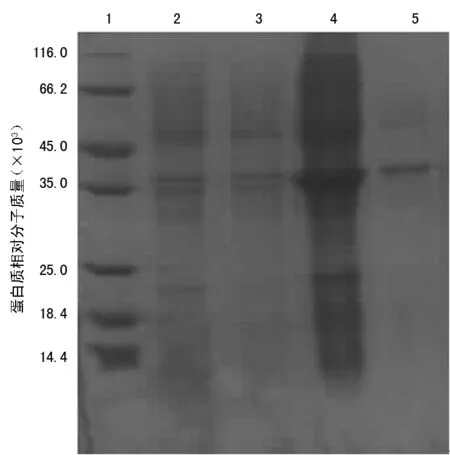
注:1表示蛋白Marker条带;2表示pET-28b经IPTG诱导的上清液;3表示pET-28b经IPTG诱导的沉淀;4表示pET-28b-TcdA经IPTG诱导的上清液;5表示pET-28b-TcdA经IPTG诱导的沉淀
图1 pET-28b-TcdA重组质粒在最佳诱导表达条件下
菌液裂解液SDS-PAGE电泳分析

注:1表示PET-28b菌株蛋白;2表示目的蛋白
图2目的蛋白的Western blot鉴定
2.2PCR扩增优化反应条件 采用ssDNA文库作为模板时,在PCR扩增过程中对其循环数与引物特异性退火温度进行摸索,结果显示,在退火温度为55 ℃、循环数为8时,目的条带显示为单一条带,且无非特异性条带出现,见图3。

注:M表示10 bp DNA Ladder;1表示PCR循环数为5;2表示PCR循环数为8;3表示PCR循环数为12;4表示PCR循环数为16;5表示PCR循环数为20;6表示PCR循环数为24;7表示PCR循环数为28
图3采用ssDNA文库作为模板进行PCR时
不同循环数下扩增结果
2.3各轮ssDNA随机文库与TcdA结合率 经过12轮筛选,至第10、11、12轮筛选后适配子结合率变化不明显,说明结合率峰值趋于饱和,达到44.6%,见图4。
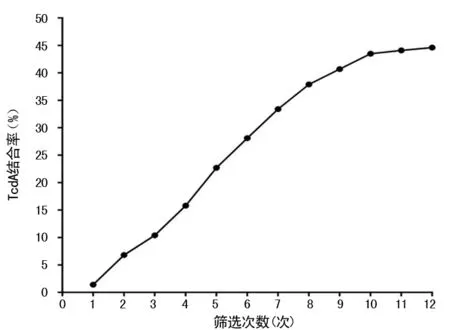
图4 各轮随机文库与TcdA结合率
2.4克隆测序结果 TcdA筛选后克隆测序的有效适配子为50条。
2.5适配子序列同源性和二级结构分析 测序的50条有效适配子进行多序列比对,总体同源性为45.27%。将具有90%以上同源性的序列归为一组,可分为6组:第1组包括Apt-A1、Apt-A3、Apt-A13、Apt-A23、Apt-A25、Apt-A37、Apt-A40、Apt-A57,其中前5个适配子序列完全相同,而Apt-A37、Apt-A57序列中均只有1个碱基与上述序列不同;第2组包括Apt-A5、Apt-A55,二者序列完全相同;第3组包括Apt-A17、Apt-A36,二者序列完全相同;第4组包括Apt-A14、Apt-A27、Apt-A58、Apt-A60、Apt-A43,其中前4个适配子序列完全相同,Apt-A43与前4条序列只有1个碱基不同;第5组包括Apt-A44、Apt-A59,二者序列完全相同;第6组包括Apt-A22、Apt-A29,二者序列完全相同。见表2。其余序列同源性均较低。二级结构分析结构最稳定的TcdA适配子是Apt-A22,其自由能为dG=-1.30 kcal/mol。
2.6适配子KA测定
2.6.1重组蛋白TcdA包被浓度确定 当倍比系列浓度(2、1、0.5、0.25、0.125、0.062 5、0.031 25 μg/mL)重组蛋白TcdA包被时,其OD450值分别为1.145、0.623、0.417、0.234、0.175、0.096、0.065,在蛋白浓度为2、1、0.5 μg/mL时,OD450值均在0.15~2.50,说明在此范围内OD值与包被板的重组蛋白浓度有一定线性关系。选定重组蛋白浓度分别为2、1、0.5 μg/mL时,测定其与二级结构最稳定的适配子Apt-A22的反应曲线。

表2 重组蛋白TcdA经12轮SELEX筛选后获得的同源性适配子序列
2.6.2Apt-A22与重组蛋白TcdA的KA测定 蛋白浓度为2 μg/mL、OD450为50%时,Apt-A22浓度约为1.373 ng/μL;蛋白浓度为1 μg/mL,OD450为50%时,Apt-A22浓度约为2.194 ng/μL;蛋白浓度为0.5 μg/mL、OD450为50%时,Apt-A22浓度约为3.76 ng/μL。将上述值代入公式计算相应KA,KA1=3.06×107M-1;KA2=1.60×107M-1;KA3=2.08×107M-1。因此适配子Apt-A22与重组蛋白TcdA的KA=2.25×107M-1,见图5。
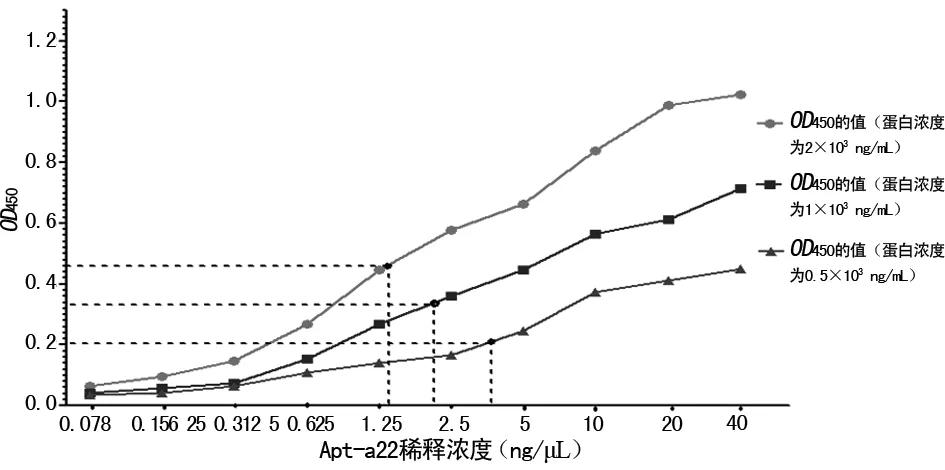
图5 Apt-A22与TcdA重组蛋白亲和曲线
3 讨 论
TcdA的羧基末端可结合易感靶细胞表面的受体,介导TcdA进入细胞内,从而破坏细胞结构[1]。实验室通过检测TcdA羧基末端的存在,可辅助临床诊断和阻断CDI。本课题组前期工作已通过系列试验在成功构建pET-28b-TcdA羧基末端表达载体的基础上,将其转化入大肠杆菌表达菌BL21中,并对其进行诱导表达及获得纯化目的蛋白,为相应适配子的筛选提供研究基础。
在适配子筛选过程中,随机文库的构建、每轮PCR扩增条件的优化、靶蛋白与文库结合浓度的调整、次级文库的制备等都是影响筛选的重要因素,需要进行反复摸索与验证。本研究体外合成的ssDNA文库随机序列由40个碱基组成,理论上有440个随机碱基序列文库容量,可满足SELEX筛选量的需要。在整个SELEX技术筛选过程中要多次重复进行对称PCR扩增,以ssDNA随机文库作为模板,通过对称PCR,可获得大量dsDNA,这些dsDNA通过链霉亲和素-生物素系统分离随机文库,可获得大量ssDNA,作为下一轮的筛选文库。PCR扩增条件对PCR结果影响较大,为了获得大量且特异性强的dsDNA产物,必须对PCR扩增循环条件进行优化。本研究通过优化PCR循环条件,结果显示,在退火温度为55.0 ℃、8个循环的条件下,于80 bp Ladder处成功检测到单一而清晰的条带,说明文库构建成功。
文库浓度与靶蛋白浓度比例是SELEX筛选过程中重要的环节之一,在初始阶段,由于文库中高亲和力适配子浓度低,因此,在初始的几轮筛选中,需使用较高浓度靶蛋白进行筛选。随着筛选轮数增加,结合力更高、特异性更强的适配子相对富集,而亲和力低的适配子逐渐淘汰,靶蛋白及ssDNA随机文库的用量均减少,但文库量与靶蛋白浓度相对比例升高,使结合力更强的ssDNA竞争结合到相应的靶蛋白的结合靶点,以获得特异性更强的适配子。本研究从第2轮开始加入tRNA,与ssDNA非特异性竞争结合靶蛋白,也有利于从随机文库淘汰低亲和力的适配子。当筛选到第10~12轮时,结合率不再增加,说明目标适配子已得到富集。ssDNA二级结构是靶分子与适配子特异性结合的结构基础,适配子主要是靠氢键和电荷与电荷之间的相互作用识别蛋白质[8-9]。本试验采用适配子文库的此特性,筛选出50条重组蛋白毒素A的有效适配子,通过同源树图进行分组,将同源性达到90%的分为一组,共分为6组。每个适配子序列相差1个碱基,其二级结构相差较大,适配子的二级结构主要以茎环为主,茎环结构可由序列的各个区域组成。适配子二级结构中的茎环越小,茎越长,则其结合力越好[10]。因此,根据二级结构分析,选择结合力较好的适配子Apt-A22进行后续试验的亲和力计算。
BEATTY等[7]建立的测定抗原-抗体KA测定方法已被广泛应用,适合测定抗体和包被抗原之间的KA,且随后他们从理论到实践均进行了验证,严格控制ELISA时,其质量作用定律仍然适用。本研究利用非竞争ELISA进行TcdA与适配子KA测定和计算,Apt-A22的KA均值为2.25×107M-1,对应的解离常数值为44.5 nM,KA均到达107级,解离常数达到了nM级别。与OCHSNER等[11]筛选出的TcdA适配子和目前唯一被美国食品药品监督管理局批准用于临床治疗的适配子比较,KA和解离常数相当[12],由此说明本试验所筛选的适配子有一定应用前景。
综上所述,本研究成功利用SELEX技术筛选获得了特异结合TcdA的高亲和力的ssDNA适配子,有利于进一步研究各适配子与TcdA的亲和力和结合位点,为后续适配子的应用研究奠定了基础。

