个性化血细胞分析质量控制应用实践
罗建伟,唐春梅
(四川省成都市郫都区中医医院检验科 611730)
质量控制已经进入了风险管理时代,2011年美国临床和实验室标准化协会发布了文件:《基于风险管理的实验室质量控制》(EP23-A),2012年3月美国医疗保险和医疗救助服务中心根据美国临床实验室改进修正法案的规定,将此方案命名为个性化质量控制计划(IQCP)。IQCP阐述了风险管理的原则,强调了对检验前、检验中和检验后全过程的风险管理。本院临检室于2016年11月开始以该指南为指导,并参考相关资料,制订了本科室血细胞分析的IQCP,并予以实践,现报道如下。
1 资料与方法
1.1仪器与试剂 SysmexXT-1800i全自动血细胞分析仪,试剂为仪器配套原装试剂,校准品是具有量值溯源性的Sysmex产品,质量控制物品是四川省迈克生物股份有限公司产品和Sysmex产品。
1.2IQCP制订方法
1.2.1定义阶段 血细胞分析仪用具有量值溯源性的Sysmex公司的校准品,由厂家工程师进行校准,并对仪器性能(线性、精密度、正确度、准确度、可报告范围)进行验证。每天按照质量控制标准操作程序进行室内质量控制,每年均参加了2次四川省临检中心组织的室间质量评价,所有评价项目均100%通过。
1.2.2对检测系统进行质量控制 审核厂家对检测系统的质量控制要求,并按要求尽量满足。
1.2.3对检测系统进行性能评价 评估质量要求以卫生行业标准WS/T406-2012为准,如有项目标准低于厂家标准,以厂家标准为准。
1.2.4风险评估(RA) 按指南要求RA应从5个方面(即标本、检测系统、试剂、环境及检测人员)对检验全过程的风险来源进行危害程度、发生频率、可探测性进行评估,并计算其风险指数,最后根据评估结果进行风险控制方案制订[1]。无论风险指数高低,实验室都会为了降低对患者的风险而加以控制,所以在对风险进行评估时忽略了对风险等级的评估,而把重点放在对风险识别和其出现频率的评估,并将识别评估出的风险按检测分析前、分析中和分析后进行归类。通过以下途径去识别风险和统计其发生频率:通过对各种质量记录表格统计与分析、与临床医护人员沟通、各种投诉调查、检测系统报警分析、室内质量控制和室间质量评价结果分析、实验室信息管理系统(LIS系统)设置报警规则等[2-3]。
1.2.5制订风险控制方案 将识别出的风险来源进行列表归类,针对每种风险制订详细的控制方案,并写入IQCP中。
1.2.6检测系统的质量控制计划(QCP) QCP设计的基本要求应包括质量控制物数量、质量控制物类型、质量控制物频次、质量控制方法、质量控制规则和可接受的质量控制标准。每天标本检测前进行一次质量控制检测,一个正常水平质量控制物品和一个低水平质量控制物品,检测结果在控后开始标本检测,每检测50份标本后将1、2号标本进行一次复检,并将检测结果输入电脑桌面上预制的Excel表格中,可快速计算前后结果偏差,偏差应小于卫生行业标准WS/T406允许总误差(TEa)的1/3,结果符合要求即可审核这段检测中的标本结果,否则应检查原因。审核完成后如此分段重复检测标本,直至下午工作完成后,再进行一次质量控制检测,并根据质量控制规则进行评价。本科室质量控制规则是MR2,N2(12S,13S,22S,R41S,41S/R=2,N=2),即两种水平质量控制物每日运行2次质量控制,没有依据8个常规质量控制项目的Sigma度量大小进行质量控制规则选择,是因为部分项目的Sigma度量较小,且本科室还在实施IQCP初级阶段,这样可检出更多的误差来源[4-5]。
1.2.7质量评估(QA) 建立制度化的监控程序,定期(每季度1次)对IQCP制订风险控制措施的有效性进行评估,并根据QA结果确定是否有必要增加实验室风险评估内容和更改风险监控措施。QA的主要内容有审核实验室环境温度监控中的问题记录及纠正措施、室内质量控制失控记录及纠正措施、人员培训和考核情况、危急值报告情况、不合格标本记录及纠正措施、仪器维护保养记录、仪器校准记录、性能验证记录等[6]。
2 结 果
2.1血细胞分析检验前风险评估及控制方案 见表1。发生频率来源于2016年相关记录统计结果。
2.2血细胞分析检验中风险评估及控制方案 见表2。检验过程中的风险主要由检测系统和一些人为因素产生,故其风险识别评估主要通过对检测系统进行内部质量控制(即统计质量控制)和外部质量控制(即室间质量评价)进行识别。发生频率来源于2016年相关记录统计结果。

表1 血细胞分析检验前风险评估及控制方案(部分)

表2 血细胞分析检验中风险评估及控制方案(部分)

表3 血细胞分析检验后风险识别和评估(部分)
2.3血细胞分析检验后风险识别和评估 见表3。发生频率来源于2016年相关记录统计结果。

表4 2017年上下半年血细胞分析8个常规质量控制项目Sigma度量评估
注:WBC为白细胞,RBC为红细胞,Hb为血红蛋白,MCH为平均红细胞血红蛋白量
2.4QCP运行结果
2.4.1血细胞分析8个常规质量控制项目Sigma度量统计分析 血细胞分析8个常规质量控制项目Sigma度量:Sigma度量=(TEa%-|Bias%|)/CV%,其中TEa%为我国卫生行业标准WS/T406-2012《临床血液学检验常规项目分析质量要求》中TEa标准,CV%来源于本科室2017年室内质量控制数据,分上、下半年并取平均值,Bias%(绝对值)来源于本科室参加2017年度2次四川省临检中心正确度验证,每个项目有5个正确度验证水平,计算时取平均值,见表4。上半年红细胞比容(HCT)、平均红细胞体积(MCV)、平均红细胞血红蛋白浓度(MCHC) 3项Sigma度量小于2.0,结果不能接受,血小板(PLT)Sigma度量小于3.0,也低于最低质量要求,经多方分析是由于质量控制液中红细胞形态不稳定,随着时间推移其体积会逐渐缩小,PLT受红细胞干扰所致。下半年将质量控制品更换为Sysmex公司产品,并再次对仪器进行了校准和性能验证,结果检测质量得到明显改善。
2.4.2血细胞分析8个常规质量控制项目质量目标指数(QGI)及持续改进方向 见表5。QGI=Bias%/(1.5×CV%),其中偏倚取绝对值,对Sigma度量小于6.0的分析项目计算QGI,为质量改进提供方向。当QGI<0.8,提示CV%超出允许范围,要优先改进精密度;当QGI>1.2,提示Bias%值较大,要优先改进正确度;当QGI在0.8~1.2时,提示正确度和精密度均需改进。
2.4.32017年血细胞分析全过程风险检出统计和持续改进措施 见表6。通过LIS系统、相关记录表格统计、与临床医生沟通、满意度调查等途径,本研究对2017年血细胞分析各风险指标进行统计分析,每季度统计1次,并根据分析结果调整控制方案,并持续改进。
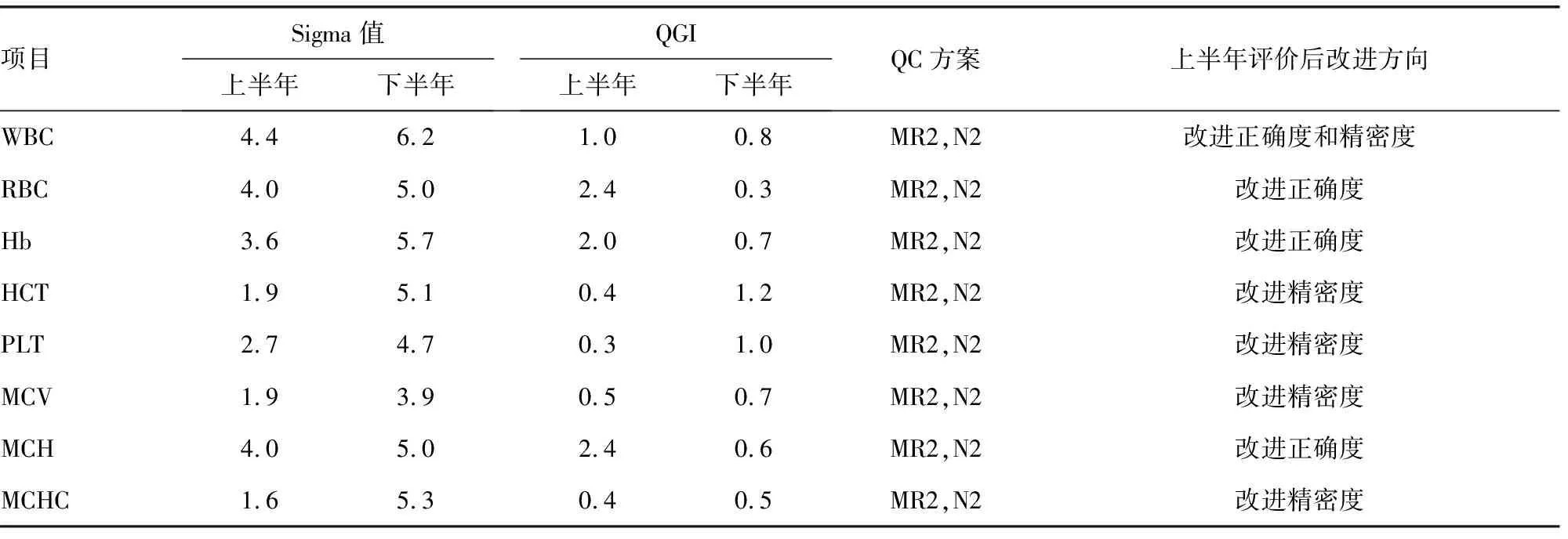
表5 血细胞分析8个常规质量控制项目质量控制方案及改进方向
注:WBC为白细胞,RBC为红细胞,Hb为血红蛋白,MCH为平均红细胞血红蛋白量
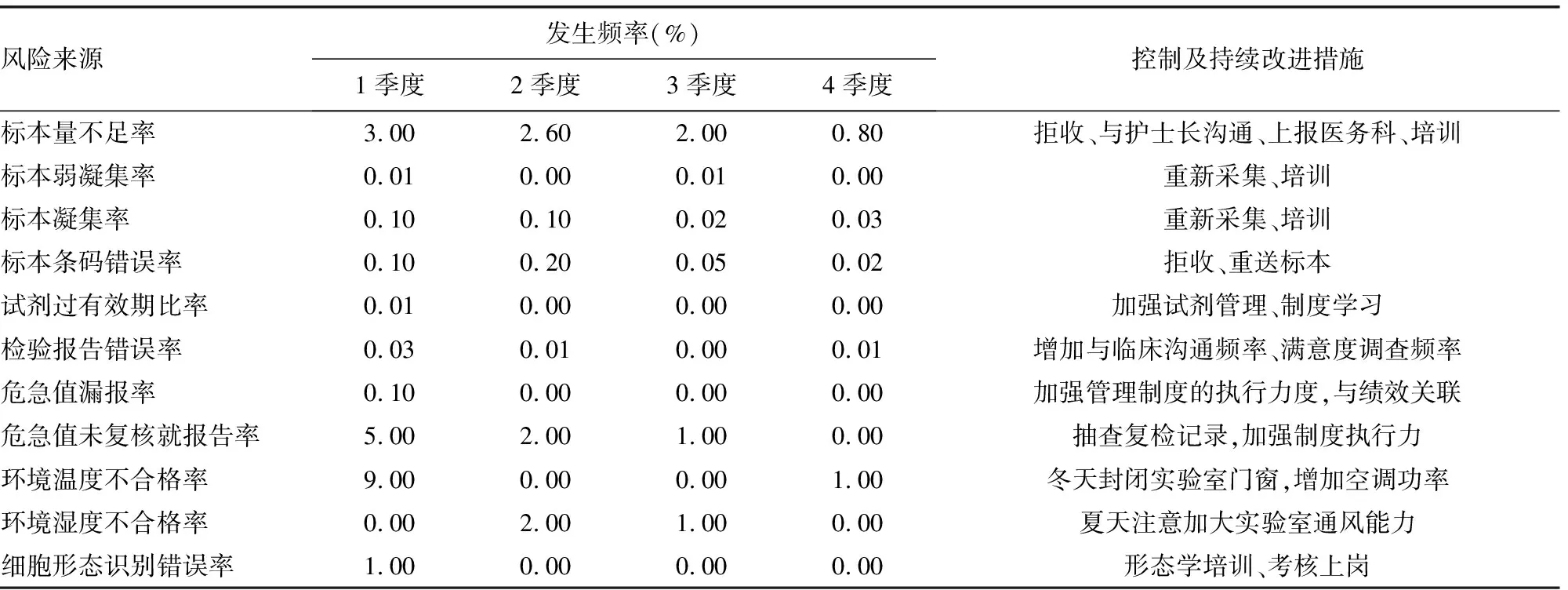
表6 2017年血细胞分析全过程风险(部分)检出率统计及持续改进措施
3 讨 论
IQCP要求实验室有监控整个检测过程(包括分析前、分析中和分析后)的质量程序,尽可能地检测出可能导致不正确检验结果发生的风险来源,从而降低对患者医疗护理产生错误影响的风险。IQCP需要依据每个实验室独特的检测环境和患者人群制订监控检测过程的QCP,该计划要根据实验室的检验质量能力规定质量控制事件频率、检测数量、检测标本量,并满足预期质量要求,还应制订监控检验前和检验后可能导致检验结果不正确风险的措施,以保障检验全过程的质量安全[2]。建立IQCP应从3个方面进行,即RA、QCP、QA。RA是指对检验全过程中能导致产生不正确检验结果风险的来源进行评估,所谓评估是对这些来源发生频率、危害程度、是否能被识别或检出作出评价。这些风险来源存在于本研究检测的标本、使用的检测系统、试剂、检测环境和执行操作的技术人员中,并在不同检验环节出现。任务是根据评估结果制订出识别风险控制风险的方法或措施[3]。QCP是IQCP的第2步,它的作用是监控并检出检测过程中的误差(风险)来源,QCP应根据自身实验室的质量能力制订有详细的质量控制物品数目、质量控制检测频次、质量控制方法、质量控制执行规则的计划。QA是IQCP的第3步,它是对IQCP中的质量活动是否有效进行评价,并根据评价结果对IQCP进行持续改进。
在制订IQCP的这3个步骤中,第1步QA在理论上是最繁琐和复杂的,但对血细胞分析来说其核心内容是风险的识别和检出,本研究弱化了对风险危害程度的评估,因为无论出现的风险是大还是小,只要一经检出都要“一视同仁”地对其进行控制。由于在IQCP初期血细胞分析各项目的Sigma度量大小不一,为了检出更多的误差来源,统一使用了MR2,N=2的多规则程序。质量评估的重点核心是控制措施持续改进,针对血细胞分析其重点是分析前的标本质量、仪器性能、实验室环境监测与控制。
通过对IQCP的认真实施,本科室血细胞分析质量得到了较大提升,下半年质量分析显示,除MCV项目Sigma度量小于4.0外,其余项目Sigma度量均大于5.0,究其原因是因为通过风险识别和质量评估进行了质量改进。从上半年各检验项目质量评估结果可知,本科室的血细胞分析系统正确度和精密度均不是很理想,需要进行质量改进,但从对仪器的性能验证结果看,正确度和精密度是符合要求和可接受的,最终分析发现是因为本研究所用的全血质量控制物品稳定性不理想,造成CV较大,Sigma度量就小了。又因为本实验室是开放式的,冬季室内温度常常低于10 ℃,试剂温度不能在仪器内快速升到要求温度,常造成Hb结果偏低而失控,后经封闭门窗,加开空调使实验室温度达到仪器所需环境温度,失控现象被纠正。
通过对检验前后出现风险的统计分析发现,出现频率较高的风险来源是标本量不足、标本抗凝不充分有凝块、危急值结果未进行复检就报告,分析原因有护士采血技术不熟练、标本要求不明确,检验人员对危急值的可靠性、准确性和重要性认识不够。经过和护理部沟通、举办《标本采集技术指南》培训,加强管理力度,标本合格率有了大幅度提高;加强对检验人员危急值报告制度的执行力度,危急值漏报率、复检率均达到良好改善。
IQCP的宗旨是降低出现不正确检验结果的风险,其核心内容是对检验全过程可能导致不正确检验结果的风险来源进行识别、评估、控制。对于血细胞分析来说,当有一个准确度良好的检测系统时,风险来源更多出现在检验前和检验后,因此针对检测前后的风险控制措施显得更加重要。本实验室检验前的风险主要来源于标本不合格、检测环境温度和湿度不稳定、校准品溯源性、质量控制物品选择等;检验后的风险来源于危急值漏报、未复查、异常结果复检。检出的风险必须进行及时纠正,为防止其再次发生必须建立有效的控制方案并加强执行力度。对潜在风险的识别最有效的方法是加强与临床医生的沟通,对各类投诉的原因进行分析[7]。制订合理的室内质量控制规则是非常必要的,本科室在2017年所有项目均采用12S,13S,22S,R41S,41S/R=2,N=2质量控制规则,是为了在实践初期能有更高的误差检出率,又因为质量控制物品成本费的原因,不能做到在较短的分析后再进行一次质量控制物品检测,并根据质量控制结果再去对样品结果进行审核报告,为了实现满足EP23-A要求,采用了前面QCP中描述的方法来保证每个检测结果在报告发出前都有一个“质量控制事件”[8-9]。
总之,IQCP控制应根据自身实验室的特点进行设计,要考虑检验全过程的动态变化,定期审核实验室的IQCP,以识别新的误差来源,不断完善控制方案,重视表单记录的查核,定期对仪器进行校准、维护、性能验证,加强与临床医生、标本运送人员、护理站之间的联系,尽量缩短标本运输时间,缩短报告周转时间,以免发生新的风险来源,进行质量控制持续改进,提高检验结果的准确性,降低患者医疗风险。

