氧化应激诱导代谢综合征大鼠勃起功能障碍的机制研究*
李 瑞 刘 康 李 浩 张 岩 陈 智 袁彗星 李明超 王 涛 蓝儒竹 刘继红 饶 可
华中科技大学同济医学院附属同济医院泌尿外科(武汉 430030)
勃起功能障碍(erectile dysfunction,ED)影响着全世界5%~20%的成年男性,其致病因素较多,包括精神因素、心血管疾病、盆腔手术以及代谢综合征(metabolic syndrome,MetS)等[1]。随着饮食习惯和生活方式的改变,MetS病人越来越多,由MetS导致的ED(metabolic syndrome related erectile dysfunction,MED)也受到越来越多的关注。MetS不是一种特定的疾病,而是指体内物质代谢紊乱而造成的一系列综合征,以胰岛素抵抗为中心,常表现为腹型肥胖、高血压、高血脂、高血糖中的至少3种[2]。MetS在不同种族人群中的发病率为20%~40%,且随着年龄的增加而升高[3]。MetS是一种复杂的全身代谢性疾病,其组成要素腹型肥胖、高血压、高血脂、高血糖均是ED的危险因素,这几种危险因素累加,引起ED的风险更大[4]。研究发现,MetS病人患ED的概率是普通人的两倍,且ED的症状更严重,并对5型磷酸二酯酶抑制剂(phosphodiesterase type 5 inhibitors,PDE5i)反应不佳[5,6]。因此,研究MED的致病机制可能会为这些病人的治疗探索新的靶点,并为临床诊治提供新的策略。
活性氧(reactive oxygen species,ROS)是指氧自由基和氧化作用较强的非自由基含氧产物,是生物有氧代谢过程中的一种副产品。ROS主要是由氧产生,包括超氧阴离子、氢氧根离子、过氧化氢、一氧化氮、羟自由基等[7]。机体有多种酶参与活性氧的生成,包括烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)氧化酶、线粒体呼吸链复合酶、黄嘌呤氧化酶、细胞色素P450、一氧化氮合成酶等,其中NADPH氧化酶是体内活性氧生成的重要来源。NADPH氧化酶是一种辅酶,也叫还原型辅酶Ⅱ,由p22phox、p40phox、p47phox、p67phox、gp91phox和GTP酶Rac构成的复合体。我们在前期研究中发现,在去势大鼠阴茎海绵体组织中,活性氧水平增高,导致氧化应激水平增加,引起内皮细胞功能障碍,cGMP产生减少,导致ED发生[8]。另有研究发现在糖尿病、高脂血症、老龄和高尿酸血症性ED病理过程中,体内ROS产生增多,氧化应激水平增高,引起内皮细胞功能障碍,NO生成和释放减少,cGMP含量降低,最终导致ED[9-13]。但在MED大鼠模型中,相关研究较少。
本研究通过喂养法建立MED大鼠模型,研究MED大鼠阴茎海绵体组织中氧化应激水平的变化,探讨氧化应激导致MED的机制。
材料与方法
一、材料
(一)实验动物
3周龄健康雄性SD大鼠40 只,购于华中科技大学同济医学院实验动物中心。
(二)药物及试剂
高脂高糖饲料(D12492,北京华阜康生物科技股份有限公司),胰岛素测定试剂盒、胆固醇测定试剂盒、甘油三脂测定试剂盒、高密度脂蛋白测定试剂盒、低密度脂蛋白测定试剂盒(南京建成生物工程研究所),RIPA 裂解液(江苏碧云天生物技术研究所),蛋白酶抑制剂Cocktail(美国罗氏公司),BCA蛋白浓度测定试剂盒(江苏碧云天生物技术研究所),gp91phox抗体(武汉三鹰生物技术有限公司),eNOS抗体(美国Abcam公司),DHE试剂盒(威格拉斯生物技术(北京)有限公司),cGMP试剂盒(南京建成生物工程研究所),ECL试剂盒(江苏碧云天生物技术研究所)。
(三)主要仪器
Powerlab四通道生理记录仪(澳大利亚AD Instruments公司)。
二、方法
(一)MED模型建立
将40只3周龄雄性SD大鼠适应性喂养1周后随机分为2组,正常对照组10只,喂普通饲料;实验组30只,喂高脂高糖饲料(D12492),喂养时间为6个月。
(二)MED模型建立及海绵体测压
喂养6个月后检测大鼠的体质量、无创血压计检测大鼠血压、血糖仪检测空腹血糖、尾静脉取血检测大鼠血浆胰岛素浓度和血脂等代谢参数。筛选出MetS大鼠后进行阿扑吗啡(apomorphine,APO)试验,APO按100μg/kg皮下注射,给药后于阴暗环境中观察,以大鼠阴茎体增长、露出作为勃起功能良好的标志,即APO(+);反之则为APO(-)。APO(-)大鼠即为筛选出的MED大鼠。大鼠测体质量后腹腔注射0.4%戊巴比妥钠(40mg/kg)进行麻醉,麻醉完全后依次剪开大鼠颈部正中皮肤、筋膜、肌肉,暴露一侧颈总动脉。仔细游离与颈总动脉紧密相连的迷走神经,并用丝线结扎颈总动脉远心端,近心端使用动脉夹夹闭。将充满肝素生理盐水的PE-50管与Powerlab/4SP数据采集分析系统连接。在显微镜下用显微剪剪开颈总动脉,将PE-50管插入颈总动脉,丝线结扎固定PE-50管。移除近心端动脉夹,Powerlab/4SP数据采集分析系统收集大鼠血压信息。沿腹部正中线剪开腹部皮肤、腹壁肌肉,分离盆腔内前列腺与周围组织。找到位于前列腺后外侧的膨大的盆神经节,其中由盆神经节发出的较大的分支且向阴茎方向斜行走行的即为海绵体神经。镊子牵拉阴茎,剪开阴茎皮肤及皮下筋膜,充分暴露阴茎海绵体。将25 G静脉输液针与Powerlab/4SP 数据采集分析系统连接,使用肝素生理盐水冲洗导管。将输液针针头插入一侧阴茎海绵体内,调整阴茎海绵体内的针头,使其与海绵窦连接通畅。打开Powerlab/4SP 数据采集分析系统的电刺激选项,将刺激参数调为15 Hz、1.2 ms,采用5.0 V电压刺激海绵体神经,持续时间为1min,刺激间隔为10min。测压完毕后,注射过量空气处死大鼠。收集阴茎海绵体组织,PBS冲洗后平均分为三段,将中段海绵体制备冰冻切片,其余两段放至-80℃冰箱保存。
(三)Western blot 检测阴茎海绵体组织中gp91phox和eNOS蛋白表达
将大鼠阴茎海绵体100mg剪碎后加入RIPA 裂解液和蛋白酶抑制剂Cocktail,用超声破碎蛋白。然后4℃离心机中12 000×g离心10min,取上清,用BCA法测定蛋白浓度后取总蛋白量40μg,100℃煮沸10min。配制10%的SDS-聚丙烯酰胺凝胶,电泳分离蛋白。电泳结束后将蛋白转到PVDF 膜上,然后使用5%的BSA 封闭 PVDF膜2h,封闭后放入gp91phox(1:200), eNOS(1:1000)抗体中孵育过夜。取出后洗膜3次,每次 10min,然后加入辣根过氧化物酶标记的羊抗兔和羊抗小鼠二抗(1:5000)继续孵育1h。孵育完成后再次洗膜30 min,采用 ECL 化学发光并采集图像进行处理,用 Quantity One 软件分析图像。
(四)阴茎海绵体组织活性氧水平检测
将大鼠阴茎海绵体组织制备成8mm厚的冰冻切片,并将冰冻切片放至室温平衡。配制浓度为1µmol/L的二氢乙啶溶液,冰冻切片避光添加二氢乙啶溶液,37℃温箱中避光孵育30min,孵育结束后用PBS清洗玻片。倒置荧光显微镜下观察并采集图像,随后采用Image-Pro Plus软件进行定量分析。
(五)阴茎海绵体组织cGMP浓度检测
阴茎海绵体组织放入匀浆器,置于冰上,加400μL RIPA裂解液(含PMSF和Cooktail)于匀浆器中快速匀浆10min,磨碎组织,冰上裂解30min后,用移液器将裂解混合物转移至1.5 mL离心管中,4℃下12 000×g离心10min。提取的蛋白裂解液按照说明书检测阴茎海绵体组织cGMP浓度。
三、统计学方法
结 果
一、两组大鼠代谢参数比较
MED组大鼠接受高脂高糖饲料喂养6个月后,体质量、空腹血糖、血胆固醇、血胰岛素明显高于正常对照组(表1)。
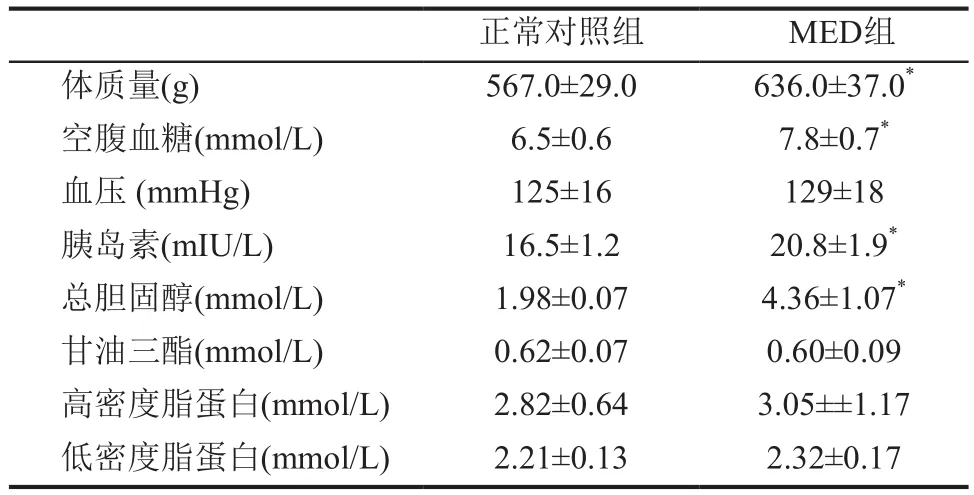
表1 两组大鼠代谢参数
二、两组大鼠Max ICP/MAP比较
用5.0V电压刺激对照组大鼠阴茎海绵体神经后,Max阴茎海绵体内压(ICP)/平均动脉压(MAP)为0.75±0.04,用5.0V电压刺激MED组大鼠阴茎海绵体神经后,Max ICP/MAP为0.46±0.05。MED组大鼠Max ICP/MAP明显低于正常对照组,P<0.05(图1)。

图1 两组大鼠勃起功能检测
三、两组大鼠阴茎海绵体组织中活性氧水平比较
MED组大鼠阴茎海绵体组织中活性氧水平明显高于正常对照组,氧化应激水平明显增加(图2A,图2B)。
四、两组大鼠阴茎海绵体组织gp91phox蛋白表达比较
五、两组大鼠阴茎海绵体组织eNOS蛋白表达和cGMP浓度比较
MED组大鼠阴茎海绵体组织中eNOS表达明显低于正常对照组,cGMP浓度也明显低于正常对照组(P<0.05)(图3)。
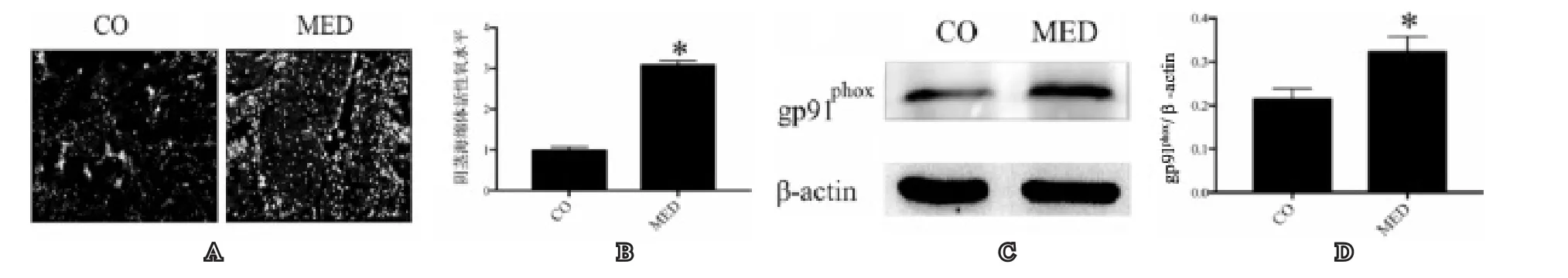
图2 两组大鼠阴茎海绵体组织中氧化应激水平

图3 两组大鼠阴茎海绵体组织中eNOS蛋白表达水平和cGMP浓度
讨 论
目前认为MetS导致ED主要包括以下几个机制[14]:(1)阴茎局部的氧化应激;(2)阴茎海绵体内皮功能障碍;(3)阴茎血管的损害;(4)性腺功能减退;(5)持续的高血糖状态使泌尿生殖系统感觉神经发生病变,影响传递到阴茎的神经递质[如神经源型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)]释放减少;(6)胰岛素抵抗引起阴茎平滑肌对舒血管物质的反应性下降和阴茎局部缩血管物质的释放增加;(7)治疗MetS的某些药物(如β-受体阻滞剂等)可能影响阴茎勃起;(8)病变晚期阴茎海绵体组织纤维化。本研究把焦点集中在MetS病理条件下,阴茎组织中氧化应激是否发生变化,发生怎样的变化?
生理水平的活性氧对于维持机体正常的生理功能具有重要意义,然而当活性氧过多积聚,超过抗氧化酶系统的清除能力,就会产生氧化应激,对机体造成氧化损伤。ROS在体内无处不在,他的产生可能是病理的或生理的,取决于各种情况。线粒体电子传递系统和NADPH氧化酶是ROS最常见的来源,而细胞色素P450和内皮型一氧化氮合酶(eNOS)以及髓过氧化物酶是一些能产生这些活性自由基的其他来源。其中NADPH氧化酶是内皮细胞中ROS的主要来源。Glennon-Alty等研究发现在自身免疫性疾病中NADPH氧化酶被激活,产生大量的超氧自由基和过氧化氢,导致ROS水平增高,从而引起一系列氧化损伤[15]。Manea等研究发现,在糖尿病病理过程中,组蛋白去乙酰化酶能上调NADPH氧化酶亚基的蛋白表达,进一步增加活性氧水平,降低NADPH氧化酶亚基的蛋白表达后,活性氧水平降低[16]。Yin等研究发现在糖尿病ED小鼠阴茎组织中,P47phox激活,使NADPH氧化酶活性增强,导致ROS过量增加[17]。我们研究发现在MED大鼠阴茎海绵体组织中NADPH氧化酶亚基gp91phox表达增高,DHE染色显示ROS产生增多。这表明ROS产生增多可能是由gp91phox表达增高,NADPH氧化酶活性增强导致。
近来有研究报道在门静脉高压大鼠的肠系膜内皮细胞中NADPH氧化酶被激活后产生过量的ROS,引起内皮细胞功能障碍,给予抗氧化剂治疗后能降低ROS水平,改善内皮细胞功能[18],另有研究发现在糖尿病模型中NADPH氧化酶被激活,引起ROS产生增多,导致氧化损伤,进一步损害内皮功能[19]。在正常情况下,机体通过氧化和抗氧化机制使体内ROS的生成和清除达到动态平衡,使ROS保持在正常水平。Huang等研究发现在吸烟诱导ED的大鼠模型中,大鼠阴茎组织中ROS水平明显增高,导致阴茎组织的凋亡明显增强,阴茎平滑肌数量明显减少,阴茎内皮的完整性也受到破坏,导致内皮功能障碍,最终导致ED的发生[20]。同样在老龄性ED,高脂血症性ED和高尿酸血症性ED中都发现有ROS产生增多,损害内皮细胞功能和NO/cGMP信号通路,最终导致ED[9,12,13]。然而,在MED病理过程中ROS对阴茎海绵体内皮功能的作用还不得而知。我们研究发现在MED大鼠阴茎海绵体中NADPH氧化酶亚基gp91phox表达增高,DHE染色显示ROS产生增多,eNOS和cGMP表达下调。因此ROS过量产生损害内皮功能可能是MED的重要机制。
综上所述,MetS可能通过激活阴茎海绵体NADPH氧化酶活性,上调阴茎海绵体平滑肌组织中活性氧的表达,引起氧化损伤,损害内皮细胞功能,最终导致ED的发生。

