介入肿瘤摘除术联合经皮椎体成形术治疗脊柱转移性肿瘤椎体压缩性骨折的疗效及安全性评价
庄怀铭,温世锋,徐耿填,黄青
(1.广东省揭阳市人民医院 脊柱外科,广东 揭阳522000;2.广东省广州市第一人民医院 脊柱外科,广东 广州 510180)
临床上恶性肿瘤晚期患者发生骨转移者高达85%,而脊柱是最常见的骨转移部位[1]。脊柱转移瘤所致的剧烈疼痛、高钙血症、恶性病理性骨折、截瘫、继发性神经功能不全等并发症显著降低患者的生活质量和生存率[2]。传统外科手术的适应证范围窄,不适合多发椎体病变,多数跨越两节以上的多发脊椎转移癌及椎体多发性骨髓瘤患者得不到有效治疗,且外科手术创伤大,手术风险高[3-4]。近年,经皮椎体成形术(percutaneous vertebra plasty, PVP)作为一种脊柱微创手术在各种脊柱肿瘤的治疗中取得了良好效果,创伤小,可显著减轻患者疼痛,提高患者生活质量[5]。尽管PVP有诸多优点,其可能出现的骨水泥外漏及抗肿瘤疗效甚微的问题仍受到临床高度关注,有研究指出介入肿瘤摘除术(interventional tumor removal, ITR)联合PVP能有效治疗恶性椎体压缩性骨折,但其相对于其他治疗方式如单独PVP、开放性手术、化疗及椎体后凸成形术等在疗效及安全性方面的研究尚无相关文献报道[6]。本研究采用ITR联合PVP治疗脊柱转移性肿瘤椎体压缩性骨折37例,取得较好疗效。现报道如下。
1 资料与方法
1.1 一般资料
选取2010年10月至2014年10月广东省揭阳市人民医院脊柱转移性肿瘤椎体压缩性骨折患者76例,依据治疗方法的不同分为两组。PVP+ITR组37例,男性21例,女性16例,年龄44~72岁,病变椎体48个。PVP组39例,男性24例,女性15例,年龄45~73岁,病变椎体52个。纳入标准:有明确的原发肿瘤病史或者由细胞学或病理诊断确诊;患者经X
射线平片、CT、MRI及骨扫描等检查确定为椎体转移性肿瘤,且伴有椎体压缩性骨折;对放化疗耐受的顽固性疼痛患者;椎体压缩性塌陷低于50%的患者。排除标准:对骨水泥(聚甲基丙烯酸甲酯,PMMA)过敏;具有神经压迫症状及预期生存期低于3个月[7];顽固性凝血功能障碍的患者。术后随访时间3~30个月。本研究经该院伦理委员会审核批准,患者及其家属均已签署知情同意书。
1.2 方法
1.2.1 治疗方法 PVP组采用PVP:患者取俯卧位,常规消毒铺巾,2%利多卡因局部麻醉后,患者在DSA引导下全程透视,于椎体单侧椎弓根处穿刺达椎体,透视下穿刺时正位达椎体中线,侧位达椎体中前交接点位置,拔除针芯,经针管打入1枚导针,沿该导针置入工作套管。沿套管将空心钻缓慢钻入椎体,穿刺成功后调配PMMA骨水泥,牙膏状时在C型臂X射线机透视下加压注入椎体,术毕拔针,局部压迫止血贴敷。术中未发生骨水泥渗漏,未加重神经损害。记录患者手术过程中所用骨水泥量、住院时间及并发症情况。术后患者平卧休息后24 h观察记录疼痛情况及有无并发症发生。PVP+ITR组采用PVP+ITR:患者术前行血常规,X射线胸片,心电图,出、凝血功能检测等常规检查。术中全程监测心率、血压、血氧饱和度及其他各项生命体征,患者取俯卧位,常规消毒、铺巾,正侧位双向透视下确定穿刺点及路径,2%利多卡因局部麻醉后将14 G穿刺针及导丝穿入椎体,使用工作套管连续扩张穿刺路径,直到最后1支套管到达椎弓根。去除倒数第2支套管后,通过最后1支套管送入环锯,缓慢切割椎弓根至最后1支工作套管到达椎弓根远端。随后从工作套管中抽出环锯和导丝,经套管送入骨髓钳,行椎体肿瘤摘除并取活检骨髓钳尽可能深入肿瘤组织内部,使肿瘤组织摘除得较为彻底,最后在正侧位透视下注入合适黏稠度的骨水泥。对于富含血供的肿瘤组织,先行射频消融,待破坏的血管凝固后再行摘除以降低手术风险(见图1)。手术过程均由本科室两名经验丰富的临床医师实施,两名独立研究人员记录患者手术所用骨水泥量、住院时间及住院期间并发症发生情况。术后患者平卧休息后24 h记录疼痛缓解及并发症发生情况。

图1 肿瘤椎体压缩性骨折患者X射线片及MRI图像
1.2.2 评价指标 患者均进行门诊及电话随访。患者术前24 h,术后24 h、1、3、6、12及24个月随访过程中均采用疼痛强度视觉模拟评分(VAS)进行疗效评价。VAS评分根据患者自觉疼痛的程度,分值范围为0~10分,分值越高疼痛越严重,0分:完全无疼痛感觉,10分:剧烈疼痛。所有随访采用相同评分方法记录患者疼痛强度[8]。总生存期的记录从患者手术日直至随访结束时或任何原因所致的死亡之间的时间。
1.2.3 并发症观察 术后3 d行脊柱CT及X射线平片检查,观察骨水泥在椎体内的分布情况及有无骨水泥渗漏(血管性渗漏,非血管性渗漏包括穿刺部位,椎体周围软组织漏,椎间盘漏,椎管内硬膜外及椎间孔漏)并发症的发生,同时观察患者住院期间有无其他症状性并发症,如感染、出血、心肺功能障碍、神经功能障碍等的发生。
1.3 统计学方法
数据分析采用SPSS 20.0统计软件,正态分布的计量资料以均数±标准差(±s)表示,非正态分布的计量资料用M(P25,P75)表示,二分类及多分类数据以例数和率表示,治疗前后比较采用配对t检验,多个时间采用重复测量设计的方差分析,进一步的组间两两比较采用LSD-t检验,生存期分析采用Kaplan-Meier法,P<0.05为差异有统计学意义。
2 结果
2.1 患者的一般情况
PVP+ITR组及PVP组共计76例(100患椎),均获得随访。其中PVP+ITR组患者平均年龄(57.65±6.74)岁,共37例患者(48患椎)。PVP组患者平均年龄(59.65±8.14)岁,共39例患者(52患椎)。所有患者均经影像学检查证实有脊柱转移癌,其余一般临床资料见表1,两组患者在年龄、性别、疼痛持续时间、病变椎体数及原发肿瘤类型比较,差异无统计学意义,具有可比性。
2.2 两组患者不同时间VAS评分比较
PVP+ITR组与PVP组患者术前及术后24 h、术后1、3、6、12、24个月VAS评分比较,采用重复测量设计的方差分析,结果:①不同时间点的VAS评分有差异(F=1254.395,P=0.000);②PVP+ITR组与PVP组患者VAS评分有差异(F=538.618,P=0.000),PVP+ITR组VAS评分较低,相对镇痛效果较好;③PVP+ITR组与PVP组患者的VAS评分变化趋势有差异(F=76.582,P=0.000)。见表 2。
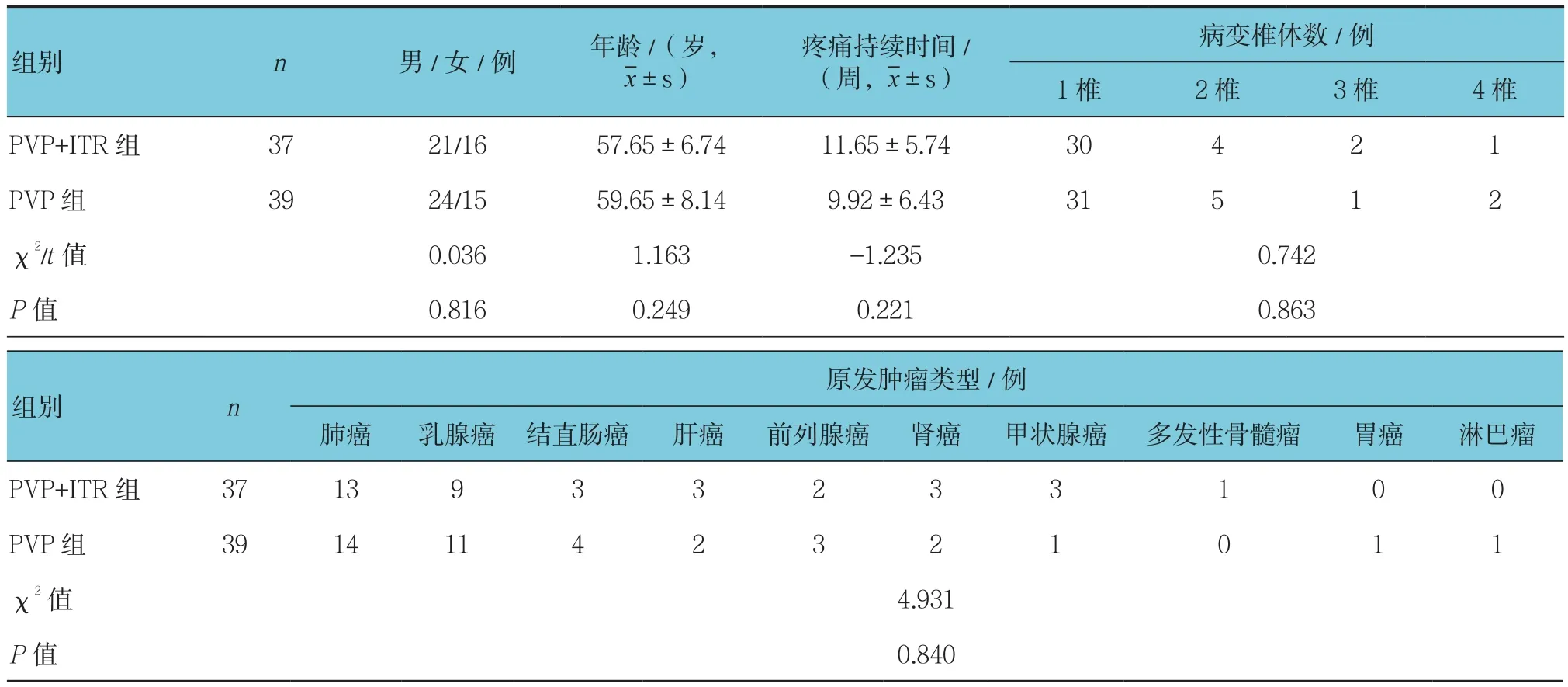
表1 两组脊柱转移瘤患者基线资料的比较
表2 两组患者不同时间点VAS评分比较 (±s)

表2 两组患者不同时间点VAS评分比较 (±s)
组别 n 术前 术后24 h 术后1个月 术后3个月 术后6个月 术后12个月 术后24个月PVP+ITR 组 37 8.93±1.24 4.14±0.69 1.03±0.36 2.66±0.75 2.62±0.82 1.91±0.96 1.76±0.83 PVP 组 39 9.04±1.02 4.01±0.82 2.76±0.64 3.15±0.79 3.21±0.79 3.70±0.95 4.11±1.25
2.3 两组患者生存期比较
Kaplan-Meier分析检测结果显示,PVP+ITR组患者生存时间的平均数及M(P25,P75)分别是(18±8)个月和 14(12,25)个月,PVP 组平均数及 M(P25,P75)分别为(17±8)个月和13(12,27)个月。两组总生存期比较差异无统计学意义(χ2=0.119,P=0.731)(见图2)。
2.4 两组患者椎体加固情况
术后3 d行CT检查显示76例(100患椎)患者中,52例(63椎)病椎的肿瘤区域被PMMA完全均匀填充加固,另24例37个椎体被大部分充填。两组术后均未见经加固后的椎体或其邻近椎体有新的骨折发生。术中及术后均无严重并发症产生,随访6~12个月患者术后病变脊椎稳定性良好。
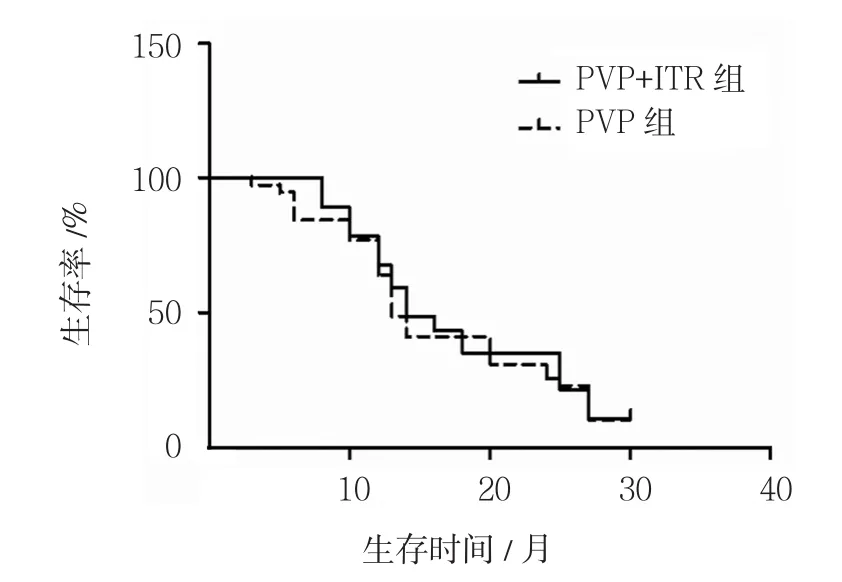
图2 两组患者生存期比较
2.5 手术安全性评价
两组术后均未出现感染、出血及心肺功能障碍并发症。平均住院时间PVP+ITR组(6.31±1.43)d与PVP组的(6.42±1.37)d比较,差异无统计学意义(t=0.342,P=0.733)。骨水泥注射量PVP组(3.12±0.90)ml,PVP+ITR 组(5.89±1.76)ml,两组比较差异有统计学意义(t=-8.704,P=0.000),PVP+ITR组患者增多。CT显示在PVP+ITR组的48个椎体中,有15个(31.25%)发生骨水泥渗漏,渗漏部位分别为静脉、椎体周围软组织、椎间盘及穿刺点,均未出现椎管渗漏。PVP组52个椎体中,有33个(63.46%)发生骨水泥渗漏,渗漏部位分别为静脉、椎体周围软组织、椎间盘、穿刺部位、椎管内硬膜外及椎间孔。PVP+ITR组椎体骨水泥渗漏低于PVP组(χ2=10.376,P=0.001)。与PVP+ITR组比较,PVP组向椎管内硬膜外及椎间孔骨水泥渗漏的例数增加,分析原因可能为ITR手术肿瘤摘除后,椎体内的空腔的骨水泥起到引导作用,减少骨水泥的椎外渗漏。
3 讨论
临床上脊柱是转移性骨肿瘤的好发部位,约5%~10%的肿瘤患者会发生脊柱转移,仅次于肺和肝脏[9]。顽固性疼痛及神经功能障碍是脊柱转移瘤最主要的临床后果,严重影响患者的生存质量,而疼痛往往先于神经功能障碍而发生[10]。对脊柱转移性肿瘤的治疗,传统的治疗手段主要有放疗、化疗和外科手术,然而放化疗无法加强因肿瘤破坏而造成的脊柱不稳;外科手术创伤大、风险高,由于患者多为癌症中晚期,手术很难切除彻底,术后易复发。近些年来,PVP术作为一种脊柱微创手术被广泛用于压缩性骨折及转移性骨肿瘤患者的镇痛中,获得较高的镇痛效果和低致残率,达到缓解疼痛,稳定椎体的作用[11-12]。本研究发现,与单独PVP类似,PVP联合ITR治疗脊柱转移瘤,能有效缓解患者疼痛,相比于单独PVP,PVP联合ITR还能显著降低骨水泥渗漏风险,但对患者的总体生存期作用不显著。
转移性脊柱肿瘤所导致的顽固性疼痛严重影响患者生活质量,报道指出PVP术能在良性骨质疏松及神经压迫方面的研究中获得约85%的疼痛改善率[13-14]。本研究结果显示,PVP联合ITR与单独PVP均能有效缓解疼痛,术后24 h两者对患者疼痛的缓解程度差异无统计学意义,其余时间相对于单独PVP术而言,PVP联合ITR术对患者疼痛的缓解作用更显著,且效果维持时间较长。
PVP联合ITR是由经皮椎间盘摘除术联合PVP整合发展而来,是一项能较为彻底的清除椎体转移瘤的微创手术[15]。由于恶性肿瘤对骨质的破坏,单纯PVP后骨水泥渗漏率高达约65%,严重制约PVP术在恶性脊柱转移瘤的临床应用[16],与单独PVP比较,PVP联合ITR因术中摘除肿瘤且无需高压下行骨水泥注射,降低椎体内压力,进而有效降低骨水泥外漏的风险。其次,由于摘除患椎内尽可能多的肿瘤组织,向椎体内注入较多的骨水泥,能够有效预防椎体塌陷,维持脊柱结构的稳定性。再者,由于脊柱转移性恶性肿瘤摘除的较为彻底,患者疼痛的缓解能够维持相对较长的时间[17]。本研究结果发现,与单独PVP比较,PVP联合ITR能有效降低患椎骨水泥渗漏风险,此外有研究报道指出,在能有效控制患椎骨水泥外漏的前提下,向患椎内注入尽可能多的骨水泥能获得较好的手术效果[18],一项针对尸体脊椎生物力学研究的报告指出,向脊椎内注入多达8 ml的骨水泥才能获得脊椎生物力学的完整[19]。本研究中也发现,PVP联合ITR术的患椎骨水泥注射量高于PVP术,而骨水泥渗漏率低于单独PVP术。分析原因可能为ITR 切除部分肿瘤为骨水泥预留了低压的空腔,在较高压力的注射时使骨水泥较容易滞留在椎体内,向椎外渗漏风险减少。因为手术者无法认为控制骨水泥的蔓延方向,使骨水泥先渗入已创造的空腔内,而不是直接通过骨质破坏的破损弥散到椎体外,这是PVP联合ITR治疗的优势。
本研究还存在一些缺陷,临床实施PVP联合ITR术的患者普遍生存期较短,可能掩盖该手术的优势和缺点。由于ITR术操作者无法直视下实施肿瘤摘除术,对硬膜外肿瘤侵袭所致临床症状的缓解较为困难。PVP联合ITR术操作较为复杂,需多学科、多个操作者共同配合协作,可能产生相对较高的费用。尽管存在诸多限制,本研究发现,相对于单独PVP而言,PVP联合ITR能有效缓解脊柱转移瘤恶性椎体压缩性骨折所致的疼痛,阻止椎体塌陷并能够维持脊椎结构的稳定,降低骨水泥渗漏风险,对临床上大部分需要姑息性治疗的椎体转移瘤所致的疼痛以及轻中度不稳定,可快速改善疼痛和恢复椎体稳定,值得进一步扩大临床研究与推广。

