宫颈鳞癌组织中c-fos蛋白表达与HPV感染的相关性*
张玉芳,任春丽,梁爽,张金环,郭艳巍,侯敬
(承德医学院附属医院 妇产科,河北 承德 067020)
目前研究者认为宫颈癌的发生与持续的人乳头状瘤病毒(human papillomavirus, HPV)感染密切相关。特别是高危型HPV(HPV16、18、31、45等)的持续性感染,是宫颈癌发病的主要原因[1-2]。原癌基因c-fos是即刻早期基因家族中的一员,其在肿瘤的侵袭、细胞外基质的降解、异常黏附及转移灶新生血管形成等多个环节中发挥重要作用[3]。本研究通过检测宫颈鳞癌和宫颈病变组织中c-fos蛋白表达和HPV的感染情况,探讨c-fos是否与HPV感染协同参与宫颈鳞癌发生发展过程。
1 资料与方法
1.1 研究对象
选取承德医学院附属医院妇科门诊及病房2012~2016年经病理确诊为宫颈鳞癌和癌前病变的标本共148例。患者年龄25~64岁,平均48.2岁,其中,<45岁患者68例,≥45岁患者80例。依据病理学诊断结果为慢性宫颈炎症组(31例)、低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion, LSIL)组(35例)、高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion, HSIL)组(33例)及宫颈鳞状细胞癌组(49例)。宫颈鳞癌组中,<45岁患者18例,≥45岁患者31例。按肿瘤分化程度:高分化16例,中低分化33例。有淋巴结转移19例,无淋巴结转移30例。
1.2 方法
1.2.1 宫颈鳞癌组织HPV-DNA含量的检测 采用PCR-反向点杂交技术检测宫颈鳞癌组织HPV DNA含量,应用HPV-DNA检测试剂盒(深圳亚能生物技术有限公司)进行检测,严格按照试剂盒操作说明书进行HPV-DNA提取、PCR扩增、杂交、洗膜及显色。
1.2.2 结果判读 阳性质控品杂交膜条在相应的HPV基因型位点及IC位点出现显色信号(蓝色斑点),其他位点不显色;阴性质控品杂交膜条除IC位点出现显色信号外,其他位点不显色。按照膜条上探针排列顺序,依据显色信号的有无判读结果,依据显色信号的位置判定HPV基因型。
1.2.3 宫颈鳞癌及宫颈病变组织中c-fos蛋白表达的检测 采用免疫组织化学PV二步法检测宫颈鳞癌及宫颈病变组织中c-fos蛋白表达,一抗为c-fos兔抗多克隆抗体,稀释浓度为1︰100,以PBS代替一抗做为阴性对照,已知阳性结果做阳性对照。c-fos抗体和免疫组织化学试剂盒均购自北京中杉金桥生物技术公司。采用阳性细胞的百分率评分和染色强度评分进行结果判定,每个标本选取6张切片,每张切片均随机取3个视野测量,取平均值。①阳性细胞百分率评分标准:无表达或阳性细胞数计分,<5%=0分,6%~25%=1分,26%~50%=2分,≥51%=3分;②染色强度评分标准:基本不染色=0分,染色较浅=1分,染色适中=2分,染色较深=3分。将阳性细胞百分率评分和染色强度评分得分之和作为最后得分:≤1分为阴性(-);2分为弱阳性(+),3~4分为阳性(++),5~6分为强阳性(+++)。按抗体说明书标示,c-fos蛋白主要表达于胞核,偶尔散在表达于胞质,单纯胞质表达不视为阳性。
1.3 统计学方法
数据分析采用SPSS 24.0统计软件,计数资料以率(%)表示,比较采用χ2检验,等级资料采用秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 HPV感染与宫颈鳞癌临床特征阳性的关系
HPV在49例宫颈鳞癌组织中的表达率为89.8%,PCR-反向点杂交方法检测结果显示:膜条上分别于16、35、58位点出现显色信号,即宫颈鳞癌患者HPV感染主要为HPV16型,少数为HPV35型和HPV58型。不同年龄、肿瘤分级及临床分期患者宫颈鳞癌组织中HPV感染比较,差异无统计学意义(P>0.05)。宫颈鳞癌淋巴结转移组HPV感染与无淋巴结转移组比较,差异也无统计学意义(P>0.05)。见图1和表1。
2.2 宫颈鳞癌及宫颈病变组织中c-fos蛋白表达情况
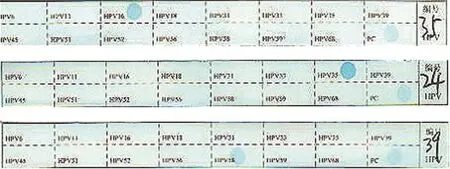
图1 宫颈鳞癌组织中HPV分型检测结果

表1 宫颈鳞癌组织中HPV感染与临床病理特征的关系
c-fos蛋白在慢性宫颈炎、LSIL、HSIL及宫颈鳞状细胞癌组织中均有表达。c-fos蛋白表达随宫颈病变的程度逐渐增加,经Spearman等级相关性分析,差异有统计学意义(P<0.05)。见图2和表2。
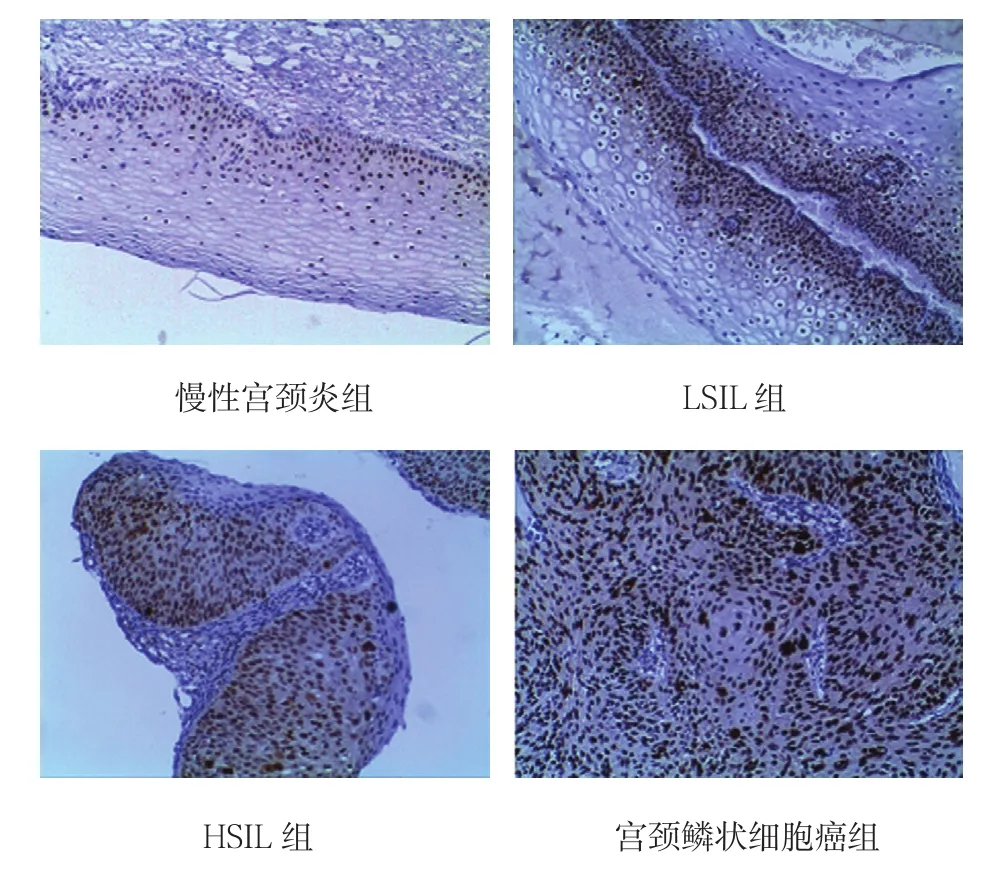
图2 各组宫颈病变组织中c-fos蛋白表达情况
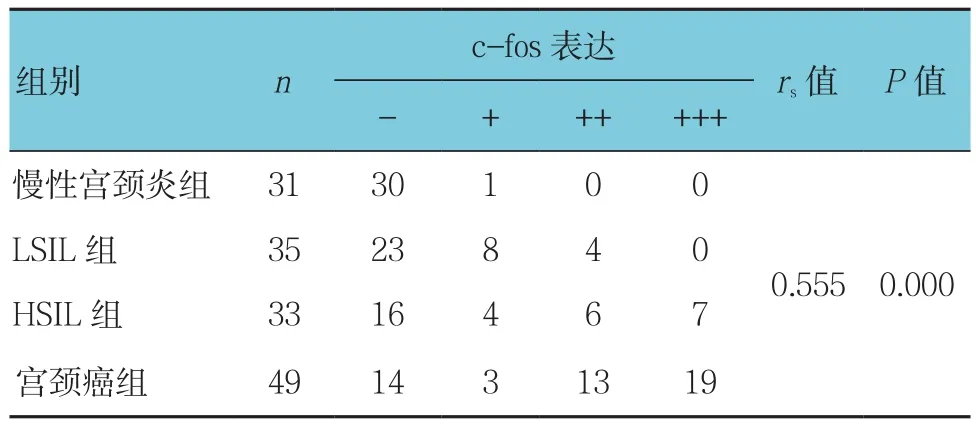
表2 各组宫颈病变组织中c-fos蛋白表达情况
2.3 c-fos蛋白表达与宫颈鳞癌临床病理特征的关系
Ⅰ、Ⅱ期宫颈癌组织中c-fos蛋白表达阳性率与Ⅲ、Ⅳ期癌组织比较,差异有统计学意义(P<0.05),Ⅰ、Ⅱ期低于Ⅲ、Ⅳ期;c-fos蛋白在高、中、低分化肿瘤组织中出现异常表达,差异有统计学意义(P<0.05);有淋巴结转移组c-fos蛋白表达与无淋巴结转移组比较,差异有统计学意义(P<0.05)有淋巴结转移组高于无淋巴结转移组;c-fos蛋白表达与患者年龄无相关(P>0.05)。见表 3。
2.4 HPV感染与c-fos蛋白表达的相关性
在宫颈鳞癌组织中(49例),HPV阳性患者(44例)c-fos蛋白阳性表达34例,阳性表达率为77.3%(34/44),HPV阴性患者(5例)c-fos蛋白阳性表达1例,阳性表达率为20.0%(1/5),两者比较,差异有统计学意义(χ2=4.680,P=0.003)。
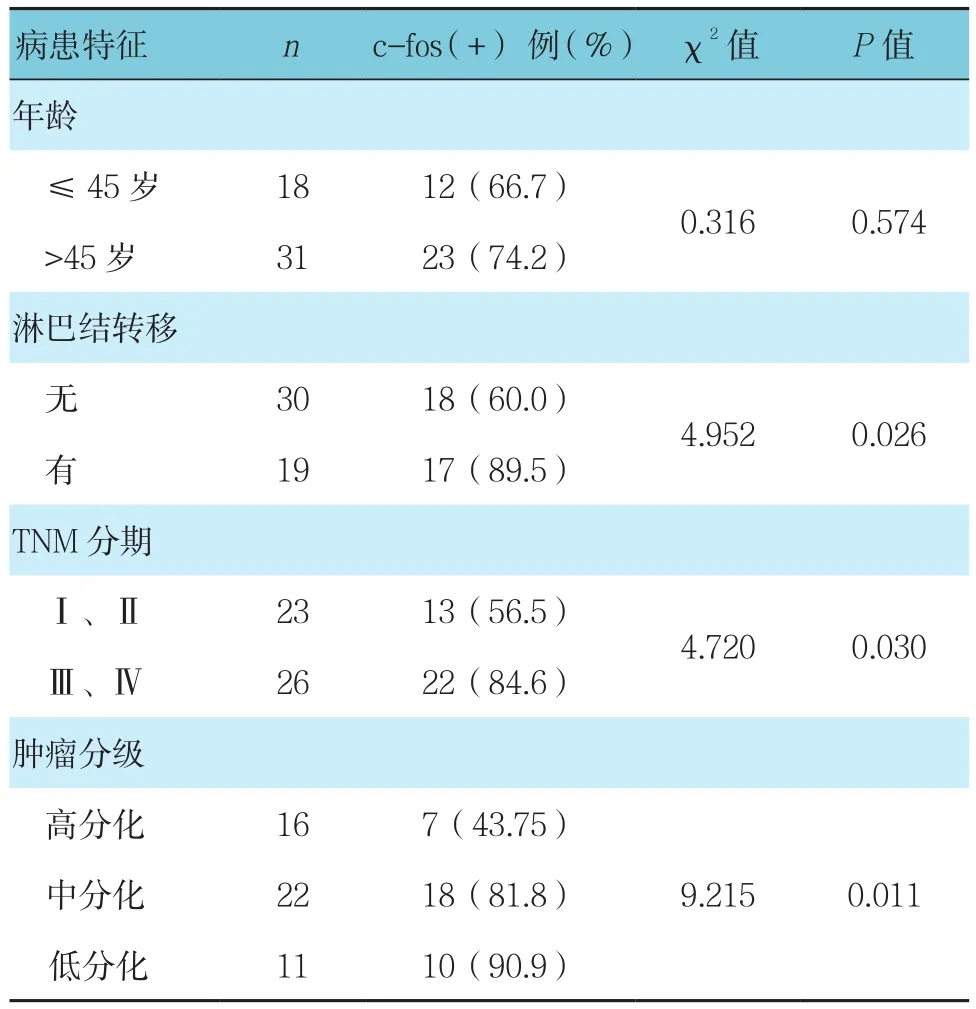
表3 宫颈鳞癌组织中c-fos蛋白表达与临床病理特征的关系
3 讨论
宫颈癌是一种可以通过早期筛查、早期干预有效降低发病率及病死率的一种疾病[4]。而在我国对于宫颈病变的筛查重视程度不足,加上受到地区、技术条件、费用等方面的限制,造成宫颈病变的筛查并不规范,这使得宫颈病变发生进展,进而向癌变的方向转化,因此导致我国宫颈癌的病死率仍居高不下,并且逐渐呈现年轻化的趋势,严重影响了女性的健康。
c-fos是fos家族中研究最多的基因之一,其可作为调控细胞增殖、分化、凋亡的重要基因。当细胞受到外界刺激使核内c-fos激活时,其转录的mRNA由胞核进入胞浆,转录出蛋白质后返回胞核与c-jun蛋白形成转录激活蛋白1(activator protein-1, AP-1),AP-1通过丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路在与基因启动子和增强子相互作用的诱导下,导致下游靶基因的过表达,促进细胞增殖及恶性转化,促使肿瘤的形成进展[5]。目前研究表明,c-fos过表达或异常表达与卵巢癌、食管癌、胃癌、甲状腺癌、大肠癌等多种肿瘤的发生、发展相关[6-7]。本研究通过免疫组织化学法检测c-fos蛋白在宫颈鳞癌及宫颈病变黏膜组织中的表达,发现c-fos蛋白阳性表达率随着宫颈病变程度的加重而逐渐增加。说明c-fos基因的过度激活在宫颈鳞癌的发生发展过程中发挥了重要的作用。在宫颈鳞癌组织中,c-fos蛋白表达与癌组织的分级、临床分期及有无淋巴结转移密切相关,c-fos参与了宫颈鳞癌的分化、转移过程。c-fos表达越明显,宫颈鳞癌的恶化、转移的潜在可能性也越强。因此,c-fos可能为预测宫颈鳞癌恶化、转移提供新的靶点。
HPV持续感染在宫颈上皮内瘤变过程中发挥着重要的作用,而其中HPV16和HPV18是导致宫颈癌发生的两个重要亚型。宫颈病变细胞内染色体常通过HPV基因的整合启动E1、E2基因的表达,而E6、E7癌基因与抑癌基因的结合并使其失活可促进宫颈上皮病变的发生[8-10]。有研究发现[11],体内细胞在受到HPV感染后,体内c-fos与c-jun表达升高,激活AP-1信号通路,并通过调控下游靶基因,促进肿瘤细胞的增殖、血管的形成、肿瘤的转移等。本研究通过PCR-反向点杂交技术检测宫颈鳞癌组织中HPV-DNA含量,发现HPV在宫颈癌组织中的表达率高达89.8%,主要为HPV16型,少数为HPV35型和HPV58型,与以往研究结果一致。推测HPV感染可能是导致宫颈癌变的重要因素之一。在宫颈癌组织中,HPV阳性患者c-fos蛋白表达率均高于HPV阴性患者,提示c-fos的表达增强进而激活AP-1信号通路可能是HPV感染后引发宫颈癌重要因素,但确切机制尚有待于进一步研究。因此,联合检测HPV与c-fos蛋白表达有望成为宫颈病变的早期筛查、预后评判及治疗的新手段。

