MicroRNA-200c对Ox-LDL介导的人主动脉内皮细胞损伤的影响
朱伟军,雷军荣,白晓君,王蕊,叶玉兰,鲍建军
(1.陕西省西安高新医院 心内科,陕西 西安 710075;2.陕西省西安高新医院 心胸外科,陕西 西安 710075;3.西安交通大学医学院第一附属医院 心血管内科,陕西 西安 710061)
动脉粥样硬化是造成死亡和残疾的主要原因,也是缺血性卒中和高血压的主要诱因之一。而内皮细胞的增殖是斑块形成的重要机制,此外,内皮细胞凋亡也是动脉粥样硬化发展过程中至关重要的因素。因此,探讨影响血管平滑肌细胞增殖和凋亡相关的分子对于预防或治疗血管增生性疾病具有重要的意义。MicroRNA(miRNA)是一类干扰转录和转录后过程的非编码小RNA家族[1]。miRNA在心血管疾病包括心肌缺氧复氧损伤、心肌肥厚、心律失常以及心力衰竭等过程中具有重要的作用[2]。miR-200c是miR-200基因家族的成员之一,和miR-141都聚集在12号染色体。前期的研究发现[3],过氧化氢H2O2刺激可上调miR-200c在人脐静脉内皮细胞的表达水平,且上调的miR-200c可调节内皮细胞的增殖、凋亡。本研究通过制备氧化低密度脂蛋白(Ox-LDL)损伤的人主动脉内皮细胞(HAEC)模型,研究miR-200c对Ox-LDL诱导的HAEC损伤的作用及相关机制,为动脉粥样硬化的治疗提供一定的理论基础。
1 材料与方法
1.1 主要试剂及仪器
HAEC和内皮细胞培养基购自美国ATCC公司,转染试剂盒LipofectamineTM2000购自美国Invitrogen公司,RNA提取试剂盒miRNeasy Mini Kit购自德国Qiagen公司,Taq Man miRNA逆转录试剂盒购自美国ABI公司,Annexin V-FITC/PI细胞凋亡检测试剂盒购自中国碧云天公司,兔抗EphA2多克隆抗体、HRP标记的牛抗兔二抗购自美国Santa Cruz公司。Applied Biosystems 7500实时聚合酶链反应系统(美国应用生物系统公司),流式细胞仪(美国Beckman Coulter公司)。
1.2 细胞培养及处理
将HAECs接种于含内皮细胞生长因子、5%胎牛血清和1%青霉素/链霉素的内皮细胞培养基中。置于37℃含5% CO2和95%空气的培养箱中进行培养。待细胞长至80%汇合时,将培养基换成含不同浓度(0、30、60 µg/ml)Ox-LDL的培养基进行培养,选择30 µg/ml浓度的 Ox-LDL分别培养 0、12、24、48 h。
1.3 转染
将胰酶消化的HAECs以2×105个/孔的浓度接种于6孔培养箱中,根据LipofectamineTM2000试剂盒说明书将miR-200c inhibitor(In-miR-200c)及其阴性对照(NC组)或Slit2及对应阴性对照(Sham组)转染至细胞,培养24 h后,收集细胞检测miR-200c和Slit2表达水平或进一步进行Ox-LDL处理,未进行任何处理的细胞为对照组(CON组)。
1.4 实时荧光定量聚合酶链反应(qRT-PCR)
收集细胞,采用miRNeasy Mini Kit试剂盒提取总RNA,Taq Man miRNA逆转录合成cDNA,随后使用Applied Biosystems 7500实时PCR系统进行实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)。PCR反 应 条 件 为 :95℃10 min,40个周期的95℃ 15 s和60℃ 60 s,以U6为内参。
1.5 MTT法
将miR-200c和Ox-LDL处理的细胞接种于96孔板,培养0、12、24、48、72 h分别向每孔中加入20 ml的MTT,继续孵育4 h后,加入150 ml DMSO振荡使结晶物充分溶解。在酶标仪上测定490 nm处吸光度值。
1.6 细胞凋亡检测
采用Annexin V-FITC/PI双染法检测细胞凋亡情况。收集细胞并以1×106个/ml浓度进行重悬浮。取500 µl细胞悬液加入5 µl Annexin V-FITC和10 µl PI溶液,然后在室温下避光孵育15 min。用流式细胞仪进行测定。
1.7 Western blot检测
将细胞置于含有蛋白酶和磷酸酶抑制剂的RIPA裂解缓冲液中进行裂解。离心后,收集上清液并对获得的蛋白进行定量。取适量蛋白质进行SDS-PAGE电泳并分离,然后转移到硝酸纤维素膜上。经5%脱脂乳封闭1 h后,将膜分别与Slit2一抗和HRP标记的二抗孵育。用奥德赛成像系统对条带进行扫描。
1.8 荧光素酶检测
将含有Slit2野生型(WT)或突变(MUT)3'-UTR的基因序列构建到psi-check2荧光素酶报告基因质粒载体(美国Promega公司)。然后,将HAEC接种于24孔板,并加入0.5 mg miR-200c inhibitor或阴性对照质粒用脂质体2000试剂进行共转染。转染48 h后,收集细胞,使用双荧光素酶报告基因检测试剂盒的荧光素酶活性。
1.9 统计学方法
数据分析采用SPSS 11.5统计软件,计量资料以均数±标准差(±s)表示,数据分析采用单因素方差分析和重复测量设计的方差分析,比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-200c在经Ox-LDL干预的HAEC中的表达
qRT-PCR结果显示,30和60 µg/ml Ox-LDL处理组miR-200c表达为(2.25±0.23)和(3.35±0.15),与0 µg/ml Ox-LDL处理组(1.00±0.10)比较,差异有统计学意义(F=145.700,P=0.000);30 µg/ml Ox-LDL 12、24和48 h处理组miR-200c表达为(1.85±0.19)、(2.71±0.25)和(4.62±0.38),与0 h处理组(1.00±0.12)比较,差异有统计学意义(F=110.6,P=0.000)。见图1。
2.2 沉默miR-200c上调细胞生存活性

图1 miR-200c在经Ox-LDL干预的HAEC中的表达
经miR-200c inhibitor转染后miR-200c表达沉默,CON组miR-200c的相对表达为(1.00±0.15),NC组为(1.05±0.10),In-miR-200c组为(0.23±0.04)(见图2A)。CON组、Ox-LDL组及Ox-LDL+In-miR-200c转染组。12、24、48、72 h吸光度值比较,结果:①不同时间点的吸光度值有差异(F=234.37,P=0.000);②3组吸光度值有差异(F=13.259,P=0.006),Ox-LDL组吸光度值较低;③3组吸光度值变化趋势有差异(F=88.172,P=0.000)。见图2B和附表。
2.3 过表达miR-200c抑制细胞凋亡
细胞凋亡结果显示,Ox-LDL组细胞凋亡水平高于CON组(t=-37.836,P=0.000)。而与Ox-LDL组比较,Ox-LDL+In-miR-200c组细胞凋亡水平下降(t=16.362,P=0.000)(见图3A)。此外,对Caspase-3的检测也发现,与CON组比较,Ox-LDL组Caspase-3活性升高(t=-9.275,P=0.001),且高于 Ox-LDL+In-miR-200c组(t=5.517,P=0.005)(见图 3B)。
2.4 miR-200c靶向抑制Slit2表达
通过检索microRNA预测程序microRNA.org(http://www.microrna.org/microrna/home.do),Target Scan(http://www.targetscan.org/vert_60/) 和 PicTar(http ://www.pictar.org/cgi-bin/Pic Tar_vertebrate.cgi)发现Slit2 的3'-UTR含有miR-200c的结合位点(见图4A)。Western blot检测结果显示,Ox-LDL+In-miR-200c组Slit2

图2 下调miR-200c对Ox-LDL损伤HAEC活性的影响
附表 各组吸光度值比较(±s)
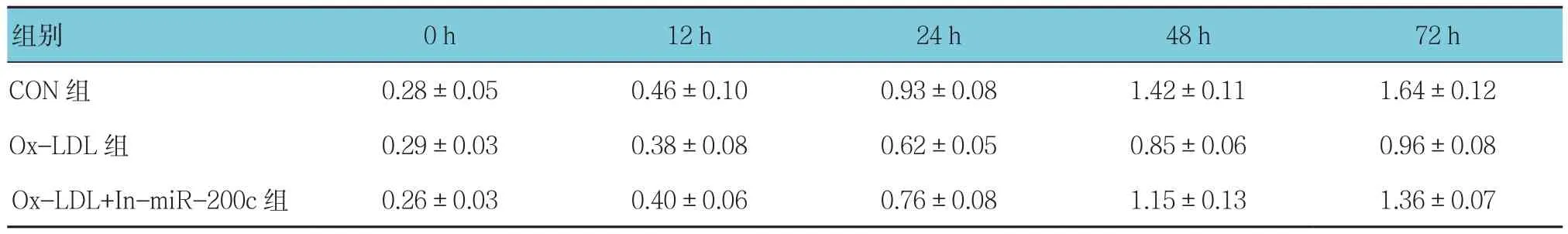
附表 各组吸光度值比较(±s)
组别 0 h 12 h 24 h 48 h 72 h CON 组 0.28±0.05 0.46±0.10 0.93±0.08 1.42±0.11 1.64±0.12 Ox-LDL 组 0.29±0.03 0.38±0.08 0.62±0.05 0.85±0.06 0.96±0.08 Ox-LDL+In-miR-200c 组 0.26±0.03 0.40±0.06 0.76±0.08 1.15±0.13 1.36±0.07
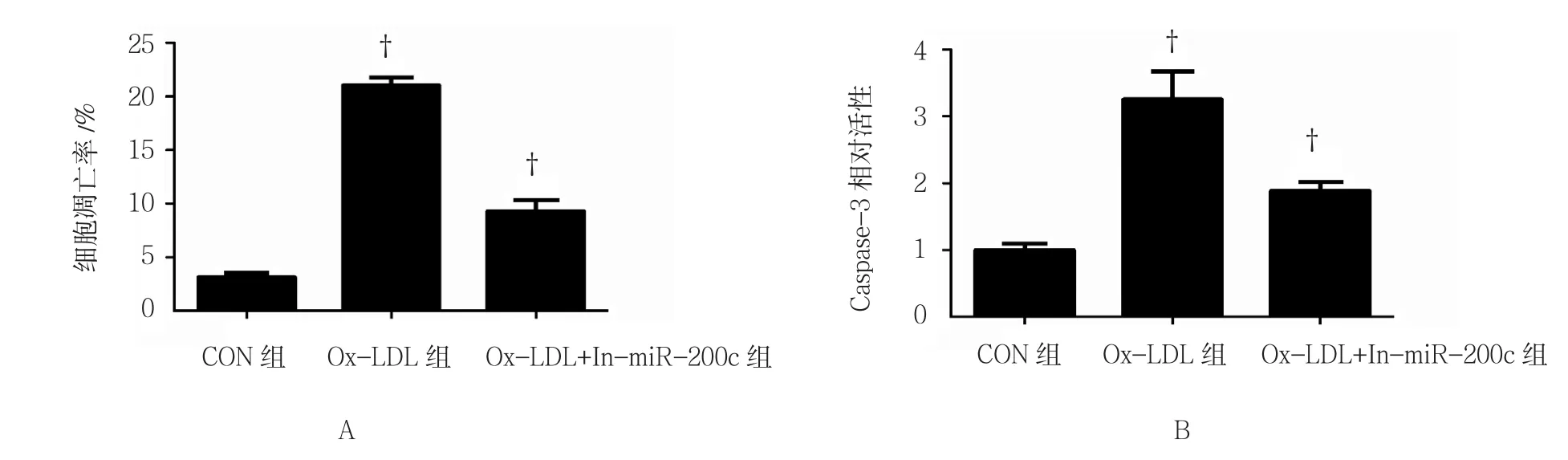
图3 miR-200c对Ox-LDL诱导的HAEC凋亡的影响

图4 荧光素酶基因报告
表达水平与Ox-LDL组比较,差异有统计学意义(t=-21.592,P=0.000),Ox-LDL+In-miR-200c组升高(见图4B)。进一步通过荧光素酶基因报告实验发现,Ox-LDL+In-miR-200c转染使携带野生型报告基因的Slit2 3'-UTR(WT)组荧光素酶活性高于Ox-LDL组(t=-11.253,P=0.000)(见图 4C)。
2.5 干扰Slit2对细胞凋亡的影响
利用干扰小RNA(siRNA)干扰Slit2的表达,对转染效率的检测发现Slit2 siRNA可抑制Slit2表达水平(见图5A)。与In-miR-200c组比较,Slit2 siRNA组吸光度值升高(t=8.601,P=0.001,见图5B)。此外,Slit2 siRNA组细胞凋亡水平高于In-miR-200c组,且差异有统计学意义(t=-4.527,P=0.011,见图5C)。


图5 Slit2沉默对Ox-LDL诱导HAEC凋亡的影响
3 讨论
Ox-LDL在动脉粥样硬化及其并发症的发生和发展中起着重要作用[4-5]。Ox-LDL促进平滑肌细胞、单核/巨噬细胞和成纤维细胞的生长和迁移,引起内皮细胞的氧化应激和细胞损伤,并进一步促进形成动脉粥样硬化斑块[6-7]。Ox-LDL通过结合并激活凝集素样ox-LDL受体1(LOX-1)诱导血管内皮细胞凋亡[8]。本研究发现,Ox-LDL诱导miR-200c在HAEC中高表达,预示miR-200c可能在Ox-LDL诱导的血管内皮细胞损伤中具有一定的调控作用。ZHANG等[9]对糖尿病小鼠和患者的研究发现,miR-200c在糖尿病小鼠和患者动脉中的表达水平上调,并指出miR-200c可能是糖尿病血管病治疗的重要靶点。MAGENTA等[3]的研究指出氧化应激损伤上调人脐静脉内皮细胞(HUVEC)miR-200c的表达水平,并通过进一步研究发现抑制miR-200c可促进HUVEC的增殖且抑制H2O2诱导的细胞凋亡。本研究也发现,抑制miR-200c的表达可促进HAEC细胞增殖并减弱Ox-LDL对HAEC凋亡的诱导作用。凋亡是清除有害刺激如Ox-LDL损伤细胞的过程,一定程度上代表着Ox-LDL对细胞的损伤程度[10]。动脉粥样硬化发生过程中凋亡细胞数量增多,细胞凋亡可通过调控病变细胞进而产生血管阻塞[11-12]。结合本研究结果,miR-200c对于Ox-LDL诱导的心血管损伤具有重要的调控作用。
为进一步探讨miR-200c调控Ox-LDL损伤HAEC的可能机制,本研究通过miRNA靶基因预测网站对比发现Slit2为miR-200c的潜在靶点,并通过荧光实验证实该猜想。Slit2是Slit家族成员之一,参与血管形成等大部分器官系统的发育[13]。Slit2在癌症、子痫惊厥以及增生性视网膜病变等人类疾病中的血管再生过程中均具有十分重要的作用。它与Robo1的结合可诱导肿瘤血管生成与淋巴管生成,并参与血管的发育[14]。LI等[15]的研究发现,Slit2可促进HUVEC的增殖、迁移和小管形成。本研究发现,抑制Slit2表达可部分逆转miR-200c沉默对Ox-LDL损伤HAEC的保护作用,表明miR-200c可能部分通过靶向作用于Slit2调控Ox-LDL损伤HAEC的增殖和凋亡,进而起到保护HAEC免受Ox-LDL损伤的作用。
综上所述,本研究结果表明miR-200c在Ox-LDL损伤HAEC表达上调;抑制miR-200c表达可促进HAEC细胞增殖并抑制细胞凋亡,由此可见miR-200c在Ox-LDL损伤HAEC中起着负调控的作用。此外,本研究还发现,miR-200c对HAEC的调控作用是部分通过靶向作用于Slit2实现。这将为动脉粥样硬化等类似心血管疾病的分子治疗靶标提供新的实验依据,但其相关分子机制还有待于进一步的探索。

