利于树突棘形态学观察的原代海马神经元转染方法的优化*
李 莎 司 尧 冯宝峰 张沂洲 崔慧先△
(河北医科大学,1 人体解剖学教研室,2 神经科学研究中心,石家庄 0050017)
与细胞系自身缺陷较多以及不能很好地模拟体内神经元的功能和状态相比,原代神经元的体外培养在神经系统尤其是神经退行性疾病的研究中发挥着重要的作用[1]。海马是与学习记忆功能密切相关的重要脑区,其突触可塑性与学习记忆功能密切相关。树突棘是脑内兴奋性连接的主要位点,在突触形成及其功能上发挥着重要的作用,树突棘在数量和形态方面的改变会直接影响突触的功能,进而影响脑功能的改变,所以观察培养原代海马神经元树突棘的形态学变化是研究神经退行性疾病突触可塑性机制的重要研究手段。活细胞成像能实时观察细胞动态,更直观地反映细胞变化,随着该研究手段越来越受关注,原代神经元的转染就成为研究手段中一项重要的实验技术。根据实验目的不同可以选择不同的转染方法,由于原代神经元属于高度分化的细胞,难于转染,又基于进行树突棘形态学观察的研究目的,本研究选择用Lipofectamine 2000和慢病毒2种转染方法对原代海马神经元进行绿色荧光蛋白(green fluorescence protein,GFP)质粒转染,观察原代海马神经元的转染效果及树突棘的形态。
1 材料和方法
1.1 实验动物与主要试剂
孕18d SD大鼠购自河北医科大学动物实验中心。Lipofectamine 2000购自Invitrogen;GFP质粒购自Addgene;含有GFP的慢病毒购自吉凯基因;DMEM培养基、Neurobasal培养基和OptiMEM培养基购自Invitrogen;胎牛血清、B27添加剂、谷氨酰胺、丙酮酸钠、青链霉素购自Gibco;Accutase消化酶购自Millipore;DNA酶购自TaKaRa;细胞黏附液购自普利莱。
1.2 大鼠原代海马神经元培养
孕18d SD大鼠用乙醚经鼻腔吸入麻醉,无菌操作快速取出胎鼠脑组织于预冷的D-hanks缓冲液中,剥离两侧海马,组织剪剪碎后,用含有0.1% DNase的Accutase酶消化15min,消化期间每隔5min轻晃一下,消化结束后静置去上清,用含B27的Neurobasal培养基吹打重悬,静置取上清液,100目过滤,离心去上清,用含10%胎牛血清的DMEM培养基重悬,200目过滤,种于共聚焦专用培养皿上,种皿密度为1×105。3h后换为Neurobasal培养基进行培养,每3d换液1次。
1.3 大鼠原代海马神经元GFP转染
细胞培养至第8天进行转染。Lipofectamine 2000转染:转染前1天将培养基换成不含青链霉素的Neurobasal,加入125μl的OptiMEM培养基,再分别加入0.25μg的pEGFP质粒和0.75μl的Lipofectamine 2000转染试剂(此用量为单个皿的用量),超净台内室温孵育5min,然后将2管液体混匀,室温静置15min,使质粒和脂质体充分结合。将含有质粒和脂质体的混合液缓慢滴加到培养皿中,置于培养箱中进行培养,3h后换为含有青链霉素的Neurobasal培养基继续进行培养。慢病毒转染:经过前期感染复数(MOI)的摸索,确定MOI为30。用1ml新鲜的培养基混入3μl慢病毒,轻轻混匀,将原培养基换成含有慢病毒的培养基。转染2h后补加1ml培养基继续培养,第2天吸出含病毒的培养基换为新鲜培养基继续培养。激光共聚焦显微镜观察转染后荧光表达高峰时(转染72h)表达GFP的神经元,比较2种转染方法的转染效率,并分别在转染前后24h及转染后1周用台盼蓝进行染色,检测神经元存活率。动态、连续地观察比较转染1周后神经元生长状况及荧光表达情况,确定后续研究采用的转染方法。
1.4 Lipofectamine 2000转染GFP观察海马神经元树突棘生长发育情况
大鼠原代海马神经元培养至第8天用Lipofectamine 2000进行GFP转染,然后分别在转染后细胞培养至10、15、20d和25d时用共聚焦显微镜观察海马神经元树突棘生长发育情况。
1.5 不同时间转染对海马神经元树突棘形态学观察的影响
分别在大鼠原代海马神经元培养至8、12、16d用Lipofectamine 2000进行GFP转染,转染后细胞培养至20d时用共聚焦显微镜观察不同时间转染对海马神经元树突棘形态学观察的影响。
1.6 统计学处理
2 结果
2.1 Lipofectamine 2000和慢病毒转染GFP
对大鼠原代海马神经元进行GFP转染,两种转染方法在转染后荧光表达高峰时,全细胞表达GFP,活性较好的神经元胞体丰满,呈锥体形或多边形,神经元突起显现清晰,树突棘还未成熟,多是细长的丝状伪足。2种转染方法的转染率相比,Lipofectamine 2000转染效率为5.21%,低于慢病毒转染效率82.53%(P<0.05);但就转染前后神经元存活率而言,Lipofectamine 2000转染后24h存活率为93.78%,高于慢病毒转染存活率83.37%(P<0.05)。转染1周后,Lipofectamine 2000转染存活率为91.59%,高于慢病毒转染存活率72.92%(P<0.05)。后期动态、连续的观察结果显示,Lipofectamine 2000转染成功的神经元生长状态良好,而慢病毒转染成功的神经元出现了较明显胞体边缘不圆润,胞内可见部分颗粒,突起杂乱不清晰,甚至有串珠样改变等现象,荧光表达也很微弱,较难清楚地显示树突棘结构。对于原代海马神经元培养树突棘形态学方面的研究而言,慢病毒转染难以用于后期树突棘的观察,Lipofectamine 2000转染显得更为优越(表1,图1,见封底)。
2.2 Lipofectamine 2000转染GFP观察海马神经元树突棘生长发育情况
大鼠原代海马神经元生长至第10天时,突起伸长明显,丝状伪足运动活跃并开始变短、变宽,荧光表达良好。第15天时,树突分支增多,交织呈网状,丝状伪足明显减少,发育中的树突棘呈现出细杆状和粗棒状,荧光表达良好。第20天时,树突棘发育比较成熟,形态多样,包括细杆状、短棒状或蘑菇状等,荧光表达减弱。第25天时,树突数目和分支减少,粗细不等或呈串珠样改变,树突棘形态杂乱,短粗状或蘑菇状的树突棘大幅度减少,细长的树突棘增多,荧光表达明显降低(图2,见封底)。
2.3 不同时间转染对海马神经元树突棘形态学观察的影响
就转染效率而言,第8天和第12天转染效率尚可,且两者的转染效率没有明显的差别,但第16天的转染效率非常低,仅少数神经元被转染。从转染后荧光表达情况来评判,第8天转染的神经元培养至第20天时荧光表达量很低,树突棘的形态不清晰,不适合转染后长时间培养进行树突棘观察;第12天转染的神经元培养至第20天时荧光表达良好,树突棘形态清晰可见,适合进行树突棘的活细胞成像(图3,见封底)。
3 讨论
观察树突棘的变化对阐明神经元的发育以及研究神经系统疾病突触可塑性机制具有重要意义[2]。传统的通过固定细胞后染色研究树突棘形态的方法,虽有广泛的应用,但这些方法不能体现树突棘的动态变化过程。随着研究的深入,转染GFP表达的神经元活细胞成像技术因可实现对树突棘的生长发育以及使用药物或其他干预手段对树突棘影响的实时动态观察,目前已成为树突棘形态学机制研究的的有效方法[3]。常用的转染方法有磷酸钙沉淀转染、脂质体转染、病毒转染、电穿孔转染等[4]。对于细胞系而言,这些方法均可获得较理想的转染效果。但对于不能进行细胞分裂、高度分化的原代培养神经元来说,外源基因难以进入,较难转染。在常用的转染方法中,转染效率和细胞毒性等为需要考虑的重要问题。磷酸钙沉淀转染成本低、操作简单,但转染效率一般在1%~5%之间,且结果常不稳定[5];电穿孔转染为目前最自动化和较高效的转染方法,但细胞存活率较低,且需要电转仪等仪器设备[6];脂质体转染是体外实验应用最广泛的转染方法之一,传统的Lipofectamine 2000试剂较此基础上的换代产品来说,转染效率虽无优势,但转染稳定,神经元存活率高[7-8];病毒转染是体外培养神经元转染效率最高的转染方法,应用广泛[9]。
基于对树突棘进行形态学研究的目的,本研究使用Lipofectamine 2000和慢病毒2种转染方法对原代海马神经元进行GFP质粒转染,在转染效率、存活率以及神经元生长状况、荧光表达情况等方面进行比较。结果显示,Lipofectamine 2000转染方法虽然转染效率较慢病毒转染低,但神经元存活率高。同时,Lipofectamine 2000转染对体外培养的海马神经元无明显毒性,细胞生长状况良好。慢病毒转染成功的神经元还未等树突棘发育成熟,便出现了较明显胞体边缘不圆润,胞内颗粒、突起杂乱不清晰,甚至有串珠样改变等现象,荧光表达也很微弱,较难清楚地显示树突棘结构。对于原代海马神经元培养以单个神经元为观察对象的树突棘形态学方面的研究而言,慢病毒转染难以用于后期树突棘的观察研究,Lipofectamine 2000转染显得更为优越,能够较好地满足研究需要。当然,对于使用Lipofectamine 2000进行转染这项技术受多方面因素的影响,比如细胞状态、细胞密度、转染试剂与质粒的比例以及转染时间的长短等,这些都直接影响转染的效果。
神经元发育早期,树突干上有许多未成熟的丝足状突起,进行着伸缩、摆动、分杈和扭曲等活跃的动态活动。随着神经元的发育,丝足状突起发育为形态多样的成熟的树突棘。本研究优化了Lipofectamine 2000转染原代海马神经元观察成熟树突棘形态学的方法。通过这一方法,对培养12d的原代海马转染后至20d时,运用激光共聚焦显微镜搭配活细胞工作站进行神经元树突棘形态学观察,可清晰显示表达GFP海马神经元的形态,结合活细胞成像即可达到高对比度、高清晰度和高分辨率地动态观察树突棘形态变化的目的,为更深入地研究树突棘可塑性提供了良好的形态学依据。
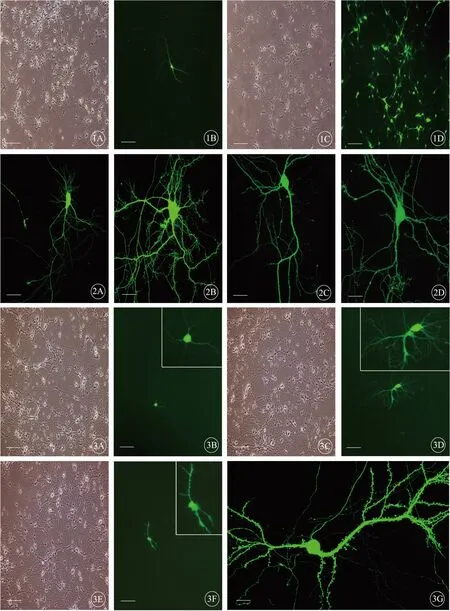
图1 Lipofectamine 2000和慢病毒转染GFP结果,第8天转染,第11天观察,标尺=50μm。A,B:Lipofectamine 2000组;C,D:Lentivirus组.
图2 Lipofectamine 2000转染GFP观察海马神经元树突棘生长发育情况,第8天转染,第10、15、20和25天观察,标尺=50μm。A:第10天;B:第15天;C:第20天;D:第25天.
图3 Lipofectamine 2000不同时间转染GFP对海马神经元树突棘形态学的影响,第8、12、16天转染,第20天观察,标尺=50μm。A,B:第8天;C,D:第12天;E,F:第16天;B,D,F转染区域放大;G:Lipofectamine 2000转染培养12天原代海马神经元,转染后培养至20天时进行神经元树突棘形态学观察.
Fig 1 The transfection result of Lipofectamine 2000 and Lentivirus with GFP,transfected on day 8,observed on day 11,bar=50μm.A,B:Lipofectamine 2000 group;C,D:Lentivirus group.
Fig 2 The result of the growth and development of dendritic spines using the transfection of Lipofectamine 2000,transfected on day 8,observed on day 10,15,20 and 25,bar=50μm.A:day 10;B:day 15;C:day 20;D:day 25.
Fig 3 The effect on the morphology of hippocampal neuron dendritic spines when transfected on different times using the transfection of Lipofectamine 2000,transfected on day 8,12 and 16,observed on day 20,bar=50μm.A,B:8d;C,D:12d;E,F:16d;Magnification of transfected area was shown in the inset of Figure B,D,F.G:Lipofectamine 2000 transfected hippocampal neuron on day 12 and then observed the morphology of dendritic spines on day 20.