从高考试题中探究“原子结构”考查热点
汤 伟
安徽
近年来,高考在考查知识与能力的同时,也特别关注化学学科素养的考查,其中“宏观辨识与微观探析”是化学学科素养的主要内容之一。我们研究发现,“原子结构”的知识要点在高考中可以较好的渗透该学科素养中的相关内容,下面通过具体实例,针对该考点做一探究。
一、原子结构中的几种微粒关系
微观世界里,人们看不见摸不着,科学家是如何引导我们认识微观世界里的境界呢?学科素养中“证据推理与模型认知”较好的诠释了科学研究的过程,最早科学家道尔顿提出了原子的基本结构模型,后来经过众多科学家的大量实验推理,不断完善,得出了我们现在的“原子结构”中的一些经典观点。目前,在高考中成为热点之一的就是原子结构中常见的一些微粒的基本关系,具体考查要点有:
1.电性关系
中性原子:核电荷数=核内质子数=核外电子数=原子序数
阴离子:核外电子数=质子数+所带的电荷数
阳离子:核外电子数=质子数-所带的电荷数
2.质量关系
质量数=质子数+中子数
3.表示原子结构的“三种方式”

例:

(2)原子结构示意图着重描述核外电子排布情况
例:

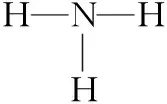
(3)电子式着重描述原子最外层电子或原子构成的物质中最外层电子的成键情况
4.易错点提示
①任何粒子中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴、阳离子。
②质量数大约等于该原子的相对原子质量。不能够理解为等于该元素的相对原子质量,有时候二者相差较大。

④质子数相同的粒子不一定属于同种元素,如NO与CO。
⑤核外电子数相同的粒子,其质子数不一定相同,如Na+、F-等。
例题1(2018年高考题重组)下列相关说法正确的是
( )
A.[2018·全国卷ⅢT8A]24 g 镁与27 g铝中,含有相同的质子数
B.[2018·全国卷ⅢT8B]同等质量的氧气和臭氧中,电子数相同
C.[2018·全国卷ⅢT8C]1 mol重水与1 mol水中,中子数比为2∶1

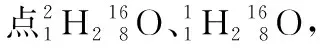
【答案】B
二、几组易混淆的概念
涉及原子结构的知识点中,常常会出现一些类似“核素、元素、同位素”以及“原子的相对原子质量、元素的相对原子质量”等容易混淆的概念,这些知识尽管近年来已经不是高考的热点,但是我们学习原子结构的相关知识时,还是要厘清这些不同概念的内涵与外延,这也是学科素养的基本要求。
1.厘清“元素、核素、同位素”概念间的不同及相互关系

2.理解同位素的“六同三不同”
3.熟知几种重要的核素及其应用
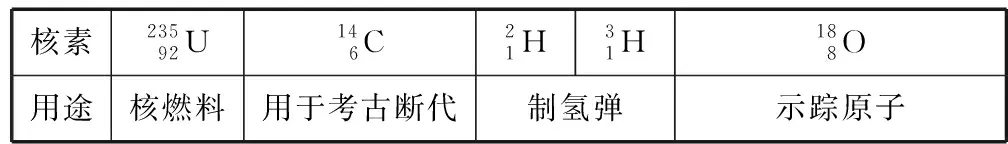
核素23592U146C21H31H188O用途核燃料用于考古断代制氢弹示踪原子
4.了解四个“量”的区别

类别定义实例原子质量某元素某种核素的一个原子的真实质量一个168O原子的质量是2.657×10-26 kg原子的相对原子质量原子的质量与一个126C原子质量的112的比值168O的相对原子质量约为16元素的相对原子质量元素的各种天然同位素的相对原子质量与其在自然界中所占的物质的量分数计算出的平均值Ar=Ar(A)·a%+Ar(B)·b%+…(其中a%+b%+…=1)质量数某原子核内质子数与中子数之和188O的质量数为18

( )




【答案】D
三、从原子结构知识延伸考查电子式与化学键
宏观上所见到的各种物质均是由原子按照一定方式结合在一起的,这也就是学科素养中提到的“宏观辨识与微观探析”的要点之一,近年来我们通过研究高考试题,可以发现通过考查电子式或化学键能够较好地考查考生是否真正理解该知识要点,这也是近年来高考一直重点考查的热点之一。我们学习该知识要点,需要重点把握如下几个关键点:
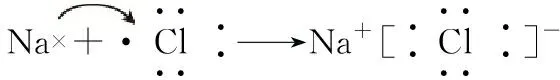
1.电子式的书写
(1)书写电子式需注意的4个问题
①阴离子和复杂阳离子要加括号,并注明所带电荷数
②要注意化学键中原子直接相邻的事实
③不能漏写未参与成键的电子对
④无论何种粒子,其电子式都是以原子为基本单位组成的,不能出现角码
(2)书写电子式常见的几个误区

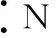
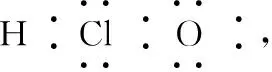

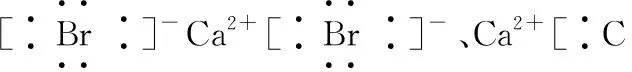
2.化学键及其类型的判断
(1)化学键与物质间的关系

注意以下几个重要的结论:
①存在离子键的化合物一定是离子化合物
②离子化合物中一定存在离子键,可能存在共价键
③共价化合物中只含共价键,一定不含离子键
④由金属元素和非金属元素形成的化合物也可能是共价化合物,如AlCl3
(2)辨清化学键与物质类型的关系
除稀有气体内部无化学键外,其他物质内部都存在化学键。化学键与物质类型之间的关系可概括如下:
①只含有极性共价键的物质一般是不同种非金属元素形成的共价化合物,如SiO2、HCl、CH4等。
②只含有非极性共价键的物质是同种非金属元素形成的单质,如Cl2、P4、金刚石等。
③既有极性键又有非极性键的共价化合物一般由多个原子组成,如H2O2、C2H4等。
④只含离子键的物质主要是由活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CaCl2、NaCl等。
⑤既有离子键又有极性共价键的物质,如NaOH、K2SO4等;既有离子键又有非极性共价键的物质,如Na2O2等。
⑥仅由非金属元素形成的离子化合物,如NH4Cl、NH4NO3等。
例题3(2018年高考题重组)下列相关说法正确的是
( )
①[2018·全国卷Ⅰ12TB]钙的氢化物为离子化合物
②[2018·全国卷Ⅱ10TB]氧元素与N、Na、Cl三种元素分别形成的化合物中只含有离子键
④[2018·全国卷ⅢT8D]1 mol乙烷和1 mol乙烯中,化学键数相同
⑦[2018·天津T7]Mg(OH)2的电子式:

A.①②③⑤⑦ B.①⑤⑥⑦⑧
C.②③⑥⑦⑧ D.②④⑤⑥⑧

【答案】B
四、原子结构与周期表、周期律相结合
高考化学中“位—构—性”一直是高考的热点和重点,其中“构”指的就是借助原子结构知识,可以推断原子在周期表中的位置、借助原子结构知识可以推断出元素相关性质,该知识点能够较好的体现出化学学科素养的内涵,它们之间的关系可以通过如下方式体现:

例题4(2018·全国卷Ⅰ·12)主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是
( )
A.常温常压下X的单质为气态
B.Z的氢化物为离子化合物
C.Y和Z形成的化合物的水溶液呈碱性
D.W与Y具有相同的最高化合价
【解析】该试题首先简介了四种不同原子结构的相关知识,“主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10”,但解题的突破口是物质的性质,借助“W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃”可以推断出HF腐蚀玻璃,所以W为F元素,Z为Ca或K元素,因为“W与Y同族”,所以Y为Cl元素,借助原子结构知识“W、X、Z最外层电子数之和为10”,可以推断出W为Ca时,X为Na,W为K时,X为Mg,由此可以得出,X为钠或镁单质在常温下不可能为气态,选项A错误;氢化钙或氢化钾均为离子化合物,选项B正确;Y和Z形成的化合物为氯化钙或氯化钾,其水溶液均显中性,不可能呈碱性,选项C错误;W最高价为+1 或+2,而Y最高价为+7价,二者不可能具有相同的最高化合价,选项D错误。


