驴沙门菌的分离鉴定及药敏试验
冯培祥,杨 莉,赵付伟,姜桂苗,高维平,嵇传良
(1. 国家胶类中药工程技术研究中心,山东 东阿 252201;2.东阿阿胶股份有限公司,山东 东阿 252201)
沙门菌(Salmonella)属肠道菌科,是一群形态、培养、生化反应和抗原构造相类似的重要肠道菌。其已确认的血清型超过2 500种[1]。沙门菌病是具有重要公共卫生学意义的人兽共患病病原菌。Mcllory[2]等报告,日、美等发达国家发生食物中毒的事件中40%~80%是由禽沙门菌引起的,其中主要病原为肠炎沙门菌。佘容[3]等报道,沙门菌极易通过直接或间接途径在人和动物之间传播,无中间宿主。人畜感染沙门菌后可呈无症状带菌状态,降低动物繁殖力,或加重病情及死亡率,也可表现为有临床症状的致死性疾病,造成巨大的经济损失,严重威胁人的身体健康和畜牧业的健康发展。其来源主要是患病的人和动物及带菌者通过粪便、尿、乳汁及流产胎儿、胎衣和羊水等排出,污染水源、土壤和饲料等[3]。本病常发生于猪、鸡、牛等动物,而关于马属动物特别是驴的沙门菌病国内报道很少。刘建国等[4]报道从一头死亡驴的肝、脾、淋巴结中分离到沙门菌,确定其是驴死亡原因。作者通过检测一例流产驴驹胎儿组织,并从中分离并鉴定出沙门菌,确定其是引起流产的致病菌。之后对其进行了药敏试验,药敏试验结果为该病在临床上的用药选择提供了依据,也为驴上沙门菌病的诊断与预防提供了参考。
1 材料与方法
1.1 材料
1.1.1 样品采集 2017年7月份,聊城某养驴厂母驴出现流产现象,采集一头流产胎儿,对其进行剖检,采集了心、肝、脾、肺、肾等脏器。将采集的样品保存于4 ℃环境中,在12 h 内进行细菌分离培养。
1.1.2 主要试剂及培养基 pMD19-T载体、dNTP、TaqDNA 聚合酶、琼脂糖、DL-2 000 DNA Marker、凝胶回收试剂盒、DNA提取试剂盒,均购自宝生物工程(大连)有限公司。普通营养琼脂培养基、S.S.培养基、XLD培养基、MH培养基,购自青岛海博生物技术有限公司。
1.1.3 药物 复方新诺明、诺氟沙星、庆大霉素、青霉素、丁胺卡那霉素、氯霉素、红霉素、强力霉素、氧氟沙星、四环素、洁霉素C、多黏菌素B、环丙沙星等药敏纸片,购自杭州天和微生物试剂有限公司。
1.1.4 主要设备 赛默PCR基因扩增仪(2720)、山东鑫科生物科技股份有限公司自动生化/药敏分析仪(XK型)、北京君意垂直电泳仪(JY300C)。上海一恒恒温振荡器(THZ98A)、湖南湘仪冷冻离心机(H1850R)、山东鑫科比浊仪(XK型)。
1.2 方法
1.2.1 病原的分离及特性培养 无菌采集剖检流产驴驹的肝脏、脾脏和肺脏、心脏及肾脏,通过三区划线将上述脏器分别接种普通琼脂平板、S.S.琼脂培养基、麦康凯培养基平板,每一种脏器分别接种2份平板,1份进行需氧培养,1份进行厌氧培养。置于 37 ℃恒温培养箱内培养24~48 h 后观察平板有无菌落形态并进行革兰染色镜检。参考文献[5]方法检测病变器官是否有病毒感染,将上述病变器官称重、研磨。按1∶5(W/V)比例加入PBS制成悬液,加入双抗1 500 IU(μg)/mL,反复冻融 3~4次,离心取上清液并过滤接种至犊牛睾丸细胞,37 ℃培养,观察细胞病变,并将细胞染色后于电镜下观察。
1.2.2 分离菌生化鉴定 按照山东鑫科生化鉴定试剂盒说明书进行操作,上机通过其自动生化仪(XK型)进行鉴定,通过生化仪自动判读结果。
1.2.3 药敏试验 参照CLSL(Clinical and Laboratory Standards Institute)推荐的K-B纸片扩散法进行药敏试验[6],参照赵战锋[7]等的方法,将分离纯化的2株细菌,接种于普通LB液体培养基中培养24 h。超净台内用无菌生理盐水稀释菌液,通过比浊仪将菌液稀释成0.5麦氏标准的菌悬液,吸取200 μL菌液于MH培养基平板内,在其表面涂布均匀,盖上平板,于37 ℃放置5 min,然后取回在超净台内,用无菌小镊子夹取各种药敏纸片,平贴于琼脂表面,倒置于37 ℃恒温培养箱培养18~24 h,平板取出后,观察药敏纸片周围有无抑菌圈形成,测量其直径(mm)大小。每株细菌的药敏试验设置一个重复。参考罗玲[8]等报道方法进行结果判定: 直径>15 mm 为高度敏感;10.1 mm<直径≤15 mm为中度敏感;直径≤10 mm 为耐药。
1.2.4 16S rRNA基因序列测定与系统进化分析 将2株分离菌接种于普通LB液体培养基中培养24 h,采用苯酚-氯仿法抽提分离菌株基因组DNA。自行设计16S rRNA上游引物F:5′-GGTTACCTTGTTACGACTT-3′,下游引物R:5′-AGAGTTGATCCTGGCTCAG-3′。PCR反应体系为30 μL,即ddH2O 19 μL、10×Buffee 5 μL、dNTP Mix 2.5 μL、Taq酶 0.5 μL、上下游引物各0.5 μL(引物浓度为40 pmmol/μL)、DNA模板2 μL。PCR反应条件为94 ℃ 预变性 5 min;94 ℃变性 30 s,55 ℃ 退火 40 s,72 ℃ 延伸 60 s,30 个循环;72 ℃ 终延伸 8 min。扩增产物结束后,PCR 产物用 1% 琼脂糖凝胶电泳检查结果,并用胶回收试剂盒回收纯化 PCR 产物。纯化的目的片段与 pMD19-T 载体相连,转化大肠杆菌感受态细胞,经 PCR 鉴定后,将阳性重组质粒送往生工生物工程(上海)股份有限公司测序并命名为A1、A2。
将上述2株分离菌的16S rRNA 基因序列通过NCBI的Blast 检索系统进行序列的同源性分析,使用软件从GenBank 数据库中获得的沙门菌的16S rRNA 序列进行多序列匹配排列(Multiple Alignments),采用邻接法(Neighbor joining method)构建分支系统树。
2 结果
2.1 分离菌培养特征及形态观察 分别从流产驴驹肝、肺内分离到2株细菌,分别命名为A1、A2,未分离到其他细菌。该分离菌在普通营养琼脂平板上菌落边缘整齐,表面光滑,半透明。小凸起。在S.S.培养基上呈无色透明,菌落中心有黑色圆点。其在麦康凯培养基上长出表面光滑、半透明的圆形菌落。2株分离菌革兰染色为阴性,杆状,无芽孢,无荚膜,有鞭毛。散在或个别成排排列,菌体体积大小约为0.6~1.0×2~3 μm。
病变肝肺组织研磨悬浮上清液接种于犊牛睾丸细胞后,未出现病变,镜检也未发现病毒颗粒。
2.2 分离菌生化反应结果 将2株分离株于LB液体培养基中,在37 ℃恒温摇床培养24 h 后,于超净台内用灭菌生理盐水将菌液稀释至0.5麦氏比浊浓度,按照山东鑫科生物科技股份有限公司细菌生化鉴定测试试剂盒(XK-24A-C)说明书进行操作,2株分离菌生化反应结果一致,均符合沙门菌生化特性。结果见表1。
2.3 药敏试验结果 对2株分离菌的抑菌圈大小进行测量,结果显示,2株分离菌的药物敏感性基本一致,取其平均值,结果见表2。

表1 分离菌株的生化鉴定结果
“+”阳性反应,“-”为阴性反应
表2 2株分离株的药物敏感性(平均值)
R 耐药;I 中度敏感;S 敏感
2.4 16S rRNA基因序列测定与系统进化分析 提取2株分离菌的DNA后,对其16S rRNA进行扩增,在1 500 bp处有目的条带,与预期扩增结果相一致(图1)。 测序结果显示,2株分离菌的16S rRNA基因序列长度均为1 560 bp,将2株分离菌16S rRNA基因序列与GenBank 核算数据库进行同源性检索,其结果与沙门菌的16S rRNA 基因自然聚类,将分离株分别与 GenBank收录的沙门菌通过DNAStar进行同源性分析,并绘制成系统进化树(图2)。结果显示,2株分离株核苷酸序列之间的同源性为98.6%,与GenBank收录的其他肠炎沙门菌EU073020.1、MF521947、MF682400同源性分别为99.4%、99.3%、97.7%。与GenBank收录的霍乱沙门菌DQ344535、NZ_MYYB01000065、NZ_MYYT01000080同源性分别为99.6%、96.3%、44.5%。与GenBank收录的伤寒沙门菌AB855736、JQ284055.1、KX232359、MG270582同源性分别为97.3%、96.9%、89.4%、98.1%。与GenBank收录的鼠伤寒沙门菌JN254642、KY750226同源性分别为96.9%、95.9%。与GenBank收录的亚利桑那沙门菌AB273736、KX082838、NR_116125同源性分别为97.5%、97.4%、98.1%。系统发育树结果显示,2株分离菌处于同一分支,且与霍乱沙门菌DQ344535最近、与肠炎沙门菌MF521947、EU073020.1遗传距离较伤寒沙门菌、鼠伤寒沙门菌的其他分离株遗传关系较远。
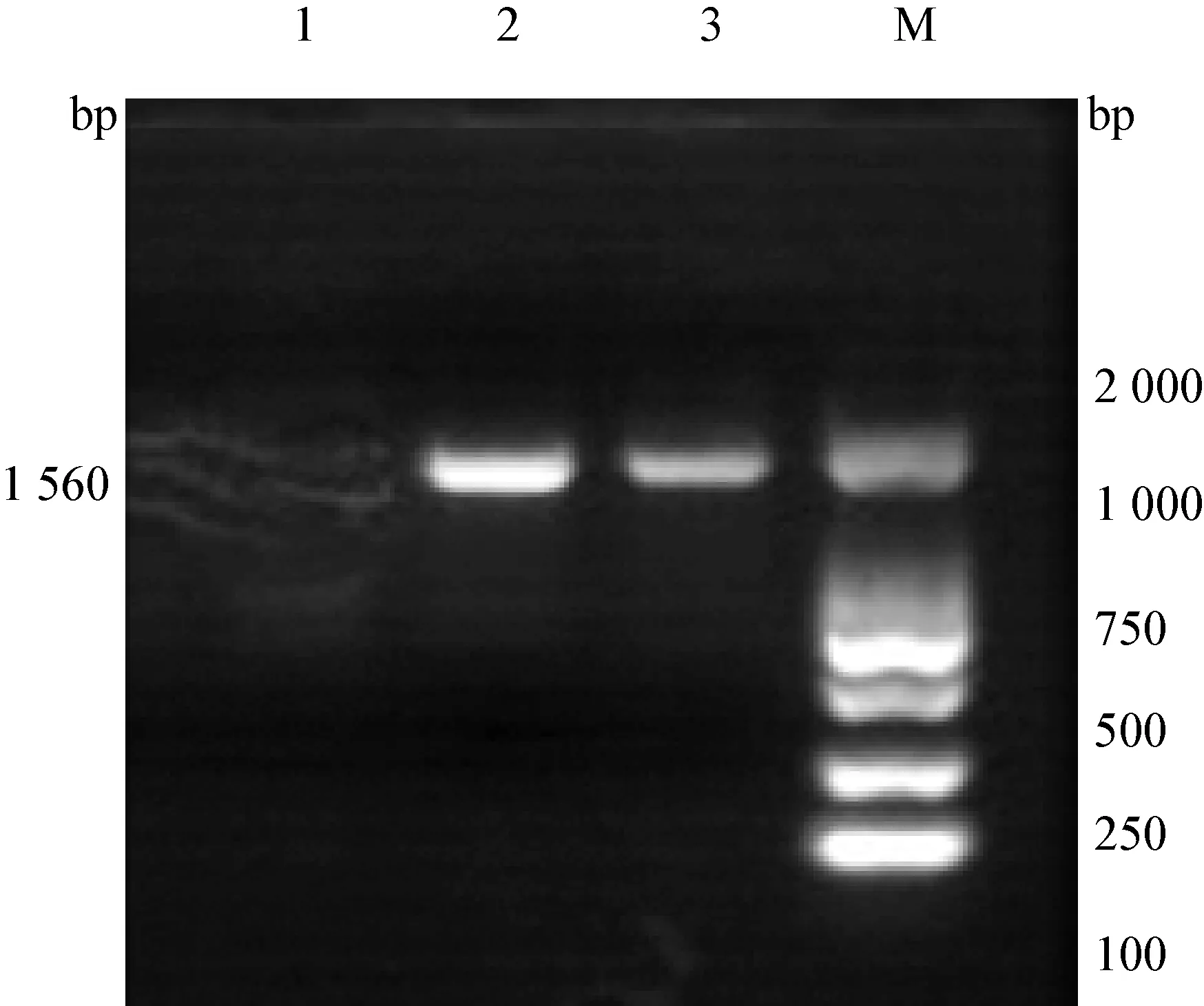
图1 2株分离菌16S rRNA目的基因的PCR结果
1:阴性对照; 2:A1; 3:A2; M:DL-2 000 Marker
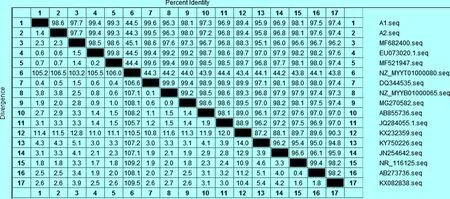
图22株分离菌16SrRNA基因序列的同源性

图3分离菌16SrRNA基因系统进化树
3 讨论
本试验从流产驴驹的肝脏与肺脏分离到2株革兰阴性杆菌,经生化鉴定为沙门菌,将所得菌株的16S rRNA基因序列在NCBI上用Blast 进行同源性比较,分离株与霍乱沙门菌的同源性最高为99.6%。除了传统的分离鉴定及生化鉴定以外,本试验选取了保守的16S rRNA基因并结合基因测序手段实现了沙门菌的诊断。16S rRNA基因为细菌高度保守基因,具有细菌种、属特征,已被用作细菌系统发育分类的目的基因,是一种对细菌分类鉴定快速、准确的方法[9]。据报道[10-11]沙门菌可以引起妊娠并发症,比如绒毛膜羊膜炎、经胎盘的胎儿感染、早产、流产、新生儿和产妇败血症。据Noto[12]等报道,低剂量的肠炎沙门菌可以导致怀孕后期鼠模型母体感染,导致40%早产和33%流产以及胎儿的生长缓慢。
沙门菌分离鉴定及药敏试验在猪、鸡、鸭上等报道较多[13-14]。在马属动物特别是驴上报道较少。加春生[12]等报道,其从猪粪便中分离出的沙门菌对氨苄西林100%耐药;对头孢西丁哌拉西林、头孢噻肟等药物存在不同程度的耐药;对碳青霉烯类敏感。王傲雪[13]等报道的其对26株沙门菌进行分离鉴定后,对5株强阳性菌株进行药敏试验,药敏试验结果显示,5株沙门菌对头孢噻肟较为敏感。对氨苄西林、替米考星、林可霉素、阿奇霉素和头孢拉定表现极高的耐药性,耐药率达100%。吴新明[15]等报道的其分离鉴定38株鸭源沙门菌对21种抗生素均有不同程度的耐药,并以多重耐药为主,耐药性差异大,最为敏感的抗生素是磷霉素和阿米卡星两种药物。通过上述报道可见,沙门菌在猪、鸡、鸭上均出现不同程度的耐药性,提示上述动物在规模化养殖过程中,在兽药广泛的使用的同时,耐药菌株也随之出现。本试验中2株沙门菌分离株对大部分药物具有敏感性,尤其对喹诺酮类药物(氧氟沙星、环丙沙星、诺氟沙星)、复方新诺明敏感;对庆大霉素、丁胺卡那霉素、多黏菌素中敏;对青霉素、头孢氨苄、红霉素、克林霉素有耐药性。推测可能在马属动物特别在驴上传染病与临床用药较少,故分离株对大多数药物敏感。由于驴的繁殖周期较长和用驴作为实验动物成本较高、试验周期较长等原因,本试验的不足之处在于未进行分离株回归本源动物试验。

