左、右半结肠癌KRAS基因和VEGF表达水平及其临床意义
邹劲林,牛 斌,莫湘琼,凌志东
(中山大学附属第五医院胃肠外科,广东珠海 519000)
结肠癌是最常见的消化道恶性肿瘤之一,1990年BUFILL等[1]首次较为系统的从流行病学、病理学、细胞遗传学、分子特征、致癌机制等方面阐述了左半结肠癌(LCC)与右半结肠癌(RCC)的差异,提出LCC、RCC是两种疾病。原发肿瘤的部位对结直肠癌预后的影响是其研究的热点之一,但是仍存在争议[2]。肝转移是结肠癌重要致死性因素之一,与多种因素有关,其中血管内皮生长因子(VEGF)在恶性肿瘤发生与发展中具有重要促进作用。鼠类肉瘤病毒癌基因(KRAS)对人类癌症影响很大。KRAS和神经母细胞瘤癌基因(NRAS)是Ras基因家族中的重要基因,是表皮生长因子受体(EGFR)信号转导通路中重要的介导因子,控制细胞增殖和存活。作者通过回顾性分析本院收治的结肠癌患者的临床资料, 对比LCC、RCC的主要临床病理特征与KRAS基因突变率和VEGF表达差异性及其对肝转影响情况。
1 资料与方法
1.1一般资料 选择2004年1月至2011年12月本院收治的结肠癌患者218例,其中男123例,女95例,年龄29~83岁,平均(47.40±5.60)岁。临床、病理、影像、治疗、随访资料完整,随访时间5年以上。按照原发肿瘤部位分为LCC组和RCC组,所有患者术后辅助治疗参照《NCCN结直肠癌临床实践指南》,肝转移患者的治疗参照文献[3]。两组患者临床相关资料比较,见表1。
1.2方法
1.2.1主要试剂和仪器 人类KRAS基因突变检测试剂盒及石蜡包埋组织DNA提取试剂盒购自厦门艾德生物医药科技有限公司;微量紫外分光光度计购自美国Thermofisher sci-entific公司;CFX96荧光定量PCR仪购自美国BIO-RAD公司。
1.2.2KRAS基因突变检测方法 (1)DNA提取:挑选肿瘤组织相对较多的蜡块切10张4 μm厚切片,脱蜡处理,再切1张2.5 μm厚切片进行HE染色,据HE染色结果,提取DNA。(2)基因突变检测:严格按照艾德DNA提取试剂盒的说明进行操作。
1.2.3免疫组织化学法检测VEGF表达 将已知阳性切片作为阳性对照,用PBS代替一抗作阴性对照。
1.3统计学处理 采用SPSS13.0统计软件进行数据分析,两样本率进行χ2检验,样本小于40的采用Fisher确切概率法,Mann-Whitney秩和检验比较基因突变与结肠癌及其肝转移灶临床病理特征的关系,采用Logisitie多因素回归分析影响肝转移发生的危险因素,以P<0.05为差异有统计学意义。
2 结 果
2.1LCC及RCC的临床病理特点 RCC发病年龄超过60岁、低分化、原发肿瘤大于5 cm、脉管侵犯、神经侵犯、Ⅳ期病例数、初诊时合并肝转移等构成比均高于LCC(P<0.05),但初诊时合并肠梗阻和可切除肝转移比例LCC高于RCC(P<0.05),见表1。
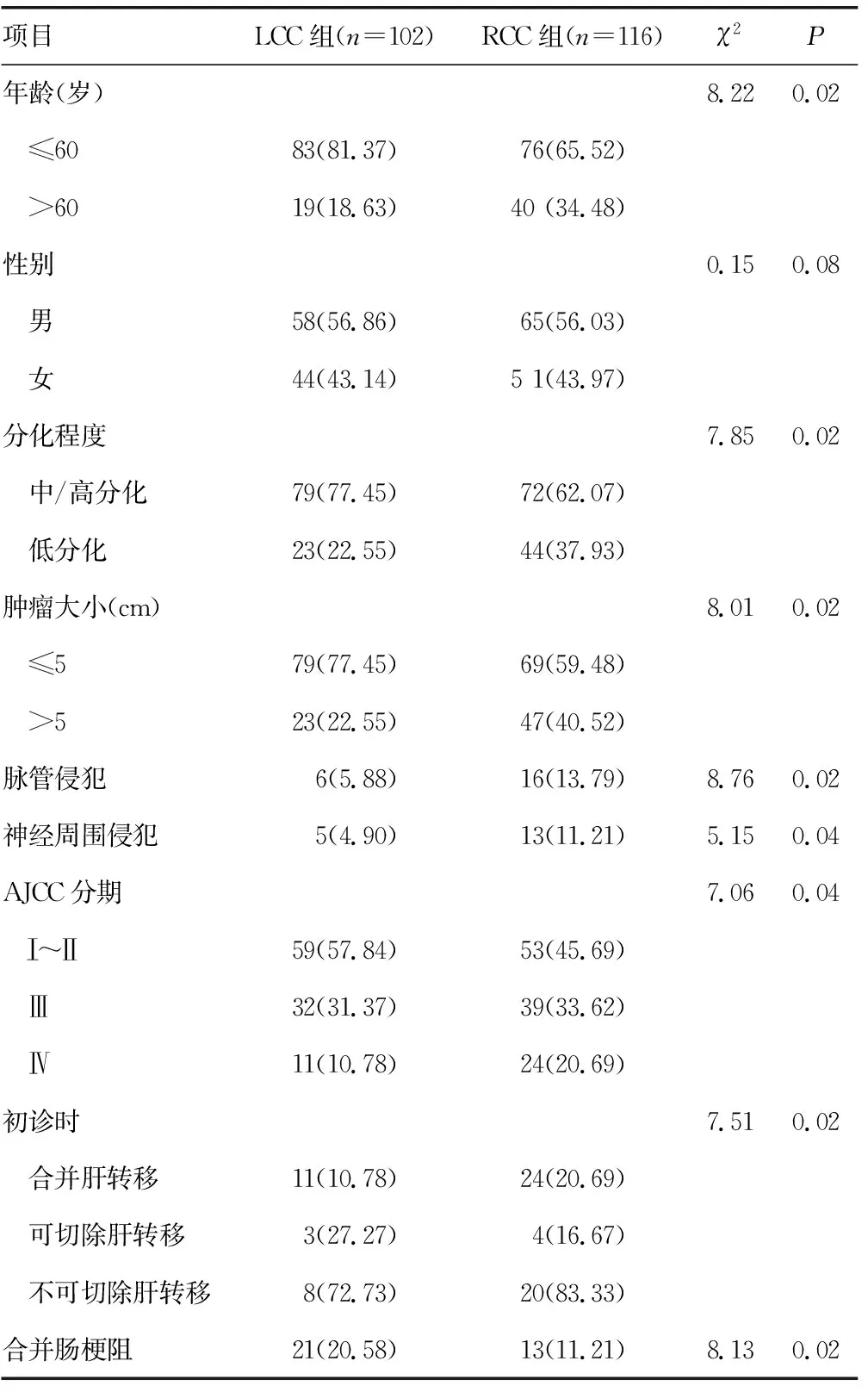
表1 两组患者临床相关资料比较[n(%)]
2.2LCC及RCC组的KRAS基因突变和VEGF阳性表达比较 LCC、RCC的KRAS基因突变率分别为29.41%(30/102)、42.24%(49/116),两组比较差异有统计学意义(P<0.05)。初诊时合并神经周围侵犯、肝转移的LCC、RCC基因突变率比较,差异无统计学意义(P>0.05);肝转移可切除和不可切除基因突变率组间比较差异无统计学意义(P>0.05),但LCC和RCC可切除与不可切除组内基因突变率比较,差异均有统计学意义(66.67%vs.87.50%,50.00%vs.95.00%,χ2=9.55、16.71,P<0.05)。其他项目KRAS基因突变率组间比较,差异均有统计学意义(P<0.05);KRAS基因突变率在年龄、性别和分化程度方面组内比较差异均无统计学意义(P>0.05)。LCC、RCC组患者的VEGF阳性表达率分别为64.71%(66/102)、80.17%(93/116),两组比较差异有统计学意义(P<0.01)。LCC和RCC组间大于60岁、原发肿瘤大于5 cm、合并脉管侵犯、Ⅳ期、肝转移和肠梗阻阳性率比较,差异有统计学意义(P<0.05)。分化程度和合并神经侵犯组间比较,差异无统计学意义(P>0.05),见表2。
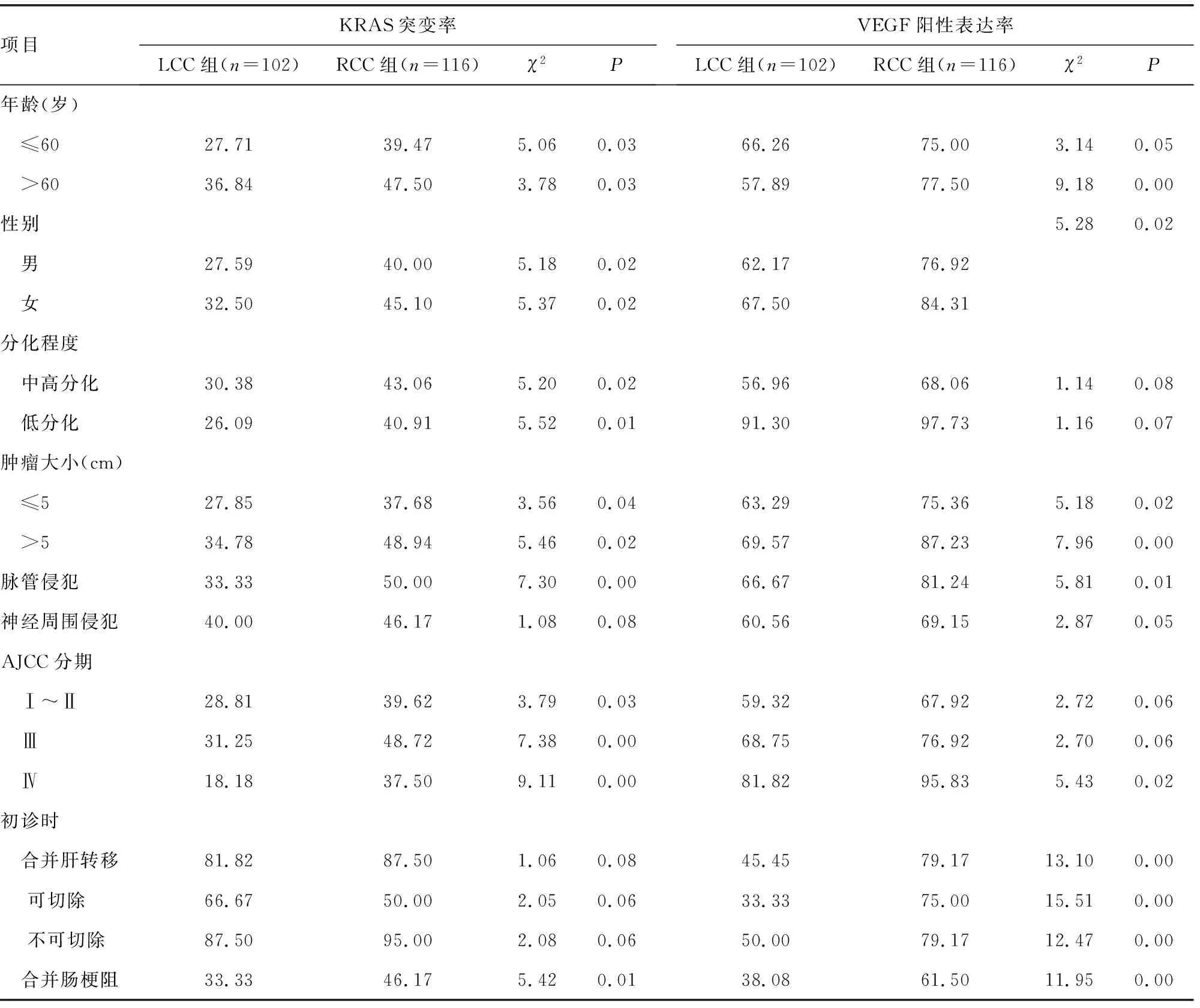
表2 LC和RC主要临床病理因子构成比、KRAS突变率及VEGF阳性率(%)
2.3影响LCC及RCC肝转移的因素 进行Logistic回归分析结果显示,肿瘤部位、大小、分化程度、脉管侵犯、KRAS基因突变率和VEGF阳性表达率均是结肠癌肝转移的危险因素。
2.4两组患者随访结果比较 两组患者随访时间均大于或等于60个月, 7例失访,60个月随访率为96.79%(211/218)。LCC、RCC组患者总5年生存率分别为71.61%(73/102)、59.53%(69/116),两组比较差异有统计学意义 (P<0.05)。
3 讨 论
在过去较长时期临床上一直将LCC、RCC视为同一种疾病进行治疗。自从BUFILL等[1]提出二者是两种不同疾病并基于结肠不同胚胎起源提出左、右半结肠之分,认为LCC、RCC应被视为不同类型的两种疾病[4]。国内外不少学者从不同角度研究二者的生物学特征的差异性。流行病学分析显示,世界范围内RCC发病率呈升高趋势,LCC发病率呈下降趋势[5]。临床病理及预后方面二者存在明显差异性,RCC中晚期预后比LCC更差[6-9]。
本研究联合检测KRAS和VEGF两个与肿瘤发生、发展和转移密切相关的基因,结合临床病理特点,旨在从临床、病理、基因多个层面探讨LCC、RCC的生物学特性差异性及其原因。本研究结果显示,>60岁患者RCC与LCC比例高;RCC原发肿瘤较左侧大,低分化、脉管侵犯、神经侵犯及合并肝转移比例均较LCC高(P<0.05)。LCC、RCC组患者总5年生存率分别为71.61%、59.53%,两组比较差异有统计学意义(P<0.05)。在临床、病理及预后方面二者存在差异性与上述文献报道相似。推测出现上述差异性的解剖因素:右半结肠由肠系膜上动脉供血,经肠系膜上静脉回流入肝。右半结肠管径较大,管腔壁较薄故而弹性好,其内容物水分较多。左半结肠则由肠系膜下动脉供血,经肠系膜下静脉回流入肝。左半结肠因肠道狭小且壁厚,水分逐渐被大部分吸收,粪便形成。右半结肠动脉弓血供相对左半结肠丰富,有利于肿瘤构建自身丰富的微循环,因此肿瘤生长较快,生长的空间相对较大,所以临床发现相对较晚。由于右半结肠静脉丛丰富且回流距离肝脏相对较近,更容易出现肝转移,因此,初诊时RCC发现较晚,合并肝转移比例相对较高,从而导致预后相对较差。
在基因层面,微卫星不稳定性(MSI)是DNA错构修复基因突变或失活。多见于LCC,启动区域CpG岛甲基化导致的遗传改变多见于RCC[10-11]。曾亮等[12]研究发现LCC与LCC癌旁的差异基因共有389个,而RCC和RCC癌旁的差异基因共有103个,这些基因可能与结肠癌的发生和发展有关,进一步从基因水平揭示LCC、RCC的生物学特性不同。KRAS基因是EGFR信号通路上的重要靶点,抗EGFR单克隆抗体治疗的疗效与其密切相关,只有野生型方可获益[13]。KRAS基因结直肠癌中突变率较高,与肿瘤发生、发展有关[14]。RUI等[15]认为KRAS基因与肿瘤分化程度和部位等无关。然而FRIEDRICH等[16]研究提示,KRAS基因的突变与RCC高分化程度、黏液化成分及低淋巴结转移率相关。VEGF在肿瘤形成、生长和转移中起重要作用,其表达受许多信号通路的调节,同时取决于细胞的环境[17]。林冰等[18]认为VEGF在转移性结肠癌中呈现高表达,与分期分化程度无关。
本研究显示,RCC的KRAS基因突变率较LCC高(P<0.01)。初诊时合并神经周围侵犯及肝转移的LCC、RCC患者KRAS基因突变率比较,差异均无统计学意义(P>0.05),其余研究因子组间比较均存在明显差异,RCC组高于LCC组(P<0.05)。KRAS基因突变与性别、肿瘤部位、分化程度、分期、脉管侵犯等因素有关。RCC的VEGF阳性表达率、原发肿瘤大于5 cm、合并脉管侵犯和肝转移阳性率均高于LCC(P<0.05),提示该基因可能与结肠癌肝转移有一定关系,RCC更容易发生肝转移,可能是RCC初诊时肝转移率较高原因之一。KRAS基因第13位密码子突变与结直肠癌发生同时性肝转移及局部转移相关,在结肠癌病理过程中,肠黏膜上形成大量新生血管,VEGF因其具有促进细胞增殖、促进血管生成的功能,在肿瘤的发生、发展及转移中具有重要作用[19-20],从而可以解释文献报道RCC患者对抗VEGF治疗的贝伐单抗治疗优于LCC的原因[21]。
本研究进行Logistic多因素回归分析显示,肿瘤部位、大小、分化程度、脉管侵犯、KRAS基因突变率和VEGF阳性表达率均是结肠癌肝转移的危险因素。
综上所述,LCC、RCC二者在临床、病理、基因及预后等多方面的生物学特性均存在较大差异性,解剖因素、KRAS基因和VEGF的差异性表达可能是影响其临床病理和预后等不同的重要因素。本研究认为将二者视为不同病种研究治疗更符合精准医疗原则。KRAS基因突变率和VEGF阳性表达率均是影响结肠癌肝转移的危险因素。

