孤独症谱系障碍患儿脑白质异常的弥散张量成像观察
刘洋,张通
1.首都医科大学康复医学院,北京市100068;2.中国康复研究中心北京博爱医院,北京市100068
目的 探讨孤独症谱系障碍(ASD)患儿与正常儿童脑白质连接的差异。
方法 2017年9月至2018年7月,选取ASD患儿10例(ASD组)和正常儿童10例(对照组)。ASD组采用Gesell发展量表(GDS)评定发育商,并采用孤独症儿童心理教育评核第3版(PEP-3)进行评定。所有儿童均行MRI弥散张量成像(DTI)扫描,比较两组各向异性分数(FA)、轴向弥散系数(AD)、径向弥散系数(RD)和平均弥散系数(MD)差异;以及ASD组临床量表评分与DTI各参数行相关性分析。
结果 与对照组相比,ASD组左侧小脑中脚、左侧胼胝体体部、左侧内囊后肢、双侧放射冠和双侧上纵束FA降低,左侧小脑中脚、左侧胼胝体体部及压部、双侧放射冠和双侧上纵束RD增高。智龄与左侧小脑中脚FA呈正相关(r=0.686,P<0.05),发育商与左侧放射冠(r=0.720,P<0.05)和左侧胼胝体压部(r=0.744,P<0.05)FA呈正相关,语言表达(r=0.711,P<0.05)和语言理解(r=0.754,P<0.05)与左侧胼胝体体部FA呈正相关,精细运动与左侧小脑中脚FA呈正相关(r=0.723,P<0.05),情感表达与左侧胼胝体体部RD呈负相关(r=-0.902,P<0.05)。
结论 ASD患儿脑白质发育异常,且与智力、发育和临床表现相关。
根据美国精神疾病诊断和统计手册第5版(Diagnostic and Statistical Manual of Mental Disorders,DSM-Ⅴ)的分类标准,孤独症谱系障碍(autism spectrum disorder,ASD)主要表现为两大功能障碍,即持续的相互社会沟通和社会交往损害,以及限制性、重复的行为模式,并在儿童发育早期出现。美国疾病预防和控制中心报道,2006年美国0~8岁儿童ASD患病率为1/110,2008年上升为1/88,2012年为1/68,2018年为1/59[1]。2015年美国3~17岁儿童ASD患病率达1/45[2]。
在我国,随着诊断标准的规范与研究的深入,ASD在中国经历了由罕见病到流行病的转变。2006年第二次全国残疾人抽样调查报告中,0~6岁ASD患病率为4.06/10000(约合1/2463),2015年已上升为1/244[3]。国内专家共识,中国孤独症患病率和世界其他国家相似,约为1%,孤独症患者已超1000万,0~14岁儿童患者达200余万。
由于ASD疾病本身的复杂性,国内外研究仍未明确其病因和发病机制,对ASD的治疗尚无权威指南。
弥散张量成像(diffusion tensor imaging,DTI)研究显示,ASD患者颅内白质微观结构改变,白质结构连接异常,且这种异常可能与ASD的核心症状有关。各向异性分数(fractional anisotropy,FA)是分子位移程度或方向变化的衍生量度[4],常被用于DTI的研究。大多数研究表明,与对照组相比,ASD组FA降低[5-8];也有部分学者发现FA增加[9-10]。Meta分析显示,ASD组较对照组FA降低主要集中在两个区域,即左侧胼胝体膝部和右侧大脑脚,该区域异常可能与ASD患儿某些特殊症状有关[11]。上述研究选取的研究对象均为18岁左右青年ASD患者,且均为欧美人群。本研究以3~6岁低龄ASD国内患儿为对象,观察我国低龄ASD患儿的颅内影像学特征。
1 资料与方法
1.1 一般资料
选取2017年9月至2018年7月在北京博爱医院自闭症治疗中心就诊的ASD患儿为ASD组,均符合DSM-Ⅴ关于ASD的诊断标准。
纳入标准:①年龄3~6岁;②右利手;③无接受MRI检查禁忌症;④患者及家属知情同意并签署知情同意书。
排除标准:①既往有癫痫发作史;②有明确的颅脑外伤史;③有神经系统疾病或严重躯体疾病史。
同期在北京市范围内向社会募集健康儿童志愿者为对照组。纳入标准:①年龄3~6岁;②右利手;③出生前后发育无异常,否认神经精神系统疾病及脑外伤等可能影响儿童正常发育的病史,智商>90分。
本研究经中国康复研究中心伦理委员会审批(审批号2018B004)。所有入组志愿者均由其法定监护人签署知情同意书。
剔除、脱落标准:①MRI过程中出现头动等影响数据准确性的情况;②不能耐受MRI检查过程;③临床医师评定不适宜继续接受实验。
经筛查后,共纳入ASD组10例,对照组10例。两组年龄、性别无显著性差异(P>0.05),智龄和发育商有显著性差异(P<0.05)。见表1。
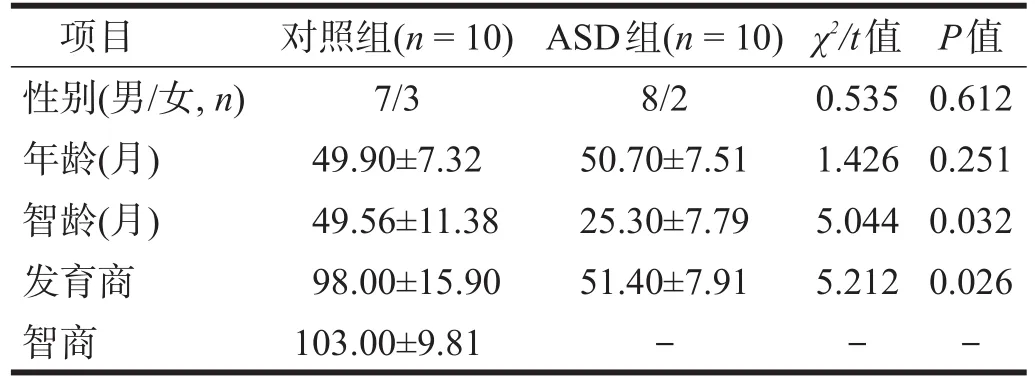
表1 两组一般情况比较
1.2 方法
1.2.1 一般情况问卷
采用自编一般家庭情况表了解所有受试者的一般情况,包括患儿姓名,出生日期,父母生育年龄,是否为第一胎,孕期及生育过程中有无异常,父母学历、职业,性格特征及家族史。
1.2.2 临床评定
两组均采用Gesell发展量表(Gesell Developmental Schedules,GDS),ASD组采用孤独症儿童心理教育评核第3版(Psychoeducational Profile-Third Edition,PEP-3)进行评定。
GDS从动作、顺应、言语和社会应答4个方面进行评定[12],最终形成发育商和智龄。
PEP-3于1979年由Schopler和Reichler开发,后经多次改版,最新版在2005年发布并被引入中国。该量表包括10项发展与行为检测,包括认知(语言/语前)、语言表达、语言理解、精细运动、粗大运动、模仿(视觉/动作)、情感表达、社交互动、行为特征-非语言和行为特征-语言,以及3项儿童照顾者报告测验,包括问题行为、个人自理和适应行为,最终形成合成分数,从沟通、体能和行为3个方面评价ASD患儿的障碍特点,用于指导临床训练[13-14]。
1.2.3 DTI
采用Philips Ingenia 3.0 T超导磁共振仪,使用鸟笼式头部正交线圈,海绵垫固定受试者头部。受试者予10%水合氯醛口服,最大剂量不超过10 ml,入睡后进行扫描。先行头部矢状位T1WI、T2WI扫描解剖定位,排除明显的神经系统器质性疾病,扫描参数如下。①T1序列:体素1×1×1 mm,脉冲间隔时间2530 ms,回波时间3.45 ms,层厚1.00 mm,反转角7°,返回时间1100 ms,扫描视野256×256 mm,矩阵256×192,扫描时间299 s。②DTI:扫描层面平行于胼胝体膝部与压部的连线,从头顶到小脑下部,共192层;平面回波序列,体素2×2×2 mm,弥散敏感系数b值1000 s/mm2,弥散敏感梯度方向64个,采集矩阵128×128,扫描视野256×256 mm,层厚2 mm,重复时间6100 ms,回波时间93 ms,翻转角90°,扫描时间766 s,每次扫描75层。
DTI数据分析采用FSL(FMRIB Software Library,http://www.finrib.OX.ae.Uk/fsl)软件的工具包进行。将原始DICOM数据转换成Nifli格式;B0像提取,去除非脑组织结构;以B0为标准进行矫正;梯度方向矫正;张量计算,得出FA、轴向弥散系数(axial diffusivity,AD)、径向弥散系数(radial diffusivity,RD)、平均弥散系数(mean diffusivity,MD)。
通过基于纤维束追踪的空间统计(tract-based spatial statistics,TBSS)[15]算法,将FA利用线性和非线性配准到1×1×1 mm MIN152标准空间,并基于所有配准到标准空间的FA构建FA图及白质骨架,将平均FA骨架阈值取0.2。同法处理AD、RD和MD值。
应用随机化置换程序对统计资料进行分析。该程序基于非参数随机排列检验(randomized permutation test,RPT)对两组间FA、AD、RD、MD进行多重比较,以年龄和性别作为协变量,经5000次无阈值簇群增强(threshold-free cluster enhancement,TFCE)置换,将P值阈值校正为<0.05,从而得出具有统计学差异的区域[16]。由于本研究样本量较小,可能存在假阳性区域,故在上述区域中再筛选体素>500的区域。
将TBSS生成的具有统计学差异的白质区域叠加到标准化后的平均FA图及平均FA骨架上,生成伪彩图。颅内组织结构定位应用MNI structural atlas结构模板,脑白质解剖定位应用Johns Hopkins University(JHU)DTI-based white matter atlases白质模板进行分析。
1.3 统计学分析
采用SPSS 20.0软件对数据进行统计学分析。计量资料以(±s)表示,组间比较采用独立样本t检验和置换检验。计量资料行χ2检验。DTI参数量表分之间行偏相关分析。显著性水平α=0.05。
2 结果
2.1 DTI参数比较
与对照组相比,ASD组左侧小脑中脚、左侧胼胝体体部、左侧内囊后肢、双侧放射冠和双侧上纵束FA降低,左侧小脑中脚、左侧胼胝体体部及压部、双侧放射冠和双侧上纵束RD增高;未见FA增高和RD降低区域,MD和AD两组间无显著性差异。见图1、表2。
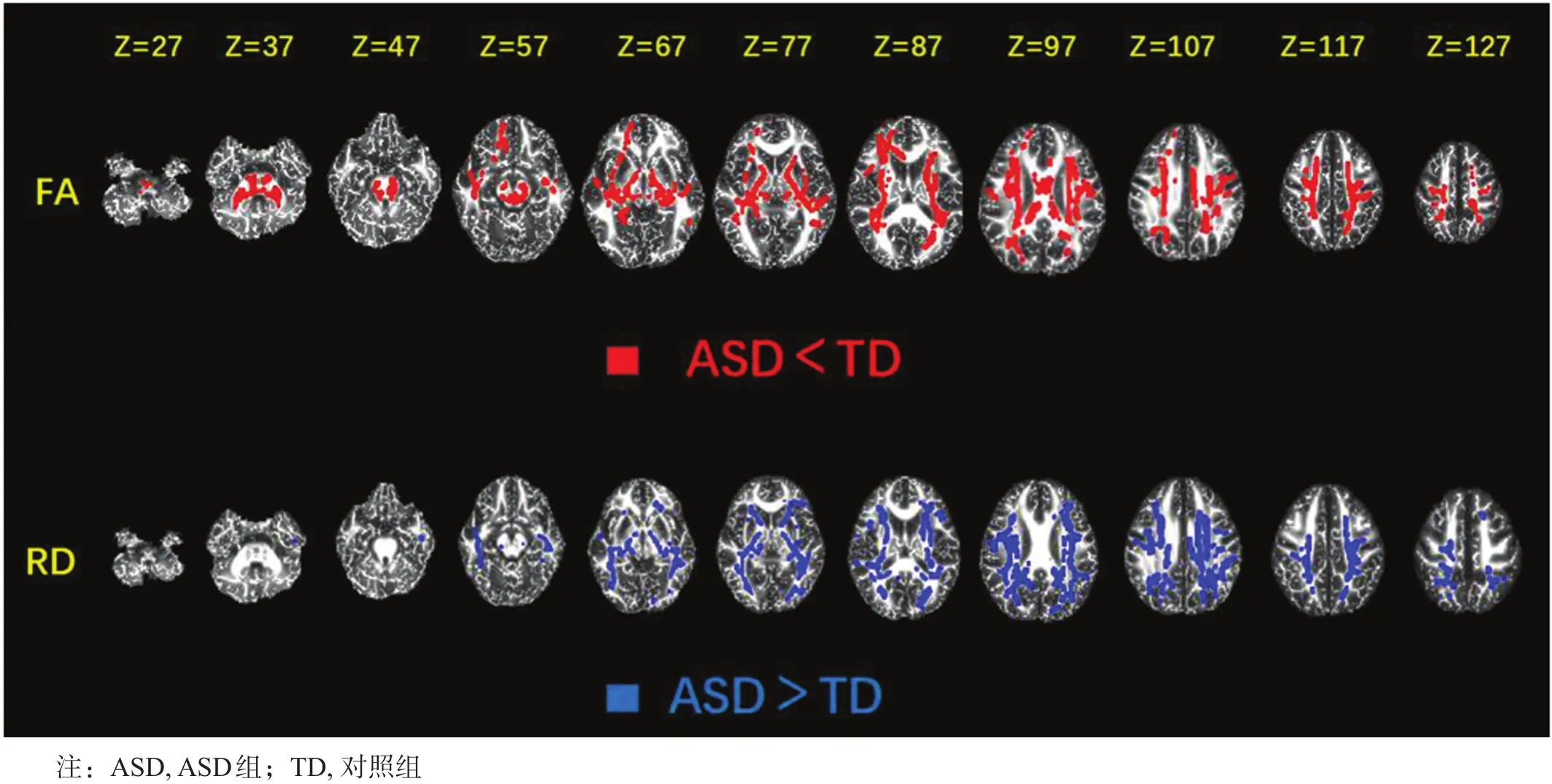
图1 两组间有显著性差异的区域
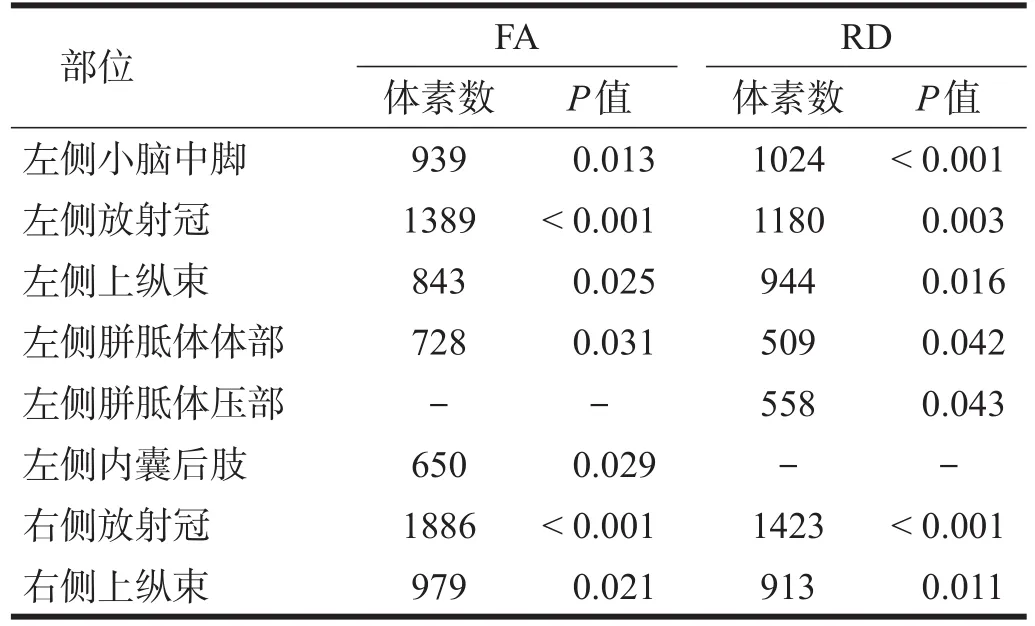
表2 两组FA与RD比较
2.2 相关性分析
将两组间有显著性差异区域的FA和RD,与年龄、智龄、发育商以及PEP-3各项目分进行相关性分析,年龄与各区域FA相关性无统计学意义;智龄与左侧小脑中脚FA呈正相关(r=0.686,P=0.041);发育商与左侧放射冠(r=0.720,P=0.044)和左侧胼胝体压部(r=0.744,P=0.022)FA呈正相关。年龄、智龄和发育商与各区域RD均无相关性。
语言表达(r=0.711,P=0.048)和语言理解(r=0.754,P=0.031)与左侧胼胝体体部FA呈正相关,精细运动与左侧小脑中脚FA呈正相关(r=0.723,P=0.043),情感表达左侧胼胝体体部RD呈负相关(r=-0.902,P=0.01)。
3 讨论
DTI采用水分子弥散各向异性进行成像,可在活体显示纤维束的方向及完整性,反映活体组织的空间组成及病理状态下各组织间水分子交换状况。采用TBSS处理方法,可观察全脑范围内白质异常情况,相比于传统的感兴趣区观察法,无需手工勾画特定脑区,减少主观误差,具有更强的准确性与可重复性[17];相比基于体素的分析方法,可免去图像标准化后进行高斯平滑处理,避免图像配准不精确和平滑所带来的问题,提高数据分析的准确性[18]。采用TBSS分析DTI数据比较ASD患儿与正常儿童脑白质的差异,能准确、可重复地从全脑层面全面分析数据差异,保证研究的客观性。
FA、RD、AD和MD均为DTI常用观察指标。FA是水分子各向异性成分占整个弥散张量的比例,0代表弥散不受限制,如脑脊液中FA接近0,而大脑白质纤维FA接近1。普遍认为FA发生改变可反映脑白质纤维发育程度,越接近1,分化程度越好[19]。本研究显示,与对照组相比,ASD组FA在左侧小脑中脚、左侧胼胝体体部、左侧内囊后肢、双侧放射冠和双侧上纵束降低,与之前研究相同[5-8]。FA降低提示髓鞘分化不良或白质脱髓鞘,ASD组FA降低提示脑白质发育不良。
RD反映径向弥散系数,即垂直于白质纤维走形方向弥散速度与效率。由于纤维髓鞘减少,纤维间水分子扩散能力增强,RD增高区域与FA降低区域基本吻合。
本研究显示,在控制性别与利手情况下,仅智龄和发育商与部分区域FA相关,但年龄与各区域FA和RD均无关,这与之前研究显示年龄同FA呈正相关[20]或负相关[21]不尽相同。原因可能为本研究对象年龄较小,而其他研究多为18岁左右成年高功能ASD患者,年龄并不能很好反映受试者真实的智力发育水平。本研究两组年龄均为50个月左右,并无显著性差异,但其智龄和发育商却有显著性差异。智龄和发育商越高,FA越大,白质纤维分化程度越好,符合儿童发展规律。因此,对小龄低功能ASD患儿,相比于生理年龄,智龄与发育商更能体现儿童智力发育水平,且与颅内脑白质发育水平存在相关性。
胼胝体位于大脑半球纵裂的底部,连接左右大脑半球,是大脑中最大的连合纤维,脑皮质70%~80%信息通过胼胝体联系。Travers等[22]发现,10岁前ASD患儿胼胝体发育异常。其他研究也发现,ASD患儿胼胝体区脑白质发育异常[23-24],这种异常可能与双侧大脑半球间联系异常有关[25-28],而纤维束的密度与大小对控制双侧大脑半球间信息的传导十分重要[29]。本研究在控制年龄、智龄、发育商、性别和利手后,偏相关分析显示,左侧胼胝体体部FA和RD与PEP-3许多项目相关,证明胼胝体区在ASD发病中可能扮演重要角色,值得进一步研究。
本研究显示,左侧小脑中脚FA与精细运动相关。之前研究显示,小脑中脚作为小脑脚最粗的一根神经纤维,连接小脑与脑桥,主要负责小脑信息的传入,对身体平衡觉、精细运动进行调控。小脑脚与ASD患儿运动功能障碍有关[30-31],且这种障碍与小脑脚FA正相关[30,32]或负相关[31]。ASD患儿常伴有精细或粗大运动功能障碍,且常有平衡功能障碍。与本研究结果一致。
值得注意的是,尽管经TBSS分析,ASD患儿左、右侧均有FA或RD异常的区域,但经与智龄、发育商和临床量表关联性分析,发现相关区域均在大脑左侧,分析其原因有3点。①本研究样本量小,个体特征对试验结果影响较大。②研究对象均为右利手,左侧大脑为优势半球,因而ASD患儿与正常儿童之间的差异更加明显。③研究对象为3~6岁低龄儿童,右侧大脑形象思维和独自创造能力尚未完全开发。
本研究存在一定不足。首先,经统计学计算本研究样本量需18例,最后收集到20例数据,但仍属小样本量研究,还有待进一步扩大样本量。其次,本研究为横断面研究,并未进行后续随访,进一步应对ASD患儿进行定期MRI及临床量表复查,以获得ASD患儿脑发育曲线,为之后进一步进行病因学和发病学研究做准备。

