雷公藤甲素对大鼠坐骨神经冷保存后细胞活性及异体移植后神经再生的影响
汪一,黄英如,张松,李子健,曾欢欢,冼华
重庆医科大学中医药学院,中医药防治代谢性疾病重庆市重点实验室,重庆市400016
目的 探讨雷公藤甲素(T10)对冷保存大鼠坐骨神经生物活性和异体移植后神经再生的影响。
方法 取对数生长期施万细胞(SCs),CCK-8检测1×10-6mol/L、1×10-7mol/L、1×10-8mol/L、1×10-9mol/L T10溶液对SCs增殖的影响。取Sprague-Dawley大鼠双侧坐骨神经15 mm,分别在含0 mol/L、1×10-6mol/L、1×10-7mol/L、1×10-8mol/L、1×10-9mol/L T10的DMEM液中,4℃或37℃ 放置24 h(n=6),Western blotting检测神经生长因子(NGF)、神经胶质细胞源性神经营养因子(GDNF)、脑源性神经营养因子(BDNF)表达。另取大鼠坐骨神经15 mm,随机分成新鲜神经组(A组,n=30)、DMEM保存组(B组,n=30)、T10保存组(C组,n=30)、T10预处理后DMEM保存组(D组,n=30)、T10预处理后T10保存组(E组,n=30),4℃保存4周,Calcein-AM/PI双染激光共聚焦显微镜观察、流式细胞术检测神经活细胞、死细胞数,Western blotting检测主要组织相容性复合体-Ⅰ(MHC-Ⅰ)、MHC-Ⅱ、细胞间黏附分子-1(ICAM-1)表达。用上述坐骨神经修复Wistar大鼠坐骨神经10 mm缺损(A′组、B′组、C′组、D′组、E′组,n=10),设立同系移植新鲜组(F′组,n=10)。术后16周,电生理检测肌肉复合动作电位(CMAP)和运动神经传导速度(MNCV);取移植段神经,观察神经纤维数和神经超微结构。
结果 SCs在浓度为1×10-9~1×10-7mol/L T10溶液下,细胞增殖与对照组无显著性差异(P>0.05)。各浓度T10溶液下,大鼠坐骨神经各神经营养因子表达均37℃明显高于4℃;相同温度时,1×10-8mol/L组各神经营养因子表达均高于其他浓度组(P<0.05)。大鼠坐骨神经冷保存4周后,与B、C、D组相比,E组神经活细胞数量多,MHC-I、MHC-II、ICAM-1表达降低(P<0.05)。移植术后16周,E′组CMAP、MNCV、再生有髓神经纤维数量均优于A′、B′、C′、D′组(P<0.05),E′、F′组有髓神经纤维数量多,粗细均匀,分布广泛,髓鞘厚。
结论 一定浓度T10体外能诱导大鼠坐骨神经神经营养因子表达,提高冷保存神经生物活性,降低免疫原性,促进异体移植后受体神经再生;冷保存前用一定浓度T10预处理效果更好。
自体神经移植作为周围神经缺损,尤其是长段神经缺损的主要治疗手段,因来源有限和造成新的神经缺损等隐患,制约了其临床应用。同种异体神经具有与自体神经相同的组织结构,可能是自体神经最好的替代物[1-2]。实现同种异体神经的临床化应用,成功的体外保存是基础。周围神经的体外保存面临缺血、缺氧和低温环境,会造成组织细胞损伤,导致周围神经的施万细胞(Schwann cells,SCs)失去活性甚至死亡;而SCs是周围神经的主要结构和功能细胞,能分泌多种神经营养因子和黏附分子,对神经损伤后轴突再生极为重要[3-4]。维持SCs的生物活性是周围神经体外保存的关键。
雷公藤甲素(triptolide,T10)是我国传统中药雷公藤的主要药理活性成分之一,具有抗炎和免疫抑制等作用[5-6]。T10可保护PC12细胞免受氧化应激引起的细胞损伤和凋亡,具有保护神经元、改善神经功能的作用[7-9];还能促进神经胶质细胞合成和分泌多种神经营养因子[10]。本研究观察T10对低温保存大鼠坐骨神经生物活性和异体移植后受体神经再生的影响,以提高周围神经低温保存的成功率。
1 材料与方法
1.1 实验细胞和动物
大鼠SCs株(RSC96细胞株):中国科学院典型培养物保藏委员会细胞库,目录号GNR 6。
SPF级雌性Sprague-Dawley大鼠300只,体质量(200±20)g,重庆医科大学动物中心提供,动物生产许可证号SCXK(渝)2012-0001。Wistar雌性大鼠60只,体质量(200±20)g,成都达硕实验动物有限公司提供,动物生产许可证号SCXK(川)2015-030。动物实验均根据《医学实验动物管理实施细则》的要求,依照动物福利与伦理原则处理。12 h明暗交替,相对湿度65%~75%,室温22~24℃。
1.2 试剂与仪器
T10:上海Aladdin公司。胎牛血清(fetal bovine serum,FBS)、DMSO、0.25%胰酶、Ⅱ型胶原酶、低糖型DMEM培养基、DMEM/F12培养基:美国HYCLONE公司。RPMI1640培养基:美国GIBCO公司。青霉素-链霉素双抗:上海碧云天生物技术有限公司。神经生长因子(nerve growth factor,NGF)、神经胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、主要组织相容性复合体-Ⅰ(major histocompatibility complex-Ⅰ,MHC-Ⅰ)、MHC-Ⅱ、细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)单克隆抗体:美国SANTACRUZ公司。β-actin:武汉中杉金桥生物技术有限公司。山羊抗兔IgG二抗、山羊抗鼠IgG二抗:北京中杉金桥生物技术有限公司。CCK-8:日本DOJINDO公司。tritonX-100:北京鼎国昌盛生物技术有限责任公司。Calcein-AM:日本东仁化学科技有限公司。碘化丙啶(propidium iodide,PI):上海前尘生物科技有限公司。FITC-Annexin V凋亡检测试剂盒Ⅰ:美国BD BIOSCIENCES公司。蛋白抽提试剂盒、SDS-PAGE凝胶制备试剂盒、BCA蛋白浓度测定试剂盒:碧云天生物技术研究所。
EPICS-XL型流式细胞仪:美国BECKMANCOULTER公司。LEICA TCS SP2激光扫描共聚焦显微镜:德国LEICA公司。蛋白质垂直电泳槽、稳压稳流电泳仪、图像分析软件:美国BIO-RAD公司。VICTOR3酶标仪、Geliance 200凝胶成像系统:美国PERKENELMER公司。低温高速离心机:德国SIGMA公司。H-7500透射电镜:日本HITACHI公司。
1.3 方法
1.3.1 T10冷保存大鼠坐骨神经的适宜浓度
1.3.1.1 对SCs毒性
取处于对数生长期SCs,0.25%胰蛋白酶消化成单细胞悬液,半径6 cm、1000 r/min离心5 min后弃上清,用含10%FBS的DMEM/F12培养基调整细胞浓度为 1×104/ml,接种于 96 孔板中,每孔 200 μl,37℃、5%CO2培养箱继续培养。细胞贴壁后用无血清培养基培养24 h。弃上清,加入含T10 1×10-6mol/L、1×10-7mol/L、1×10-8mol/L、1×10-9mol/L的DMEM溶液(含10%FBS、4%DMSO、1%青-链双抗),每孔200 μl;对照组加等量DMEM溶液,并设置加入等量蒸馏水的无细胞空白组。每组设5个复孔。37℃、5%CO2培养24 h。终止培养前2 h,每孔加CCK-8试剂20 μl。酶标仪450 nm波长下检测各孔吸光度(A);计算各组细胞存活率:

重复3次。
1.3.1.2 坐骨神经神经营养因子分泌
Sprague-Dawley大鼠适应性喂养5 d后,空腹24 h,SPF动物房无菌操作台上消毒后铺巾,10%水合氯醛4 ml/kg腹腔注射麻醉,于梨状肌下缘5 mm处截取大鼠双侧坐骨神经各约15 mm,生理盐水冲洗。随机数字表法将大鼠坐骨神经浸在含T10 0 mol/L、1×10-6mol/L、1×10-7mol/L、1×10-8mol/L、1×10-9mol/L的DMEM溶液中,4℃或37℃、5%CO2细胞培养箱预处理24 h(n=6)。Western blotting检测NGF、GDNF和BDNF蛋白表达。
取神经组织约30 mg,10 ml/kg加入裂解液,匀浆,静置1 h;12000 r/min离心15 min,取上清,BCA法检测蛋白浓度。SDS-PAGE电泳,转移至PVDF膜,5%脱脂牛奶室温封闭2 h,TBST洗膜,加一 抗 (NGF 1∶ 1000、 GDNF 1∶ 1000、 BDNF 1∶2000、GAPDH 1∶5000)4℃孵育过夜;TBST洗膜,加山羊抗兔IgG二抗,室温孵育60 min,TBST洗膜,ECL显色。Image J软件处理,以GAPDH为内参,计算目的蛋白与GAPDH的灰度比。生物学重复6次。
1.3.2 坐骨神经冷保存
同法另取SPF级雌性Sprague-Dawley大鼠坐骨神经15 mm,随机数字表法分成5组(n=30)。A组不进行任何处理;B组在DMEM溶液中4℃保存4周;C组在含1×10-8mol/L T10的DMEM溶液中4℃保存4周;D组在含有1×10-8mol/L T10的DMEM溶液中,37℃、5%CO2预处理24 h,然后在DMEM溶液中4℃保存4周;E组在含有1×10-8mol/L T10的DMEM溶液中,37℃、5%CO2预处理24 h,然后在含1×10-8mol/LT10的DMEM溶液中4℃保存4周。
1.3.2.1 坐骨神经活性
取各组坐骨神经各4条(A组检测时取材,下同),修剪成2 mm,浸入1%tritonX-100中通透30 min,PBS冲洗;室温Calcein-AM 20 μmol/L孵育30 min,PBS洗涤;PI 50 mg/L染色15 min,PBS洗涤;防荧光淬灭剂封片。激光共聚焦显微镜观察,激发波长490 nm和535 nm,活细胞呈绿色荧光,死细胞呈红色荧光。观察荧光强度。
将坐骨神经置含10%胎牛血清的PBS中,加入Ⅱ型胶原酶,37℃振荡1 h;置不含胎牛血清的RPMI1640培养基的平皿中,洗涤、剪切后研碎,200目过滤,制成单个细胞悬液,4℃、半径6 cm、1000 r/min离心5 min。细胞37℃、5%CO2培养箱中培养6 h,收集细胞,洗涤,根据Annexin V FITC/PI试剂盒说明染色,EPICS-XL流式细胞仪检测。
1.3.2.2 免疫原性
按照1.3.1.2方法,检测各组MHC-Ⅰ、MHC-Ⅱ和ICAM-1表达,以β-actin为内参。
1.3.3 同种异体移植效果
雌性Wistar大鼠60只,10%水合氯醛4 ml/kg腹腔注射麻醉,右股后外侧纵行切口,钝性分离,游离坐骨神经,距梨状肌下缘5 mm处整齐切除坐骨神经10 mm。分别取A、B、C、D和E组神经,修剪成10 mm,手术显微镜下,9-0线行神经外膜无张力间断缝合4~6针(A′组、B′组、C′组、D′组、E′组,n=10)。逐层关闭切口。手术由同一人操作,术后不做特殊处理。
SPF级Wistar雄性大鼠5只,同法取坐骨神经10条,修复Wistar雌性大鼠坐骨神经10 mm缺损组(F′组,n=10)。
观察术后大鼠精神状态、饮食、伤口愈合、溃疡发生情况。
1.3.3.1 神经电生理检测
移植术后16周,大鼠10%水合氯醛4 ml/kg腹腔注射麻醉,原切口暴露坐骨神经。观察移植神经段粗细、与周围组织粘连情况等。刺激电极置梨状肌下缘3 mm处神经干,接收电极置外踝上10 mm腓肠肌中部,地线远离两电极,刺激强度1 V,间歇0.25 ms。BL-420F系统测定肌肉复合动作电位(compound muscle action potential,CMAP)和神经传导速度(never conduction velocity,NCV)。
1.3.3.2 组织学观察
电生理检测后,整齐截取移植神经中段3 mm,2.5%戊二醛4℃固定过夜,1%锇酸固定2 h,丙酮梯度脱水,环氧树脂包埋。0.5 μm半薄切片,甲苯胺蓝染色,每个样本随机选5张切片,每张切片随机取5个视野,CCD光谱测量系统观察,Image-Pro Plus 6.0图像分析软件计数有髓神经纤维数目。超薄切片,醋酸铀-柠檬酸铅双重染色,透射电镜观察神经超微结构,计算有髓神经纤维髓鞘厚度与神经纤维直径的比。
1.4 统计学分析
采用SPSS 22.0统计软件进行数据分析。实验数据均以(±s)表示,组间比较采用单因素方差分析,两两比较采用q检验。显著性水平α=0.05。
2 结果
2.1 T10冷保存大鼠坐骨神经的适宜浓度
2.1.1 对SCs毒性
T10浓度为1×10-6mol/L时,SCs存活率下降(P<0.05)。其他浓度下,SCs存活率与对照组无显著性差异(P>0.05)。见表1。

表1 不同浓度T10下SCs存活率比较(%)
2.1.2 坐骨神经神经营养因子分泌
各组均可检测出NGF、BDNF、GDNF蛋白表达。37℃预处理各组,NGF、BDNF、GDNF蛋白表达均高于4℃预处理各组(P<0.05)。
4℃预处理时,NGF表达在1×10-8mol/L T10组最高(P < 0.05);GDNF表达1×10-8mol/L T10组、1×10-9mol/L T10组最高(P <0.05);BDNF表达1×10-8mol/L T10组、1×10-9mol/LT10组最高,1×10-7mol/LT10组次之(P<0.05)。
37℃预处理时,NGF表达在1×10-8mol/L T10组最高(P < 0.05);GDNF表达1×10-8mol/L T10组、1×10-9mol/L T10组最高,1×10-6mol/L T10组、1×10-7mol/L T10组次之(P<0.05);BDNF表达,1×10-7mol/L T10组、1×10-8mol/L T10组最高,1×10-9mol/L T10组次之,1×10-6mol/L T10组高于对照组(P<0.05)。
见图1、表2。
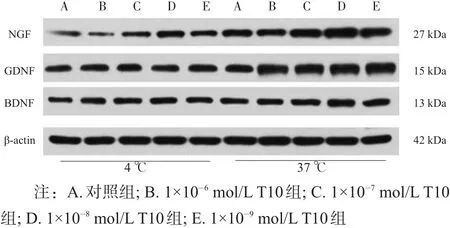
图1 不同温度、浓度T10预处理坐骨神经各神经营养因子蛋白表达
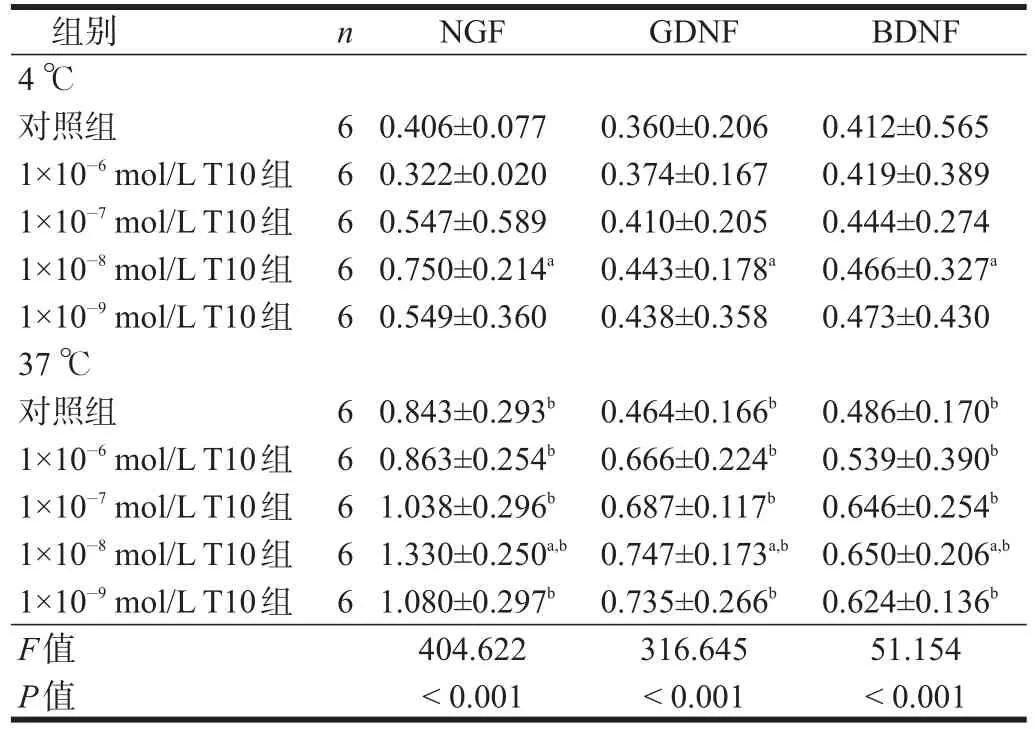
表2 不同温度、浓度T10预处理坐骨神经各神经营养因子蛋白表达(/β-actin)
2.2 坐骨神经冷保存
鉴于以上实验提示,1×10-8mol/L T10促神经营养因子分泌最佳,故以下实验均按此浓度添加T10。
2.2.1 MHC-Ⅰ、MHC-Ⅱ和ICAM-1蛋白表达
与A组相比,B、C、D、E组MHC-Ⅰ、MHC-Ⅱ和ICAM-1蛋白表达均下降(P<0.05)。B、C、D、E组中,MHC-Ⅰ表达,E、C组最低,D组次之,B组最高(P<0.05);MHC-Ⅱ、ICAM-1表达,E组最低,C组次之,D组又次之,B组最高(P<0.05)。见图2、表3。
2.2.2 激光共聚焦显微镜观察
A组以绿色荧光为主,可见零星红色荧光分布;B、C、D、E组红色荧光强度较A组增加,绿色荧光强度减少。B、C、D、E组中,E组绿色荧光强度最强,红色荧光强度最低,C、D组次之,B组最差。见图3。
2.2.3 流式细胞仪检测
A组90%以上为活细胞,B、C、D、E组活细胞百分比均较A组降低。B、C、D、E组中,E组活细胞百分比最高,C组次之,B、D组最低(P<0.05)。见图4、表4。
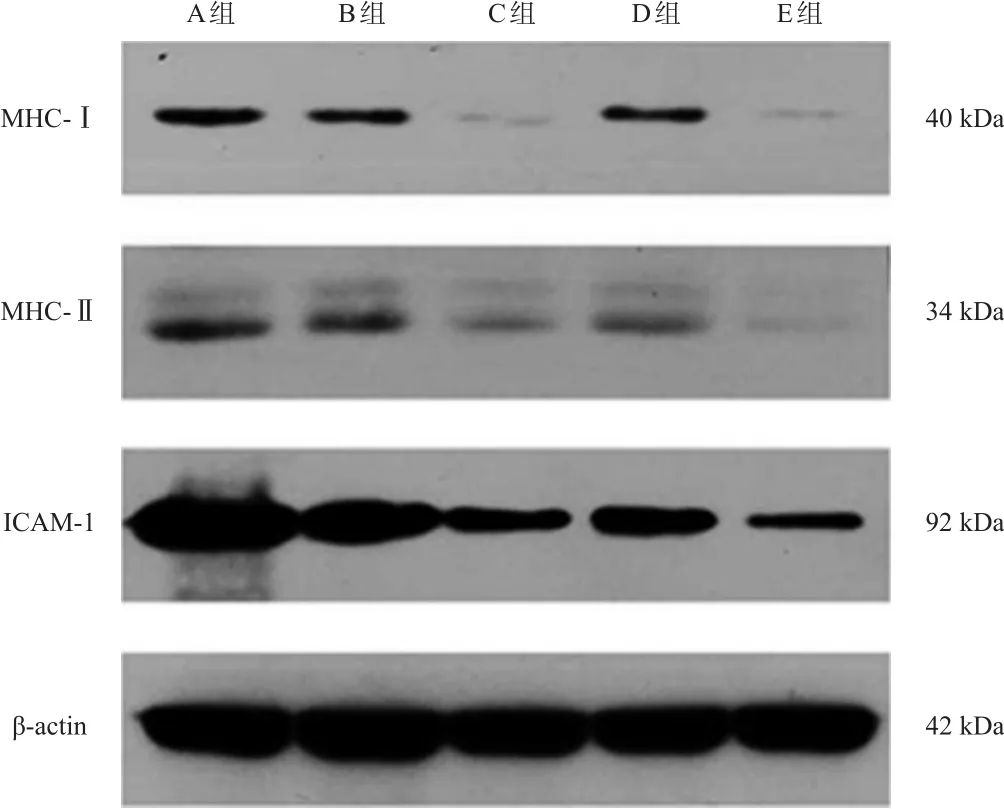
图2 冷保存下各组MHC-Ⅰ、MHC-Ⅱ和ICAM-1蛋白表达
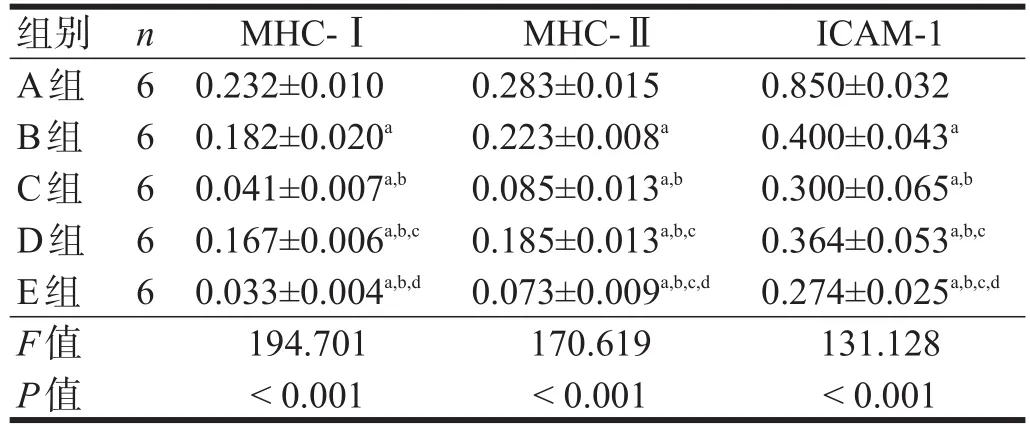
表3 冷保存下各组MHC-Ⅰ、MHC-Ⅱ和ICAM-1蛋白表达(/β-actin)
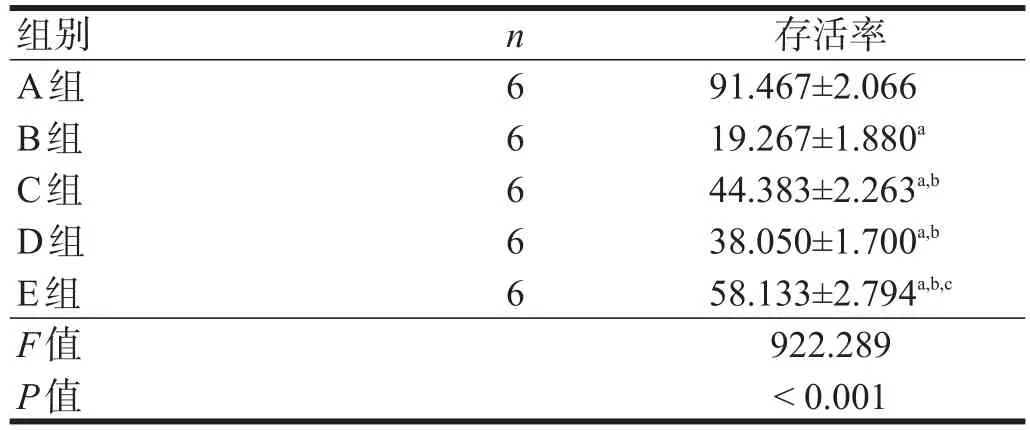
表4 流式细胞仪检测各组存活率(%)
图3 冷保存各组神经细胞存活(免疫荧光染色,bar=50µm)
图4 冷保存各组神经细胞存活和凋亡的流式细胞仪检测
2.3 同种异体移植
2.3.1 一般情况
各组大鼠术后切口均未出现感染,实验期间无大鼠死亡,无足底溃疡、足趾脱落等损害。取材时,发现A′、B′、C′、D′、E′组神经移植段与周围组织轻度粘连,远近吻合口轻微膨大;F′组移植神经与周围组织无明显粘连,远近吻合口无明显膨大。
2.3.2 神经电生理
移植术后16周,各组间CMAP、NCV均有非常高度显著性差异(P<0.001),F′组最高,E′组次之,再次为C′、D′组,A′、B′组最低(P < 0.05)。见表5。(P<0.05)。见图5、表6。
表5 移植术后各组神经电生理检查结果
电镜观察,F′组和E′组可见大量有髓神经纤维,纤维粗细均匀;C′组和D′组再生有髓神经纤维数量较多,分布较广泛;A′组和B′组再生有髓神经纤维数量较少,分布较稀疏,可见明显结蹄组织增生。有髓神经纤髓鞘厚度与神经纤维直径的比,F′组>E′组>C′组 > D′组 >A′组 =B′组(P < 0.05)。见图6、表6。
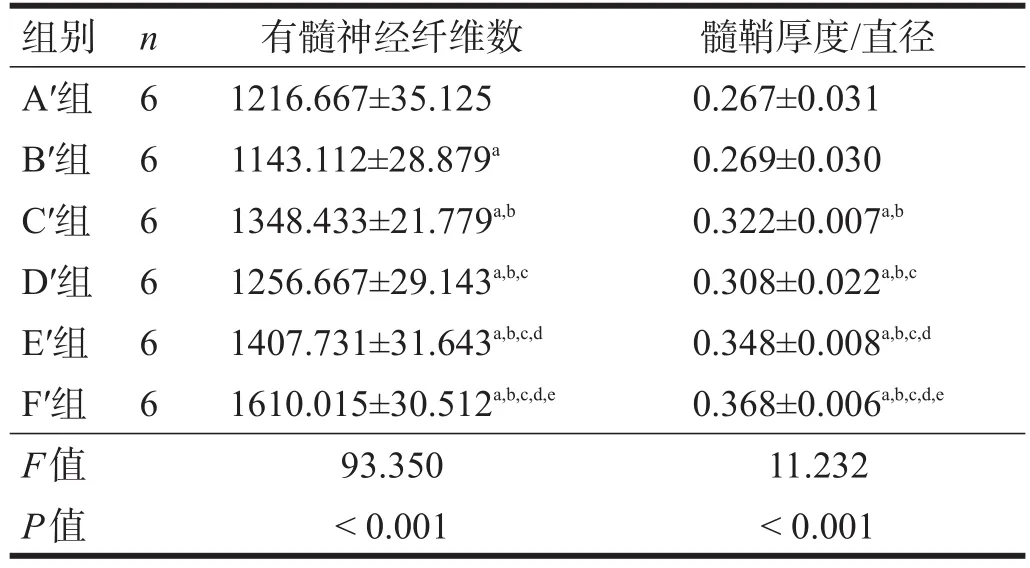
表6 移植术后各组再生神经纤维情况
2.3.3 组织学观察
各组之间有髓神经纤维数有非常高度显著性差异(P < 0.001),F′组 > E′组 > C′组 > D′组 > A′组 > B′组
图5 移植术后16周移植神经中段(甲苯胺蓝染色,bar=50µm)
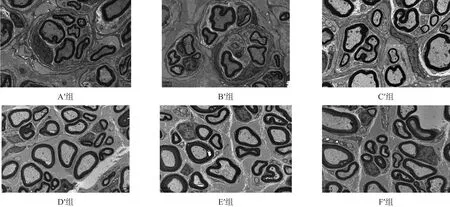
图6 移植术后16周移植神经中段超微结构(透射电镜,bar=10µm)
3 讨论
自体神经移植因来源受限、供区并发症等缺点,不能满足周围神经缺损修复的需要;同种异体神经具备相同的组织结构,且来源丰富,可能是自体神经最佳替代物。与器官移植一样,有效的体外保存成为移植技术的重要限制因素。目前国内外尚无公认的周围神经体外保存方法。
T10是中药雷公藤的主要活性成分之一,具有抗炎、免疫抑制作用。我们在坐骨神经保存液中添加一定浓度T10,希望能对低温保存的坐骨神经发挥保护作用。考虑到T10的毒性,我们先进行SCs细胞毒性试验,结果表明,T10在1×10-9~1×10-7mol/L浓度下,对SCs无明显毒性作用。
T10能促进体外培养的星形胶质细胞分泌神经营养因子[11],而神经营养因子除了促进神经损伤后轴突生长和对新生轴突的导向作用外[12-13],还有营养作用和促神经细胞存活的作用,对周围神经损伤后神经细胞具有保护作用[14-15]。本研究显示,1×10-8mol/L T10溶液37℃预处理24 h,神经营养因子表达最多;T10中冷保存4周后,经上述T10预处理的神经活细胞最多。推测大鼠坐骨神经用一定浓度T10溶液预处理和保存,能对大鼠坐骨神经起到叠加保护作用。
免疫排斥反应是影响同种异体周围神经移植成功的重要因素,理想的体外保存异体神经应在尽量保留神经活性细胞的前提下,降低神经免疫原性。MHC-Ⅰ、MHC-Ⅱ和ICAM-1在移植排斥反应中起重要作用[16-17]:MHC-Ⅰ分子由CD8+细胞毒性T淋巴细胞识别,MHC-Ⅱ分子与CD4+T细胞活化、增殖密切相关,而CD8+、CD4+T细胞是介导同种异体排斥反应的关键细胞;ICAM-1在T细胞黏附、激活及侵入等环节发挥作用[18-20]。雷公藤制剂有抗排斥反应作用[21],在体外能抑制MHC、共刺激分子表达,削弱抗原呈递细胞抗原呈递功能和对T细胞的激活作用[22]。本研究显示,大鼠坐骨神经4℃冷保存4周后,各组MHC-Ⅰ、MHC-Ⅱ和ICAM-1表达均较新鲜神经降低,可能与冷保存后SCs活性下降、凋亡增加有关;而T10冷保存能进一步抑制神经移植物MHC-Ⅰ、MHC-Ⅱ和ICAM-1表达,从而降低异体移植后急性期排斥反应。
本研究用不同方法冷保存的Sprague-Dawley大鼠坐骨神经修复Wistar大鼠坐骨神经缺损,术后16周观察,T10保存、T10预处理的神经,治疗效果较佳;两者合用效果更佳。神经损伤后,随着时间推移,其支配的靶肌肉将发生不可逆萎缩,失去功能,其功能恢复与神经轴突的再生关系密切[23-24]。NCV与神经纤维直径相关,再生纤维传导速度的恢复,很大程度上取决于髓鞘厚度的恢复,髓鞘厚度也是再生纤维成熟程度的反映[25]。本研究显示,T10保存、T10预处理的神经,再生效果良好。这可能由于T10对低温保存的神经组织具有保护作用;同时,T10预处理可通过促进神经组织分泌神经营养因子,提高SCs活性;还能降低免疫原性,从而有利于异体移植后神经轴突再生,促进坐骨神经功能恢复。
综上所述,T10预处理能促进坐骨神经神经营养因子表达;经T10预处理后的坐骨神经,在保存液中添加T10,可提高SCs活性,降低免疫原性,从而减弱移植后排斥反应,促进神经再生及功能恢复。

