黄芪总皂甙对Wnt/β-catenin信号通路及神经干细胞分化的影响
漆国栋,伍亚民,漆伟,刘超智,江琼
1.重庆医科大学中医药学院,中医药防治代谢性疾病重庆市重点实验室,重庆市400016;2.中国人民解放军陆军军医大学附属大坪医院野战外科研究所三室,创伤烧伤与复合伤国家重点实验室,重庆市400042;3.重庆市中医骨科医院,重庆市400010
目的 观察黄芪总皂甙(TSA)调控体外培养大鼠神经干细胞(NSCs)向神经元方向分化的作用及其有效浓度,并研究其Wnt/β-catenin信号通路相关机制。
方法 新生24 h大鼠大脑皮层来源NSCs进行原代、传代培养并鉴定,通过CCK-8试剂盒初筛TSA诱导分化的可能有效浓度。取第三代NSCs,设不加TSA的正常组和不同浓度TSA实验组,分化培养7 d后,间接免疫荧光法和Western blotting检测微管相关蛋白2(MAP-2)和胶质纤维酸性蛋白(GFAP)表达。另设正常组、最佳浓度TSA组、TSA+Wnt/β-catenin信号通路抑制剂ICG-001组和ICG-001组,分化培养7 d后,Western blotting检测各组Wnt3/3a、β-catenin和抗神经原素1(Ngn1)蛋白表达。
结果 TSA在浓度1×10-4mol/L、1×10-5mol/L、1×10-6mol/L时,NSCs数量显著增加(P<0.001)。TSA能增加NSCs分化为神经元的比例,1×10-5mol/L最佳(P<0.05)。TSA能上调Wnt3/3a、β-catenin与Ngn1蛋白的表达(P<0.05)。
结论 TSA能促进体外培养NSCs向神经元方向分化,与激活Wnt/β-catenin信号通路,从而调控该通路下游促分化靶向蛋白Ngn1的表达有关。TSA最佳促神经元方向分化浓度约为1×10-5mol/L。
神经干细胞(neural stem cells,NSCs)作为细胞疗法的重要细胞类型,近些年已广泛应用于多种神经系统病变的基础研究甚至临床治疗,如脑卒中[1]、帕金森病[2]、亨廷顿氏病[3]、脊髓损伤[4]和阿尔茨海默病等[5]。一方面,NSCs可以直接替换损伤或死亡的神经细胞,并通过其增殖能力,持续修复损伤;另一方面,也存在诸如可控性、成瘤性和伦理性等诸多问题。在诸多问题中,关键的问题之一在于如何诱导NSCs向神经元方向分化。本课题组前期对黄芪多糖对NSCs增殖与分化的影响进行相关研究[6-7],发现黄芪多糖促进增殖的效果明显,但对分化的影响有限。本研究观察同为黄芪提取物的黄芪总皂甙(total saponins of Astragalus,TSA)能否更有效地诱导NSCs向神经元方向分化。TSA分子式C28H32O17,是中药黄芪的主要有效成分之一,具有抗凋亡、抗氧化、抗炎和扩张血管等作用[8-9]。TSA对改善运动性疲劳大鼠海马功能和形态有积极作用[10];可以促进体外培养的NSCs增殖[11]。本研究探索TSA促进NSCs诱导分化为神经元的最佳浓度范围,并探讨其相关机制。
1 材料与方法
1.1 实验动物与试剂
SPF级新生24 h Sprague-Dawley大鼠,购自中国人民解放军陆军军医大学大坪医院动物房,动物生产许可证号SCXK(渝)2012-0005。所有操作均根据《医学实验动物管理实施细则》要求,符合动物福利与伦理原则。
TSA(17429-69-5,纯度 ≥98%)、无菌细胞爬片、CCK-8、DNA酶、DAPI:北京索来宝公司。Neural basal培养基、B-27、Acctuase酶、胎牛血清(fetal bovine serum,FBS):美国GIBCO公司。碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表皮生长因子(epidermal growth factor,EGF):美国PEPROTECH公司。DMEM(含F12培养基、青霉素+链霉素双抗、0.25%胰酶):美国HYCLONE公司。小鼠单克隆抗nestin抗体:美国MILLIPORE公司。兔多克隆抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体:美国INVITROGEN公司。小鼠单克隆HM-2微管相关蛋白2(microtubule-associated protein-2,MAP-2)抗体、兔单克隆Wnt3/3a抗体、兔单克隆β-catenin抗体、小鼠单克隆内参GAPDH抗体:英国ABCAM公司。兔多克隆内参β-actin抗体、兔多克隆抗神经原素1(neurogenin 1,Ngn-1)抗体:美国AFFINITY公司。BrdU、小鼠单克隆BrdU抗体:美国SIGMA公司。DyLight488标记山羊抗小鼠二抗、TRITC标记山羊抗兔二抗、HRP标记山羊抗小鼠二抗、HRP标记山羊抗兔二抗:武汉博士德公司。组织蛋白抽提试剂、BCA蛋白浓度测定、蛋白上样缓冲液、ECL发光检测试剂盒、Wnt阻断剂ICG001:上海碧云天公司。10%蛋白电泳预制胶、MOPS电泳液:南京金斯瑞公司。
激光共聚焦显微镜:德国LEICA公司。荧光显微镜:日本OLYMPUS公司。细胞培养箱、酶标仪、-80℃冰箱:美国THERMO FISHER SCIENTIFIC公司。蛋白电泳、电转仪:美国BIO-RAD公司。Odyssey FC近红外双色激光和化学发光双功能成像系统:德国LI-COR公司。
1.2 方法
1.2.1 NSCs原代培养及传代
取新生大鼠大脑皮层组织,剪碎为1 mm3左右小块,0.25%胰酶联合DNA酶37℃消化10~15 min,FBS终止。蓝枪头吹打10~15次,70 μm细胞筛过滤为单细胞悬液;1000 r/min离心5 min,增殖培养基重悬,2×105/ml密度接种于培养皿,于37℃、5%CO2培养箱中培养,每2~3天半量换液,6~7 d传代。
1.2.2 NSCs鉴定
1.2.2.1 Nestin
取第三代培养7 d细胞球,接种于多聚赖氨酸包被后的细胞爬片中,培养箱中培养4 h贴壁。去除培养基,PBS洗两次;4%多聚甲醛固定20 min,PBS洗3次,每次5 min;0.5%tritonX-100破膜15 min,PBS洗3次,每次5 min;10%正常山羊血清37℃封闭30 min,甩干。加Nestin一抗(1∶200)4℃过夜。室温复温30 min,PBS洗3次,每次5 min;加Dylight488标记山羊抗小鼠二抗(1∶100),37℃孵育1 h,PBS洗3次,每次5 min;DAPI染核10 min,PBS洗2次,每次5 min;抗荧光淬灭封片剂封片,激光共聚焦观察。
1.2.2.2 BrdU
第三代培养3 d细胞培养基中加入10 μmol/ml BrdU培养2 d,接种到包被后的爬片上贴壁,4%多聚甲醛固定,2 mol/L HCl变性,0.1 mol/L NaB4O3清洗。按1.2.2.1染色步骤,一抗改为BrdU一抗(1∶100),二抗改为Dylight488标记山羊抗小鼠二抗(1∶100)。
1.2.3 CCK-8
取传代后单细胞悬液,接种于96孔板中,每孔约7000。设正常组和实验组:正常组使用不添加TSA的增殖培养基;实验组分别使用含TSA 1×10-2mol/L、1×10-3mol/L、1×10-4mol/L、1×10-5mol/L、1×10-6mol/L、1×10-7mol/L的增殖培养基。培养48 h后,每孔加10%培养基体积的CCK-8原液,继续培养4 h。酶标仪在450 nm处测光密度(optical density,OD)。每组5孔,重复3次。
1.2.4 诱导分化
后来,随着颍河的多次改道,小商河水日益枯竭,不再是一个水气氤氲,凤凰栖身的所在。干涸的河道,凝滞的河水,千年沧桑应如是,迢迢来路应如是。
取第三代神经球经Acctuase酶消化后的单细胞悬液,随机接种于多聚赖氨酸包被后的六孔板专用无菌爬片中,细胞密度约7.2×104/cm2。设正常组和实验组:正常组使用不添加TSA的诱导分化培养基,实验组使用含TSA 1×10-4mol/L、1×10-5mol/L、1×10-6mol/L(CCK-8筛选的浓度)的诱导分化培养基。2~3 d半量换液,并补足实验组TSA浓度。7 d后收集细胞行间接免疫荧光染色和Western blotting。诱导分化培养基为含2%B27、2%FBS、1%青霉素+链霉素的Neural basal基础培养基。
1.2.4.1 间接免疫荧光染色
参考1.2.2.1方法,一抗改为MAP-2一抗(1∶500)和GFAP一抗(1∶1000),二抗为Dylight488标记山羊抗小鼠二抗(1∶100)和TRITC标记山羊抗兔二抗(1∶100)。激光共聚焦下观察,每组任取5张细胞爬片染色,400倍下随机选择细胞数约70左右的5个视野进行统计。每组共统计25个有效视野,计算阳性细胞数并计算阳性细胞占全部细胞的百分比。
1.2.4.2 Western blotting
细胞于冰上用IP细胞裂解液裂解30 min,细胞刮收集裂解液,4℃、12000 r/min离心10 min取上清,BCA法测定蛋白浓度;加相应上样缓冲液煮沸,每孔上样25 μg;140 V恒压电泳,根据预染Marker的分子量切胶,300 mA恒流转移蛋白至活化的PVDF膜上,双蒸水洗2次,5%脱脂牛奶室温封闭2 h,TBST洗3次,每次5 min。根据分子量分别加MAP-2一抗(1∶2000)、GFAP 一抗(1∶10000)和 GAPDH 一抗(1∶5000),4℃过夜;TBST洗3次,每次10 min;依一抗不同种属,分别加HRP标记山羊抗小鼠二抗(1∶5000)、HRP标记山羊抗兔二抗(1∶5000),室温1 h,TBST洗3次,每次10 min,ECL化学发光剂反应,成像系统成像。Image J分析灰度值,计算目的蛋白与内参蛋白的灰度值比。重复3次。
1.2.5 Wnt/β-catenin信号通路相关蛋白检测
取第三代NSCs单细胞悬液,分别设立正常组、TSA组、TSA+抑制剂组和抑制剂组,分别采用普通诱导分化培养基,加TSA 1×10-5mol/L诱导分化培养基,加TSA 1×10-5mol/L和ICG-001 25 μmol/L诱导分化培养基,加ICG-001 25 μmol/L诱导分化培养基。每2~3天半量换液并补足TSA和ICG-001,培养7 d后提取总蛋白,同1.2.4.2方法检测Wnt3/3a、β-catenin、Ngn1相对表达量。一抗改为Wnt3/3a一抗(1∶20000)、β-catenin一抗(1∶5000)、Ngn1一抗(1∶500)和β-actin一抗(1∶3000),二抗依一抗加HRP标记山羊抗小鼠二抗(1∶5000)和HRP标记山羊抗兔二抗(1∶5000)。Image J分析灰度值,计算目的蛋白与内参蛋白的灰度值比。重复3次。
1.2.6 统计学分析

图1 NSCs鉴定(bar=100 μm)
2 结果
2.1 NSCs鉴定
细胞原代培养2~3 d后显著增殖,呈悬浮聚集成球生长,单个神经球直经≤50 μm。原代培养6~7 d后,神经球变大,直经150~300 μm。第三代培养7 d后,95%以上细胞Nestin阳性,且有BrdU阳性细胞存在(图1)。
2.2 浓度筛选
与正常组相比,实验组TSA浓度1×10-4mol/L、1×10-5mol/L、1×10-6mol/L时,NSCs数增加(P <0.05);TSA浓度1×10-2mol/L时,NSCs数减少(P<0.05)。见表1。
依据以往经验,促进NSCs增殖的最佳浓度通常也是促进分化机的最佳浓度,故以TSA 1×10-4mol/L、1×10-5mol/L、1×10-6mol/L作为后续分化实验浓度。
2.3 诱导分化
免疫荧光和Western blotting均显示,各实验组MAP-2蛋白表达均提高,GFAP蛋白表达均下降,以10-5mol/L效果最佳(P<0.05)。见图2、图3,表2、表3。

图2 各组免疫荧光染色(bar=100 μm)

表1 各组增殖情况比较(OD)

表2 MAP-2、GFAP阳性细胞数百分比(%)

图3 MAP-2、GFAPWestern blotting条带

表3 MAP-2、GFAP蛋白表达(/GAPDH)
2.4 Wnt3/3a、β-catenin、Ngn1蛋白表达
抑制剂组目的蛋白相对表达量低于正常组;TSA+抑制剂组表达量稍有升高,但仍低于正常组;TSA组表达量高于正常组(P<0.05)。见图4、表4。
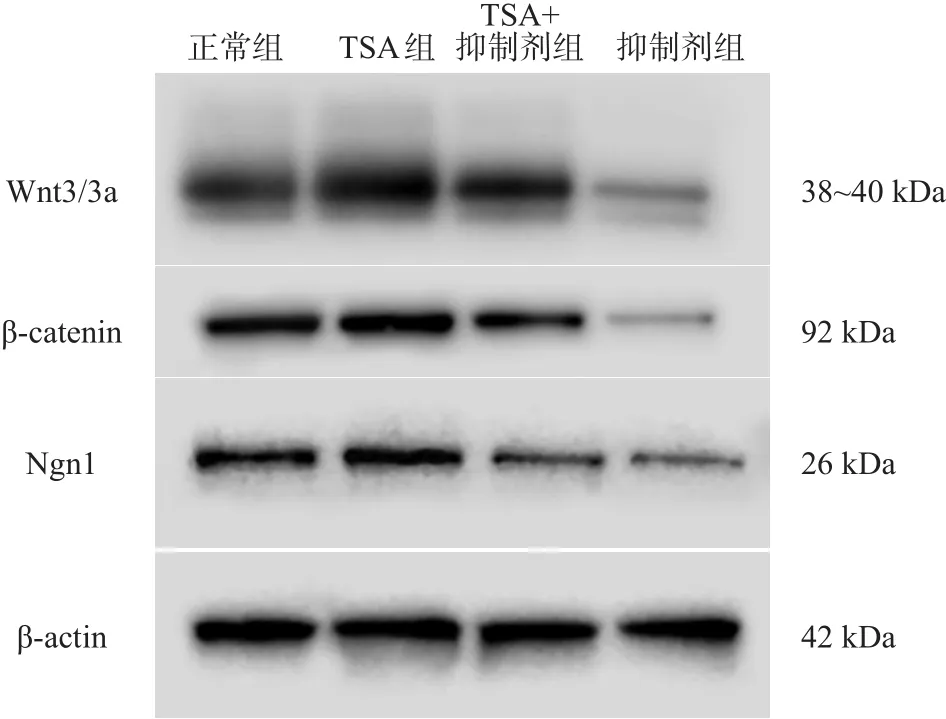
图4 Wnt3/3a、β-catenin、Ngn1 Western blotting条带
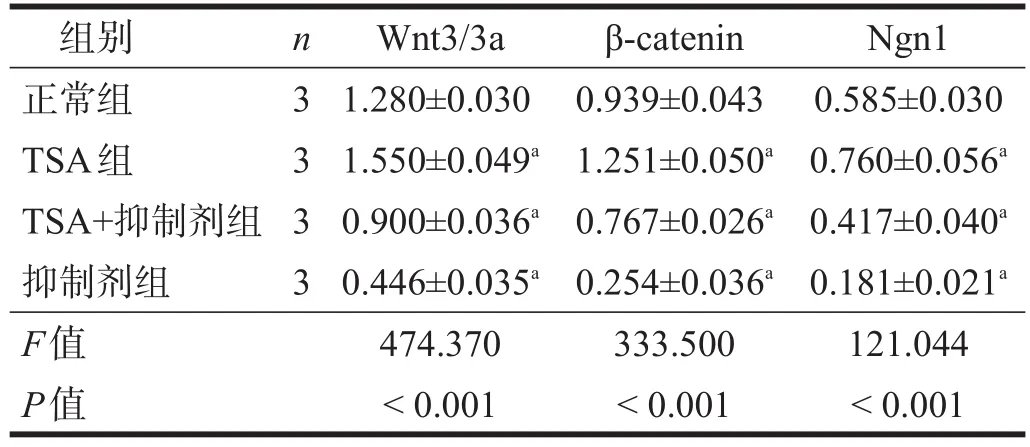
表4 Wnt3/3a、β-catenin、Ngn1蛋白表达(/β-actin)
3 讨论
针对神经系统病变,干细胞疗法备受关注,其中又以NSCs移植最有治疗前景[12]。NSCs具有自我更新能力,且能通过不对称分裂方式分化为神经元、星形胶质细胞、少突胶质细胞等中枢神经细胞[13]。其分化的神经元可替换损伤或死亡的神经元,修复神经组织,恢复神经信号传导[14];其分化的星形胶质细胞能营养支持和保护神经,还可以抑制炎症等[15]。在运用NSCs治疗神经损伤类疾病时,诱导NSCs分化成神经元,从结构上修复损伤的神经,可以发挥最好疗效。然而相关实验表明,NSCs优先分化成星形胶质细胞[16]。如何更好地诱导NSCs向神经元方向分化,成为干细胞疗法的热点和难点。
黄芪为补气中药,现代药理学研究证明,黄芪具有延缓脑退行性变、保护脑血管等多种作用[17-18]。张力等[19]研究表明,黄芪注射液可以促进体外培养的NSCs增殖,对细胞分化也有一定促进作用。黄芪注射液能促进内源性脑组织Nestin表达,并促进NSCs分化为神经元和神经胶质细胞[20]。
黄芪提取物有黄芪多糖、黄芪黄酮和TSA[21]。本研究显示,TSA在适宜浓度下,可体外诱导NSCs更多向神经元分化,减少分化为胶质细胞的比例,这一作用可能与经典的Wnt/β-catenin信号通路有关。
Wnt蛋白是一种广泛存在的分泌型蛋白生长因子,作为配体蛋白,可通过调控下游靶蛋白Ngn-1、Ngn-2、cyclinD1和c-myc影响神经细胞分化[22-23]。Wnt3a是Wnt家族的成员,有抑制NSCs增殖,促进向神经元分化的作用[24]。诸多研究表明,激活Wnt/β-catenin信号通路能显著促进NSCs向神经元分化的比例[25-27]。Ngn1是Wnt/β-catenin信号通路重要的下游靶蛋白,可调控干细胞向神经元方向分化,并降低胶质细胞数量[28]。
本研究经CCK-8初筛,发现TSA在1×10-4mol/L、1×10-5mol/L、1×10-6mol/L浓度下均能有效促进NSCs增殖。进一步观察显示,TSA 1×10-5mol/L促进NSCs向神经元分化的作用最佳。TSA增加Wnt/β-catenin信号通路中关键蛋白表达,这一作用可被通路抑制剂部分阻断。研究表明,TSA通过提高上游蛋白Wnt3/3a、枢纽蛋白β-catenin表达量,激活Wnt/β-catenin信号通路,增加下游促分化靶向蛋白Ngn1的表达,促进NSCs向神经元分化,降低向星形胶质细胞分化。进一步深化对中药黄芪药理作用的理解,并为NSCs移植提出可能的中医药联合方案。TSA精确的最佳浓度,以及是否对体内NSCs具有同样调控作用,还需要进一步研究。

