唾液腺腺样囊性癌XT-I和XT-Ⅱ基因沉默效果的比较
徐 明 王 洁 刘慧娟 张艳宁 董福生
唾液腺腺样囊性癌(salivary adenoid cystic carcinoma,SACC)是唾液腺最常见的恶性肿瘤之一。该肿瘤无包膜,浸润性生长,早期侵犯周围神经,远处转移性强,临床预后差。
SACC主要由肿瘤性腺上皮和肿瘤性肌上皮细胞(neoplastic myoepithelial cells)构成,肿瘤性肌上皮细胞具有合成分泌蛋白多糖(proteoglycans,PGs)的功能。本实验室以往的研究发现,PGs对腺样囊性癌的增殖、粘附、迁移、侵袭及转移等生物学行为的实施,提供了物质基础和能量来源。
蛋白多糖(proteoglycans,PGs)是由核心蛋白及不同的糖胺聚糖(glycosaminoglycans,GAGs)侧链构成的一类大分子糖蛋白,属于胞外基质(extracellular matrix,ECM)非胶原的重要成分[1]。在机体内生物合成过程较为复杂,影响因素较多。然而,木糖基转移酶 -I(xylosyltransferase,XT-I)是 PGs 合成过程中关键性的起始酶,对PGs的合成起到至关重要的作用。XT-II作为XT-I的一个亚型,同样参与了PGs的生物合成。二者氨基酸的相似度接近55%。分别沉默XT-I与XT-II,对腺样囊性癌蛋白多糖合成的影响,目前尚未有人研究。
本课题所采用的RNA干扰(RNA interference,RNAi)技术,设计构建靶向沉默木糖基转移酶XT-I和XT-II基因的质粒载体,采用腺病毒包装,转染腺样囊性癌细胞。分别观察木糖基转移酶XT-I和XT-II基因沉默后,蛋白多糖合成分泌量的变化,比较两种基因的沉默效率。
资料和方法
1.材料:人唾液腺腺样囊性癌细胞株(SACC-83),购买自北京大学口腔医学院口腔颌面外科研究室。
2.腺病毒的构建与包装:均由武汉淅玛生物技术有限公司(原武汉晶赛生物技术有限公司)完成。
3.细胞培养与转染:将SACC-83细胞培养于含15%胎牛血清的RPMI 1640培养液(100U/ml青霉素和100U/ml链霉素,PH值为 7.2)中,于 37℃、5%CO2饱和湿度培养箱中培养,每隔48h以0.25%胰蛋白酶(0.01 M PBS)消化传代。取处于对数生长期的细胞,常规消化传代,制备细胞悬液,每100ml培养瓶接种1×105细胞,继续培养24小时。0.01MPBS冲洗三次后加入新鲜RPMI-1640培养基,按感染复数(multiplicity of infection,MOI)为 100加入重组腺病毒(浓度 1×109pfu)。
4.实验分组:实验分为转染Ad-shRNA-XT-I组(SACC-83-XT-I 组 , 沉 默 组 1)、 转 染Ad-shRNA-XT-II组(SACC-83-XT-II组,沉默组2)、转染Ad-shRNA-HK组(SACC-83-HK 组,空载体组)和未转染的SACC-83细胞组(SACC-83组,未转染组)。
5.XT-I基因和XT-II基因mRNA表达:提取细胞总RNA并对其进行扩增。XT-I、XT-II和GAPDH引物序列如下(均由北京Invitrogen公司合成):XT-I上游引物:5'-GCAAGTTTGAAGCCGTGGT-3';XT-I下游引物:5'-AAAGGAGTGGTACAAGGTG AGTG-3';XT-II 上 游 引 物 :5'-GTTCGA CTCCTTCAGTTCTGG-3';XT-II 下 游 引 物 :5'-CT GCTCCATGTACTCGTTGTG-3';GAPDH 上游引物:5'-GTAACCCGTTGAACCCCATT-3';GAPDH 下游引物 :5'-CCATCCAATCGGTAGTAGCG-3'。 采 用Real-time PCR的方法分别检测XT-I和XT-II基因的表达。通过相对定量法比较XT-I和XT-II基因mRNA表达。
6.XT-I和XT-II蛋白的相对表达量:利用蛋白印迹(Weastern blot)技术,采用鼠抗人木糖基转移酶(XT-I、XT-II)单克隆抗体作为一抗,辣根过氧化物酶标记山羊抗鼠二抗,管家基因GAPDH作为内参基因,检测XT-I蛋白在SACC-83-XT-I组,SACC-83-HK组和SACC-83组的相对表达量以及XT-II蛋白在SACC-83-XT-II组,SACC-83-HK组和SACC-83组的相对表达量。
7.蛋白多糖合成:采用Blyscan Sulfated GAG Assay试剂盒建立浓度-吸光度标准曲线。将测得的吸光度值代入标准曲线计算公式,计算转染后蛋白多糖合成抑制率。GAGs抑制率=(1-沉默组GAGs含量/未转染组GAGs含量)×100%
8.统计学分析:采用SPSS21.0统计分析软件进行统计学处理。所有实验数据以均数±标准差(Mean±SD)表示,单因素方差分析对实验结果进行分析,P<0.05表示差异具有统计学意义。
结 果
1.腺病毒的构建及包装
利用shRNA真核表达载体成功构建了重组腺病毒Ad-shRNA-XT-I和Ad-shRNA-XT-II腺病毒(图1)。
腺病毒酶切分析显示,正确的克隆将切出一条约2.5K的小条带,且大条带大于15kb(说明载体为腺病毒载体),可知目的克隆正确,将其分别命名为Ad-shRNA-XT-I、Ad-shRNA-XT-II(图2)。
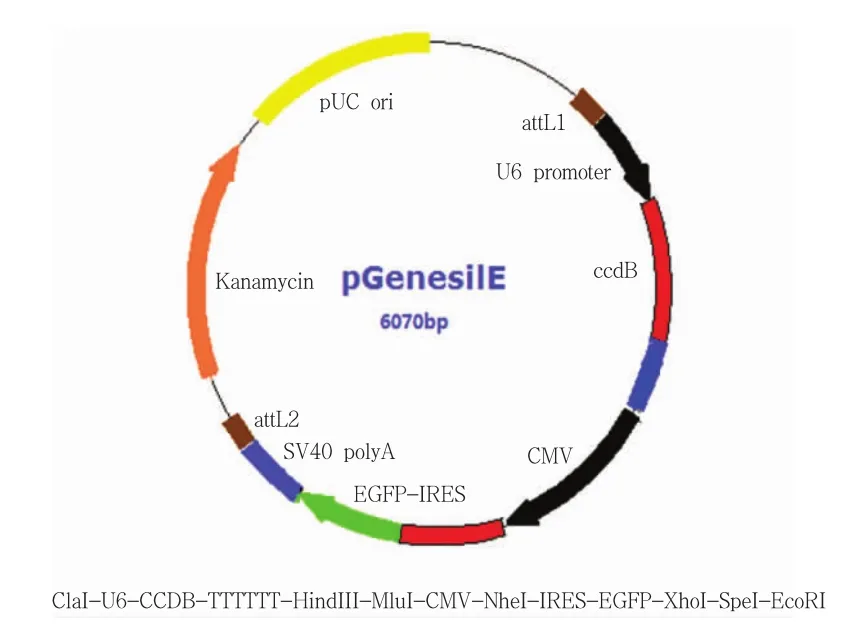
图1 腺病毒Ad-shRNA-XT-I和Ad-shRNA-XT-II构建环形图
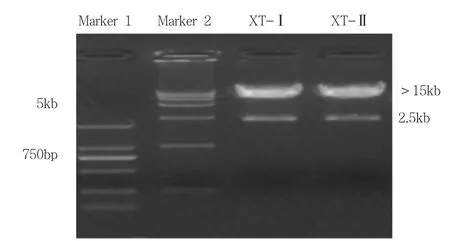
图2 腺病毒Ad-shRNA-XT-I和Ad-shRNA-XT-II酶切图
测序结果显示,目的序列与设计序列完全匹配,表明腺病毒构建成功(图3、4)。
2.腺病毒的转染
腺病毒转染48小时后,在倒置荧光显微镜下可见未转染的SACC-83组细胞未见绿色荧光表达(图5),而两沉默组和空载体组细胞均可表达绿色荧光蛋白(图6~8)。消化细胞,计数荧光细胞数,每组计数3次,计算转染率,取平均值。
转染率=(表达EGFP的细胞数/细胞总数)×100%沉默组1(SACC-83-XT-I组)的转染率为91.71%沉默组2(SACC-83-XT-II组)的转染率为93.05%空载体组(SACC-83-HK组)的转染率94.10%
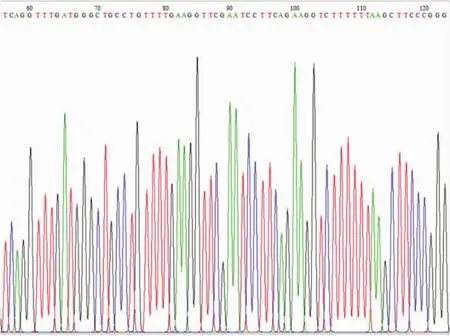
图3 腺病毒Ad-shRNA-XT-I测序图
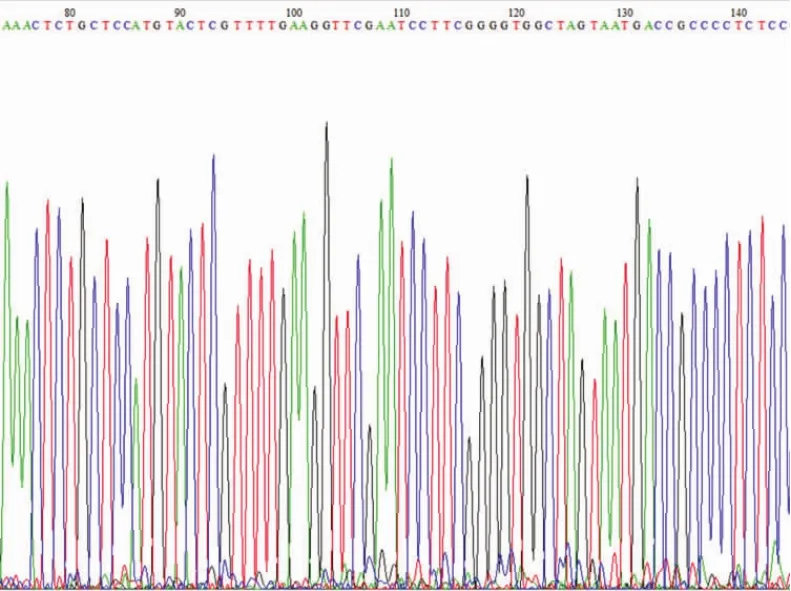
图4 腺病毒Ad-shRNA-XT-II测序图

图5 未转染组SACC-83细胞荧光倒置显微镜( ×100)

图6 空载体组SACC-83-HK细胞荧光倒置显微镜( ×100)

图7 沉默组1 SACC-83-XT-I细胞荧光倒置显微镜( ×100)
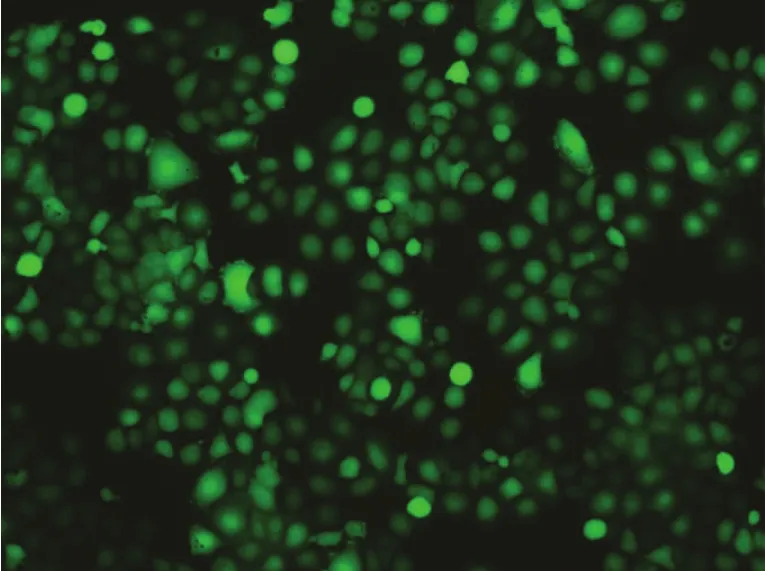
图8 沉默组2 SACC-83-XT-II细胞荧光倒置显微镜( ×100)
3.Real-time PCR分别检测XT-I和XT-II的基因沉默效率
提取转染48h的4组细胞总RNA,鉴定其纯度(吸光度比值:OD260nm/OD280nm),达到要求后,将样本RNA反转录成cDNA,进行Real-time PCR扩增,生成XT-I和内参基因GAPDH的溶解曲线和扩增曲线(图9、10)以及XT-II和内参基因GAPDH的溶解曲线和扩增曲线(图11、12)。溶解曲线呈锐利的单峰曲线,并且峰前曲线平滑,说明引物设计正确。
根据△△CT计算方法算得,沉默组1(SACC-83-XT-I组)中SACC-83组细胞XT-I基因mRNA相对表达量为1.00,SACC-83-HK组细胞XT-I基因 mRNA相对表达量为 1.20±0.26,SACC-83-XT-I组细胞XT-I基因mRNA相对表达量为 0.36±0.05(表 1)。沉默组 2(SACC-83-XT-II组)中SACC-83组细胞XT-II基因mRNA相对表达量为 1.00,SACC-83-HK组细胞 XT-II基因mRNA相对表达量为 1.22±0.18,SACC-83-XT-II组细胞XT-II基因mRNA相对表达量为0.46±0.04(表2)。两基因沉默组分别与空载体组和未转染组比较,差别具有统计学意义(P<0.05)。

图9 XT-I与GAPDH基因溶解曲线图
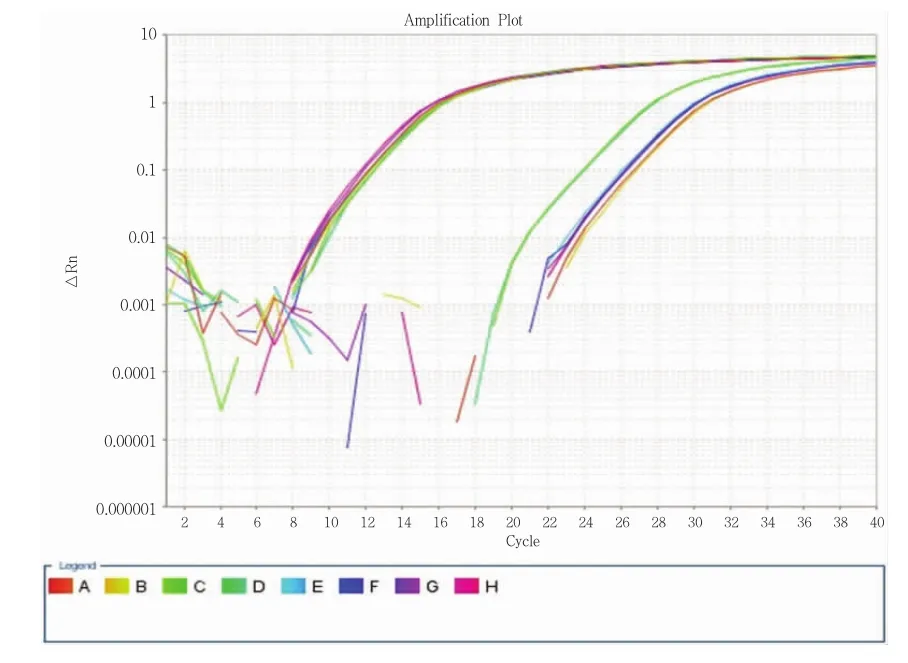
图10 XT-I与GAPDH基因扩增曲线图

图11 XT-II与GAPDH基因溶解曲线图

图12 XT-II与GAPDH基因扩增曲线图

表1 Real-time PCR检测XT-I基因相对表达量(Mean±SD)

表2 Real-time PCR检测XT-II基因相对表达量(Mean±SD)
4.Western blot检测 XT-I、XT-II蛋白含量
通过GeneTool检测Western blot样本条带相对定量分析结果显示:沉默组1(SACC-83-XT-I组)中SACC-83组中XT-I蛋白相对表达量为0.72±0.17;SACC-83-HK组中XT-I蛋白相对表达量为0.68±0.16;SACC-83-XT-I组中 XT-I蛋白相对表达 量 为 0.34±0.06( 图 13)。 沉 默 组 2(SACC-83-XT-II组)中SACC-83组中XT-II蛋白相对表达量为 0.80±0.08;SACC-83-HK组中XT-II蛋白相对表达量为 0.77±0.09;SACC-83-XT-II组中XT-II蛋白相对表达量为0.49±0.05(图 14)。沉默组 1(SACC-83-XT-I组)相对未转染组(SACC-83组)XT-I蛋白相对表达量降低38%(表 3)。沉默组 2(SACC-83-XT-II组)相对未转染组(SACC-83组)XT-II蛋白相对表达量降低31%(表4)。两空载体组均未见蛋白表达明显降低。
5.蛋白多糖合成量检测
BSA标准品测得标准曲线为Y=0.0102X+0.0279(R2=0.9898)(图15)。根据标准曲线测得转染48小时后,每106细胞分泌蛋白多糖含量为:沉默组1(SACC-83-XT-I组)68.33±4.75μg;沉默组 2(SACC-83-XT-II组)86.28±5.67μg;空载体组(SACC-83-HK组)126.58±9.21 μg;未转染组(SACC-83组)135.81±10.15 μg(图 16)。沉默组1(SACC-83-XT-I组)比较未转染组(SACC-83组)蛋白多糖合成量降低49.69%,沉默组2(SACC-83-XT-II组)比较未转染组(SACC-83组)蛋白多糖合成量降低36.47%。空载体组(SACC-83-HK组)比较未转染组(SACC-83组)蛋白多糖合成量降低6.79%(表5)。单因素方差分析结果显示:两沉默组分别与空载体组、未转染组有统计学差异(P<0.05),沉默组 1(SACC-83-XT-I组)与沉默组2(SACC-83-XT-II组)相比,具有统计学差异(P<0.05)。空载体组和未转染组未见明显差异(P>0.05)。
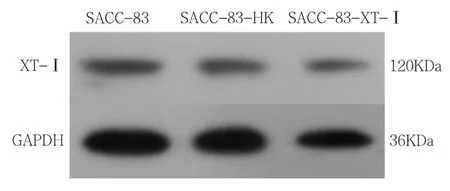
图13 Western-blot检测XT-I蛋白表达水平

图14 Western-blot检测XT-II蛋白表达水平

图15 蛋白多糖标准曲线图

图16 每组106细胞中蛋白多糖的分泌量
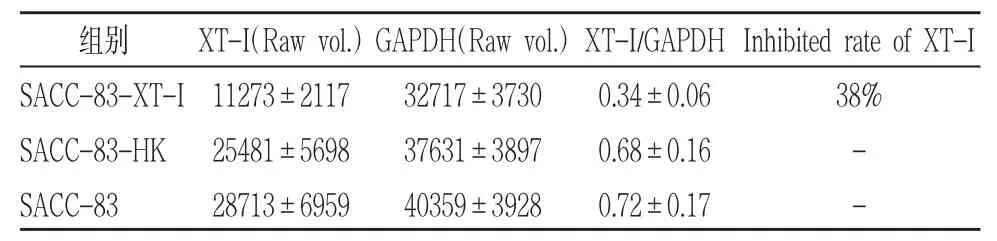
表3 Western blot检测XT-I蛋白的相对表达量(Mean±SD)

表4 Western blot检测XT-II蛋白的相对表达量(Mean±SD)
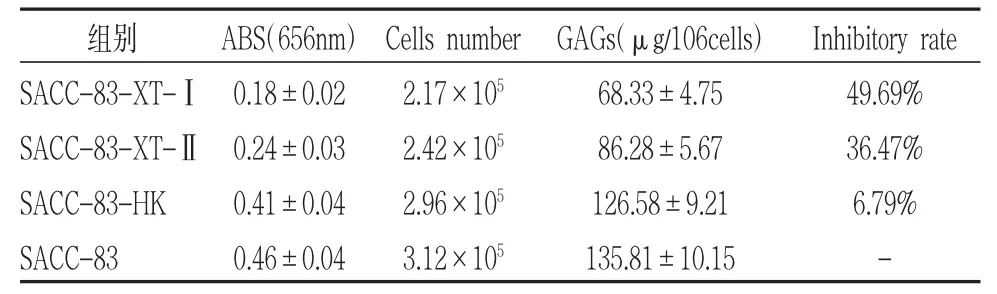
表5 每组106细胞中蛋白多糖的分泌量(Mean±SD)
讨 论
唾液腺腺样囊性癌(salivary adenoid cystic carcinoma,SACC)最常见的唾液腺上皮性的恶性肿瘤,约占唾液腺恶性肿瘤的21%~24%[2~4]。在临床上具有侵袭性强,血行转移率高的特点。在SACC患者中,远处转移和神经浸润最为常见[5,6]。其远处转移率高达40%以上,尤其累及肺、骨和肝。唾液腺腺样囊性癌(SACC)的嗜神经生长和远处转移的机制尚不清楚,一直成为口腔科学领域研究的难点和热点。
在唾液腺中,正常的肌上皮细胞通常呈三角形分布于腺泡细胞和基底膜之间,或呈长梭形分布在闰管壁的导管上皮和基底膜之间。肌上皮细胞的胞核呈圆形或椭圆形,胞浆中充满了肌微丝而细胞器较少,具有收缩功能,可协助腺泡及导管排出分泌物[7]。
唾液腺腺样囊性癌主要由肿瘤性腺上皮和肌上皮细胞(neoplastic myoepithelial cells,NMCs)构成。以往的研究发现,唾液腺腺样囊性癌在肿瘤发生发展过程中,存在着多基因的异常和突变[8,9]。目前对于腺样囊性癌的基因研究和外泌体的研究,仍然是研究热点所在[10,11]。研究表明,肌上皮细胞转变为肿瘤细胞后,获得了分泌蛋白多糖的功能。肿瘤性肌上皮细胞产生的蛋白多糖,形成了腺样囊性癌特殊的筛孔状结构[12,13]。其他研究也表明,SACC独特的筛孔状结构的形成正是由于肿瘤性肌上皮细胞异常分泌过多的蛋白多糖(PGs),并且在SACC增殖过程中PGs呈现动态变化[14,15]。SACC除具有筛孔结构外,还有很多的条索状结构。这些条索状结构周围同样富含肿瘤性肌上皮细胞分泌产生的PGs。条索状结构具有很强的侵袭和浸润性生长的能力,PGs的分泌为肿瘤的浸润性生长提供了良好的营养基础和细胞增殖的大分子微环境[16]。
PGs是由核心蛋白及不同的糖胺聚糖(glycosaminoglycans,GAGs)侧链构成的一类大分子糖蛋白,属于胞外基质(extracellular matrix,ECM)非胶原的重要成分。但是同一核心蛋白上可结合不同的GAGs从而构成了结构复杂,功能多样的PGs。这些不同的PGs分子不仅与胶原纤维、弹性纤维、糖蛋白等一起组成SACC的细胞外间质,而且还参与调控肿瘤的生长与分化,是造成SACC组织结构多样性和其特定生物学行为的主要因素。
PGs在机体中的生物合成过程较为复杂,影响因素众多。在诸多影响因素中,起催化作用的酶与其生物合成关系最为紧密,而木糖基转移酶(xylosyltransferase,XT)是PGs合成的效率-限制阶段中的关键起始酶,对PGs的合成和分泌起到至关重要的作用。目前研究发现,XT具有两个亚型(isoform):XT-I和XT-II。人的XT-I基因位于染色体16p13.1,含有12个外显子以及巨大的内含子,开放阅读框2877bp,总长度达300kb以上。而人的XT-II基因位于染色体17q21.3-17q22,含有11个外显子,开放阅读框2598bp,总长仅为15kb。但XT-I与XT-II表现出了高度保守的外显子-内含子结构,尤其在后9个外显子的结合部位更是高度的相似[17,18]。基因同源性相当之高。而人的XT-I基因编码959个氨基酸,蛋白分子量约为120Kda。人XT-II基因编码865个氨基酸,蛋白分子量约为97Kda。二者全部氨基酸中,相似度不足55%。在XT的催化作用下,尿苷二磷酸-D-木糖(UDP-D-xylose)中的一分子木糖基连接到了核心蛋白的丝氨酸-甘氨酸序列的丝氨酸残基的羟基上,从而以O-糖苷键的形成而完成其使命。而已连接到核心蛋白的木糖则继续参与形成三糖核心区乃至四糖核心区,再连接交替的若干二糖结构,最终核心蛋白和糖氨多糖侧链相连构成PGs。
RNA 干扰(RNA interference,RNAi)技术是目前应用较广泛,效果较好的一种基因沉默技术。以往实验曾利用RNAi技术,构建了靶向沉默人木糖基转移酶-I基因的shRNA真核表达载体[19]。有效沉默了PGs合成的关键起始酶XT-I基因,从而阻抑了PGs的合成与分泌。筛选并建立了PGs合成抑制的ACC-M-WJ3和ACC-M-WJ4细胞株,通过生长曲线和MTT分析观察表明,降低ACC-M细胞PGs的合成分泌水平,可以有效抑制细胞的增殖,阻止细胞进入有丝分裂增殖S期。并且通过裸鼠实验发现,PGs的减少可以导致ACC-M细胞在裸鼠体内的增殖受到明显抑制,促进了肿瘤细胞的凋亡。紧接着又通过经典的体外划痕实验,明确了ACC-M细胞PGs分泌水平的降低,可使其细胞运动能力显著下降。为进一步观察PGs分泌水平的变化对ACC-M细胞侵袭转移能力的影响,通过裸鼠体内肺转移实验证明了PGs的合成与分泌的抑制,对ACC-M细胞的肺转移和侵袭能力具有显著阻断作用[20]。
通过进一步从临床病例中,筛选出与腺样囊性癌肺转移密切相关的蛋白多糖亚类GPC5,进行有效的抑制,明显阻断了腺样囊性癌的肺转移[21]。
腺样囊性癌细胞在有蛋白多糖提供的情况下,定向嗜神经迁移,沿神经纤维束生长,侵袭神经纤维束。同样利用RNAi技术,靶向沉默SACC细胞XT-I基因的表达,抑制PGs的合成与分泌,并通过裸鼠移植瘤神经侵袭实验,发现PGs合成分泌阻抑后,SACC细胞的嗜神经生长和侵袭神经的能力得到明显阻断[22]。提示唾液腺腺样囊性癌是一种蛋白多糖依赖性肿瘤,它的恶性生物学行为的实施完全依赖于肿瘤性肌上皮细胞产生的蛋白多糖。
以往的研究表明,沉默XT-I基因,PGs合成受到阻抑[23],沉默XT-II基因,PGs合成同样受到阻抑[24]。然而,沉默XT-II基因较沉默XT-I基因谁的沉默效率更高?目前尚未见报道。本研究采用RNAi技术,同时沉默XT-I和XT-II基因,比较二者的沉默效果。结果发现,在腺样囊性癌中,沉默XT-I基因,阻抑蛋白多糖合成量效率(49.69%)明显高于XT-II基因(36.47%)。
综上所述,本实验构建靶向沉默XT-I、XT-II基因的质粒载体,采用腺病毒包装(Ad-shRNA-XT-I、Ad-shRNA-XT-II)。采用RNAi技术,转染人唾液腺腺样囊性癌细胞,分别沉默XT-I和XT-II基因的表达,阻抑PGs的合成与分泌。通过Real-time PCR技术和Western blot蛋白印迹法,分别检测二者的基因沉默率和蛋白抑制率,通过PGs含量的测定发现,分别沉默XT-I和XT-II基因均可抑制PGs的合成分泌,其中沉默XT-I基因后,PGs量降低的效果,明显优于沉默XT-II基因,差别有显著性。

