功能性复合膜与人牙周膜干细胞的生物相容性研究
杨 昊 雷 敏 伊远平 支方静
牙周病是造成成年人牙齿缺失的主要原因,目前牙周治疗的目的除了控制局部炎症外,还要实现牙周组织的修复与再生。随着引导组织再生技术(guide tissue regeneration,GTR)在临床的广泛应用,对生物膜材料的研究也更加丰富多样,膜材料不仅能起到机械屏障作用,作为细胞载体复合了生长因子的膜材料还能为牙周组织提供更加理想的再生环境,在牙周组织再生工程中有着重要的地位和作用[1,2]。为了解决生长因子与生物膜复合后短期内降解失活的问题,将缓释给药系统(sustained release delivery system,SRDS)引入生物膜的研究,通过提高蛋白类药物在缺损局部的治疗浓度,延长药物在局部的作用时间[3,4]。在这类生长因子载体中,天然多糖类化合物基水凝胶被证实具有较好的生物膜性能[5~13],其中右旋糖酐是理想的智能凝胶载体材料。有实验组将缓释载体系统甲基丙烯酸缩水甘油酯右旋糖酐(dextran-glycidylmethacrylate,dex-GMA)与生长因子重组人骨形态发生蛋白-2(recombined human bone morphogenetic protein-2,rhBMP2)相结合的凝胶微球,复合到单纯壳聚糖引导组织再生膜中,将其制备成具有较好生物活性的功能性复合膜(functional complex film,FCF)[13,14],为生物膜研究提供了新的方向。随着牙周膜干细胞的发现及转化医学的发展,将牙周膜干细胞移植于牙周组织缺损处进行牙周组织的修复有望用于临床治疗,因此对GTR技术中生物膜的研究也至关重要。本文将之前实验组所制备的FCF与人PDLSCs的生物相容性进行综合评价。
资料和方法
一、材料
单纯壳聚糖引导组织再生膜(购置于第四军医大学组织工程中心,图1);功能性的复合膜(FCF[13])(购置于第四军医大学组织工程中心,图2);Ⅰ型胶原酶(Sigma,美国);2.5g/L 胰蛋白酶(Amresco,美国);二甲基亚砜DMSO(Sigma公司,美国);茜素红(Sigma,美国);油红 O(Sigma,美国)。

图1 单纯壳聚糖膜电镜图(SEM ×700)
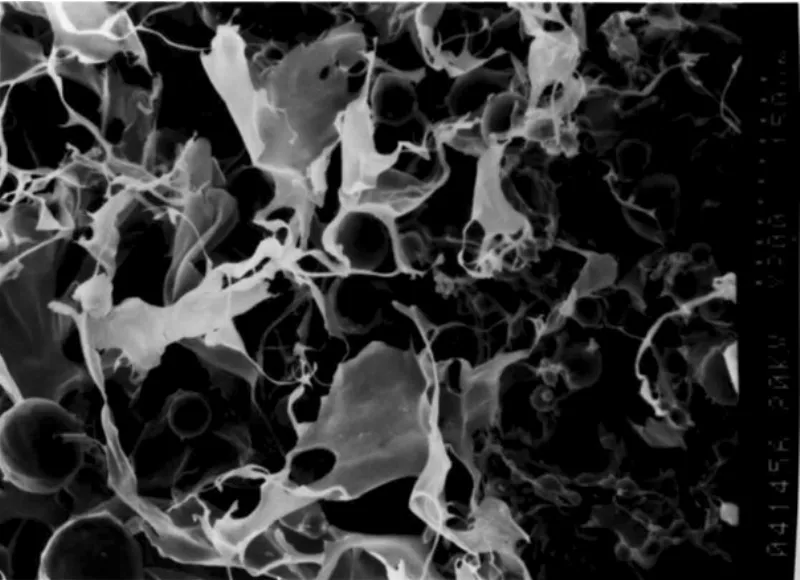
图2 复合载药微球的壳聚糖引导组织再生膜电镜图(SEM ×400)
二、人PDLSCs的分离培养和鉴定
1.人PDLSCs的分离和培养
无菌条件下用刀片刮取离体牙根中1/3的牙周膜组织,剪碎为1mm3组织块,Ⅰ型胶原酶消化15min后置于6孔板中,在标准环境下孵育,每2~3d换液1次,当细胞爬出达到80%汇合时,用有限稀释法分离培养人PDLSCs[15]。
2.人PDLSCs生长曲线的测定
取第3代PDLSCs,调整细胞密度为1×104/ml,接种于96孔板中,每孔200μl,置于标准环境中24小时后,每孔加20μl的MTT液,4小时后弃上清液,加160μl DMSO,测吸光值(OD 值),以时间为横轴绘制细胞生长曲线。
3.人PDLSCs体外分化能力的鉴定
取第3代细胞以5×104/ml接种于6孔板中,细胞汇合至50%~60%时,换成骨诱导液,每3天换液,至28天时细胞呈复层生长并出现圆形结节,茜素红染色,镜下观察并照相。
取第3代细胞以5×104/ml接种于6孔板中,培养细胞至80%~90%时换成脂诱导液,每3天换液,21天时脂滴形成,油红O染色并照相。
3.细胞相容性实验
(1)浸提液制备:在标准环境下,将FCF(实验组)及单纯壳聚糖膜(对照组)分别以0.5cm2/ml浸泡在Eagle’s MEM中,在24h、48h和72h时收集两组浸提液。
(2)降解液制备:在标准环境下,将FCF(实验组)及单纯壳聚糖膜(对照组)分别以0.5cm2/ml浸泡在Eagle’s MEM中,在2、4、8周时收集两组降解液。
(3)MTT(即 thiazolylblue,噻唑蓝) 法:将PDLSCs以 4×103/ml接种于 96孔板中,每孔100μl,分成两大组,即浸提液组和降解液组,每组分别设空白组、对照组、实验组。培养24小时后,空白组为单纯Eagle’s MEM培养液,对照组弃培养液加单纯壳聚糖浸提液、降解液,实验组弃培养液加FCF浸提液、降解液,在 2d、4d、7d时测吸光值(OD值),观察细胞在浸提液、降解液中增殖的情况。
(4)ALP检测:分别将浸提液和降解液的空白组、对照组及实验组在相同时间点2d、4d、7d弃去相应培养液,使用碱性磷酸酶试剂盒(南京建成)进行ALP定量,比较浸提液和降解液对细胞分化的影响。
结 果
一、人PDLSCs的分离培养和鉴定
1.形态学观察:人PDLSCs为多角形细胞,胞突细长,核呈圆形或卵圆形(图3)。
2.生长曲线:人PDLSCs生长曲线呈倒S形,1~2天内细胞数量无显著变化,第3天细胞生长迅速,第8天时达高峰,之后细胞生长速度下降(图4)。
3.成骨成脂分化:成骨诱导28天时细胞复层生长,可见圆形小结节,茜素红染色见红色成骨结节(图5a)。成脂诱导21天时,细胞复层生长并有圆形小空泡形成,油红O染色,镜下观察脂滴(图5b)。

图3 体外培养的人牙周膜干细胞
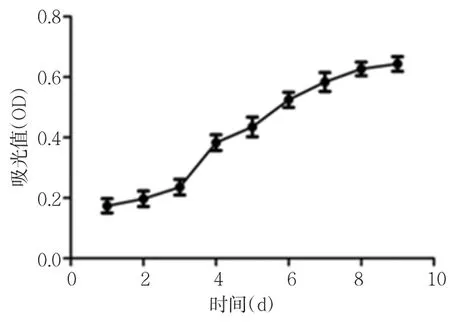
图4 人PDLSCs细胞生长曲线图

图5 人PDLSCs体外诱导分化
表1 FCF浸提液对人PDLSCs增殖的作用(OD值,±s)
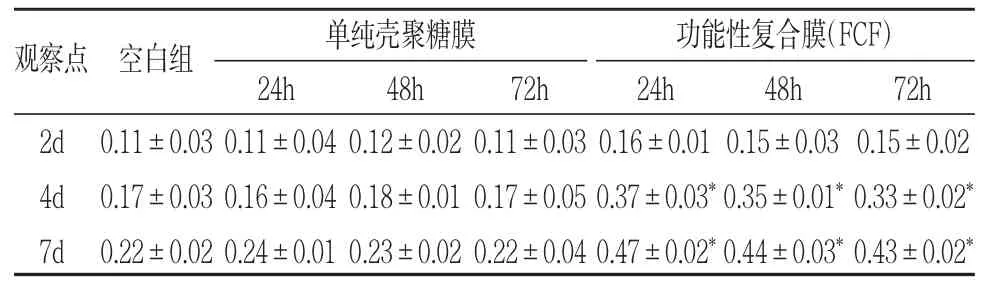
表1 FCF浸提液对人PDLSCs增殖的作用(OD值,±s)
*P<0.05
观察点 空白组 单纯壳聚糖膜24h 48h 72h功能性复合膜(FCF)24h 48h 72h 2d 4d 7d 0.11±0.03 0.17±0.03 0.22±0.02 0.11±0.04 0.16±0.04 0.24±0.01 0.12±0.02 0.18±0.01 0.23±0.02 0.11±0.03 0.17±0.05 0.22±0.04 0.16±0.01 0.37±0.03*0.47±0.02*0.15±0.03 0.35±0.01*0.44±0.03*0.15±0.02 0.33±0.02*0.43±0.02*
二、细胞相容性实验
1.MTT法:细胞在浸提液、降解液中培养后不同时间点OD值检测结果见表1、2。由表1可以看出,人PDLSCs在普通培养液(空白组)、单纯壳聚糖膜的浸提液(对照组)及FCF浸提液(实验组)中均有增殖,但在FCF浸提液中增殖明显高于另外两组(P<0.05),有统计学意义。由表2得出, 在三组的降解液中人PDLSCs均有增殖,只有2周的FCF降解液中细胞增殖明显高于其他组(P<0.05),有统计学意义。
2.ALP检测:不同时间点反映ALP活性的OD值检测结果见表3、4。由表3可以看出,实验组浸提液的ALP活性明显高于空白组及对照组(P<0.05),有统计学意义。由表4得出,实验组2周时降解液的ALP活性明显高于对照组(P<0.05),有统计学意义。4周、8周时空白组、对照组、实验组降解液的ALP活性无显著性差异。
表2 FCF降解液对人PDLSCs增殖的作用(OD值,±s)
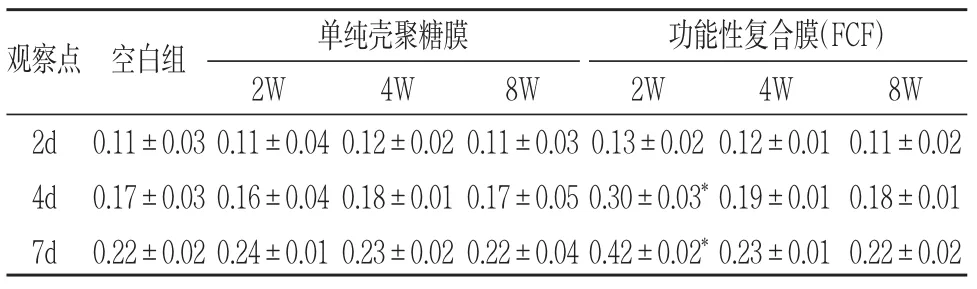
表2 FCF降解液对人PDLSCs增殖的作用(OD值,±s)
*P<0.05
观察点 空白组 单纯壳聚糖膜2W 4W 8W功能性复合膜(FCF)2W 4W 8W 2d 4d 7d 0.11±0.03 0.17±0.03 0.22±0.02 0.11±0.04 0.16±0.04 0.24±0.01 0.12±0.02 0.18±0.01 0.23±0.02 0.11±0.03 0.17±0.05 0.22±0.04 0.13±0.02 0.30±0.03*0.42±0.02*0.12±0.01 0.19±0.01 0.23±0.01 0.11±0.02 0.18±0.01 0.22±0.02
表3 FCF浸提液对人PDLSCs的ALP活性的影响(OD值,±s)
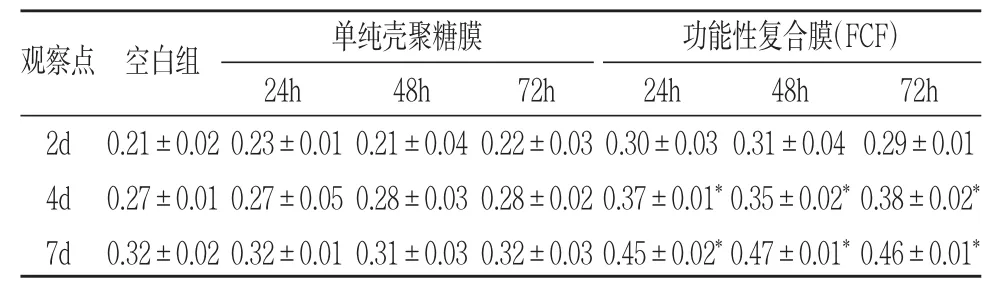
表3 FCF浸提液对人PDLSCs的ALP活性的影响(OD值,±s)
*P<0.05
观察点 空白组 单纯壳聚糖膜24h 48h 72h功能性复合膜(FCF)24h 48h 72h 2d 4d 7d 0.21±0.02 0.27±0.01 0.32±0.02 0.23±0.01 0.27±0.05 0.32±0.01 0.21±0.04 0.28±0.03 0.31±0.03 0.22±0.03 0.28±0.02 0.32±0.03 0.30±0.03 0.37±0.01*0.45±0.02*0.31±0.04 0.35±0.02*0.47±0.01*0.29±0.01 0.38±0.02*0.46±0.01*
表4 FCF降解液对人PDLSCs的ALP活性的影响(OD值,±s)

表4 FCF降解液对人PDLSCs的ALP活性的影响(OD值,±s)
*P<0.05
观察点 空白组 单纯壳聚糖膜2W 4W 8W功能性复合膜(FCF)2W 4W 8W 2d 4d 7d 0.21±0.02 0.27±0.01 0.32±0.02 0.23±0.01 0.27±0.05 0.32±0.01 0.21±0.04 0.28±0.03 0.31±0.03 0.22±0.03 0.28±0.02 0.32±0.03 0.26±0.02 0.36±0.03*0.44±0.01*0.25±0.01 0.29±0.02 0.31±0.01 0.23±0.03 0.28±0.02 0.32±0.02
讨 论
引导组织再生术在临床上已被证实具有确切的疗效,但在恢复牙周组织的生理功能和修复较大牙周缺损等方面还未达到所期望的目标[16,17]。近年来,生长因子的运用能明显促进牙周组织的修复和再生,但多数生长因子在体内易于稀释扩散或被蛋白酶降解,难以在组织修复的全过程中起到持续、稳定的促进作用,因此将药物控释技术应用于细胞载体,使生长因子稳定释放,可持续促进细胞的生长及分化,为牙周组织再生技术提供了新的研究空间和实验依据[18],因此复合了生长因子及药物缓释系统的功能性复合膜的研制成为热点[19,20]。
rhBMP2已被广泛认可是一种性能较好的生长因子,能够促进间充质干细胞的分化,在诱导牙周成骨细胞的形成及促进牙周软硬组织的修复方面具有理想的效果。右旋糖酐是一种天然生物材料,生物相容性好且价格便宜,赋予不同的功能基可以制备不同性能、不同包载和释药效能的微凝胶载体[21]。随着药物控释技术研究的进一步深入,右旋糖酐基生物材料通过改性可以制备出智能生物材料(smart materials or intelligence materials),因此是智能给药领域研究的热点。将rhBMP2与dex-GMA凝胶微球相结合的功能性复合膜,为生物膜的研制打开新的大门。笔者对膜材料的要求也不仅仅是机械屏障作用,设想复合了生长因子及缓释系统的生物膜在提供屏障作用的同时能够持续稳定地释放生长因子,来促进牙周膜干细胞分化,修复牙周组织缺损。既往实验所研制的FCF尚缺乏生物活性测试[13],本实验主要目的在于检测FCF的生物活性,为进一步开发及应用提供实验依据。本文通过对FCF及单纯壳聚糖膜对人PDLSCs增殖的比较,发现FCF浸提液及2周时的降解液能明显促进人PDLSCs生长,说明该膜对生长因子有确定的缓释作用,缓释作用时间在2周以上。其浸提液及2周降解液的细胞ALP活性明显高于其他组,说明其对细胞分化能力的促进同样具有优势作用。通过本文的研究,证实FCF符合引导组织再生生物膜的要求,其浸提液和降解液无明显细胞毒性,支持人PDLSCs的黏附及增殖,具有对组织细胞主动的诱导分化及加速生长的作用,符合细胞载体的基本要求,其缓释作用明确,对生长因子具有持续稳定的释放作用。

