SRSF1及caspase-3在口腔鳞癌中的表达及其意义
刘乐天 毛立民 王海侠 黄宇思
口腔鳞状细胞癌(OSCC)是口腔颌面部常见的恶性肿瘤之一,约占口腔恶性肿瘤的90%,是具有不同分化程度的鳞状上皮性恶性肿瘤,具有较高的侵袭性和早期广泛淋巴结转移倾向。当前治疗口腔鳞癌的以手术、放疗和化疗为主的综合序列治疗,虽然取得了一定程度的进步,但并未显著提高口腔鳞癌患者特别是已发生局部淋巴结转移的晚期肿瘤患者的五年生存率。因此,寻找新的可能与口腔鳞癌有关的生物标志物,阐明其侵袭和转移的机制,对于口腔鳞癌的防治具有积极意义。
富含丝氨酸/精氨酸剪接因子1(SRSF1)是SR蛋白家族的重要成员,参与前体蛋白mRNA的多种生理过程和肿瘤相关基因剪接的调控,通过调控肿瘤细胞的凋亡和增殖参与肿瘤的发生和发展[1]。其参与调节相当多的生物学途径,包括mRNA的剪接、稳定和翻译,miRNA的加工,蛋白质的SUMO化和核仁应激反应等[2],是第一个被证实与肿瘤直接相关的剪接因子[3]。caspase-3是caspase蛋白酶家族的重要成员,无论是内源性还是外源性凋亡途径,均需通过激活caspase-3诱导细胞凋亡,是凋亡执行的重要效应因子。目前关于SRSF1在口腔鳞癌中的表达及意义尚未见报导,其在口腔鳞癌中的表达机制及其与caspase-3蛋白在口腔鳞癌中的表达及相互作用亦不明确。本研究旨在通过检测SRSF1及caspase-3在口腔鳞癌中的表达情况,探讨二者在口腔鳞癌发生及发展中的作用及二者之间的相关性,为口腔鳞癌的临床诊断、治疗和判断肿瘤预后提供理论依据。
资料和方法
1.一般资料
所有标本均来自2016年10月到2017年12月之间的哈尔滨医科大学第一附属医院病理科存档的经口腔颌面外科手术中切取的组织标本(福尔马林固定,石蜡包埋),标本均经两名病理科医师双盲法阅片明确诊断结果。共69例口腔鳞癌病例,男49例,女20例,其中舌来源28例、牙龈12例,口底11例,唇6例,颊5例,其他来源6例,男49例,女20例。高分化鳞癌23例,男14例,女9例,年龄43~75岁;中分化鳞癌23例,男15例,女8例,年龄35~83岁;低分化鳞癌23例,男20例,女3例,年龄42~73岁。从口腔外科其他手术切取的正常口腔黏膜组织10例,男6例,女4例。4组年龄、性别比较无统计学意义(P>0.05)。
2.方法
(1)主要试剂:兔抗人SRSF1蛋白多克隆抗体、兔抗人caspase-3多克隆抗体购自北京博奥森生物技术有限公司。SP免疫组化试剂盒、DAB试剂盒购自北京中杉金桥生物技术有限公司。
(2)检测方法:免疫组织化学SP法,一抗稀释度经预实验检测均为1:200,用SP法免疫组化试剂盒操作,操作步骤根据试剂盒说明进行,每组实验均以PBS代替一抗作为阴性对照。
(3)结果判定:SRSF1蛋白染色阳性细胞为细胞核内呈现棕黄(褐)色,caspase-3蛋白染色阳性细胞为细胞质内呈现棕黄(褐)色。每张切片在高倍镜视野下计数细胞,按染色强度打分:0分为无色,1分为浅黄色,2分为棕黄色,3分为棕褐色。按阳性细胞百分比打分:阴性记0分,阳性细胞1%~10%记1分,11%~50%记2分,51%~75%记3分,>75%记4分。染色强度与阳性细胞百分比的乘积≥3分为免疫反应阳性。
3.统计学处理
应用SPSS22.0对数据进行处理,采用χ2检验和四格表的精准概率法判断SRSF1和caspase-3表达与各病理指标的相互关系,采用Spearman法分析SRSF1及caspase-3表达的相关性,P<0.05表示有统计学意义。
结 果
1.SRSF1蛋白检测结果
SRSF1蛋白主要定位于细胞核,在光镜下可见癌组织内细胞核呈不同程度的棕黄颗粒。SRSF1蛋白在OSCC和正常口腔黏膜上皮中的阳性表达率分别为75.4%(52/69)和40%(4/10)。两者之间的表达有统计学意义(P<0.05)。SRSF1蛋白在低分化鳞癌中的阳性率95.7%(22/23)高于中分化鳞癌的阳性率69.6%(16/23),而后者的阳性率高于高分化鳞癌60.9%(14/23),在三种病理分级的组织中表达有统计学意义(P<0.05)。SRSF1在有淋巴结转移的阳性表达率为92%(23/25),高于未见淋巴结转移中的阳性率65.9%(29/44),其表达与淋巴结是否转移有统计学意义(P<0.05)见表1。SRSF1在OSCC组织中的阳性表达情况见图1。
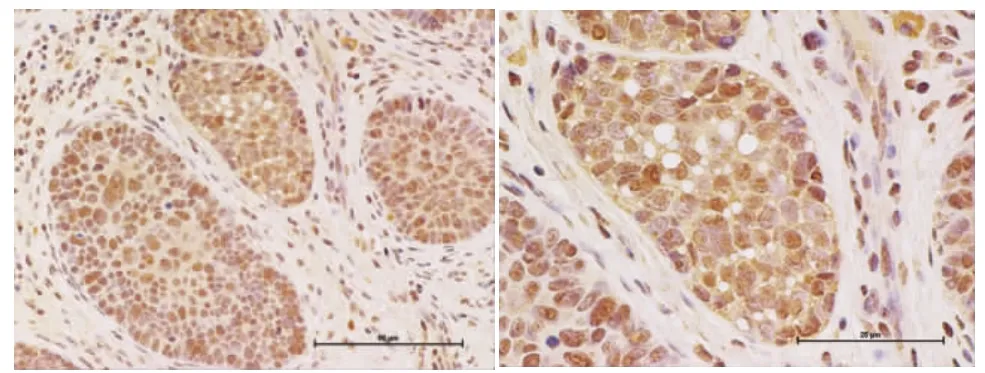
图1 SRSF1在口腔鳞癌组织中的阳性表达(DAB,×200 ×400)

表1 SRSF1在口腔鳞癌中的表达及其与淋巴结转移的关系
2.caspase-3蛋白检测结果
Caspase-3蛋白主要表达于细胞质,在光镜下可见阳性表达细胞的胞质内呈不同程度的棕黄颗粒。其在OSCC和正常口腔黏膜上皮中的阳性表达率分别为 31.9%(22/69)和 90.0%(10/69),两者之间的表达有统计学意义(P<0.01)。Caspase-3蛋白表达与肿瘤的病理分级有关(P<0.05),在低分化鳞癌中的阳性率13.0%(3/23)低于中分化鳞癌的阳性率30.4%(7/23),而后者的阳性率低于高分化鳞癌52.2%(12/23)。经检测,caspase-3蛋白的表达与肿瘤是否存在淋巴结转移无统计学关系(P>0.05)见表2。Caspase-3在OSCC组织中的阳性表达情况见图2。
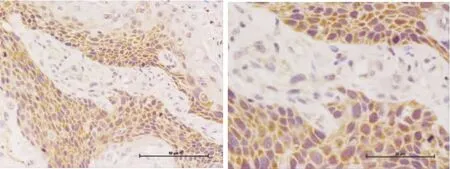
图2 caspase-3在OSCC组织中的阳性表达(DAB,×200 ×400)
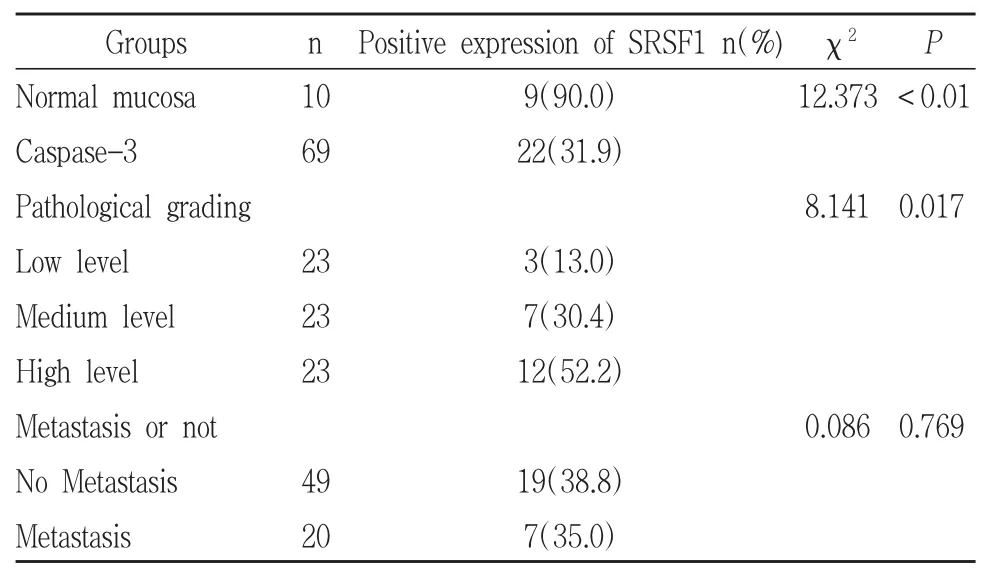
表2 caspase-3在口腔鳞癌中的表达及其与淋巴结转移的关系
3.SRSF-1与caspase3表达的相关性
52例SRSF1表达阳性的OSCC组织中有36例Caspase3表达阴性(36/52,69.2%),而 17例 SRSF1表达阴性组织中有10例Caspase-3阳性表达(10/17,58.8%),两种蛋白表达均为阳性16例,两种蛋白表达均为阴性7例,进行相关性分析(Pearson相关系数 r=-0.249,P=0.039,P<0.05) 见表 3,提示OSCC组织中SRSF1与Caspase-3表达呈负相关。
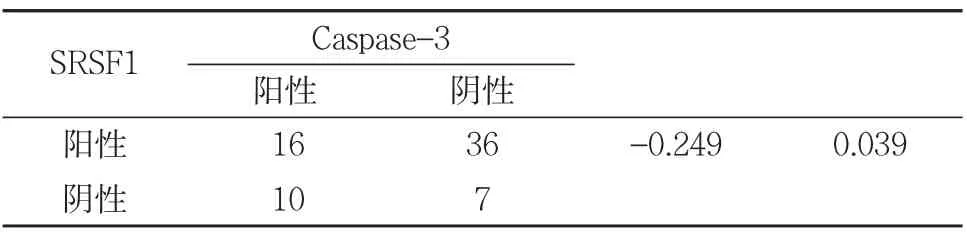
表3 口腔鳞癌中SRSF1与caspase-3表达的关系
讨 论
富含丝氨酸/精氨酸蛋白即SR蛋白是一组参与基因组成性剪接和选择性剪接的系统发育保守的蛋白质家族[4]。其在基因表达各个步骤的相互作用中起到了额外的作用[5]。丝氨酸/精氨酸剪接因子1(SRSF1,也称为SF2/ASF)是剪接调节剂的SR蛋白家族的成员。其在维持细胞的基本生命活力方面发挥重要作用。同时,SRSF1可以通过识别和结合外显子剪接增强子(ESE)来调节选择性剪接,近年来的研究表明其参与调节mRNA稳定性、输出、无义介导的mRNA衰减、翻译和miRNA的加工[6]。SRSF1调节选择性剪接事件被认为有助于肿瘤的发生。其在恶性肿瘤中可以调节细胞的运动和侵袭,可能与肿瘤的转移有关[7]。同时,SRSF1的失活或丢失会导致G2期细胞周期停滞和程序性细胞死亡,对于维持肿瘤的早期稳定性起到了至关重要的作用[8]。SRSF1被认为是一种原癌蛋白,在既往研究中被证明在乳腺肿瘤中的表达水平上调,并通过调节选择性剪接促进乳腺细胞的转化[9]。此外,其在肺肿瘤、结肠肿瘤、小肠肿瘤、肾肿瘤、甲状腺肿瘤、肝肿瘤、胰腺肿瘤、系统性红斑狼疮以及急性淋巴细胞白血病中存在过表达现象[10~15]。
Caspase(cysteinyl aspartate specific proteinase)家族,即半胱氨酸天冬氨酸特异性蛋白酶家族,是细胞凋亡过程中重要的凋亡促进因子。当Caspase蛋白活性受抑制可诱发细胞凋亡障碍,即细胞与增殖间动态平衡失调,可能促进多种肿瘤发生、发展。而Caspase-3是Caspase家族中的最重要凋亡者之一,可以通过细胞内或细胞外途径促进细胞的凋亡[16],是凋亡过程中的主要效应因子,同时其是引起细胞凋亡的最下游成分。它的活化是凋亡进入不可逆阶段的标志[17]。
现有学者研究证实SRSF1与细胞凋亡因子之间存在作用关系[18],其可以通过调控Bcl-X和caspase激活的DNA酶抑制蛋白(inhibitor of caspase activated DNase,ICAD)的剪接影响肿瘤细胞的生长与凋亡[19]。在人非小细胞肺癌(non-small cell lung cancer,NSCLC)中,SRSF1 可以增加抗凋亡蛋白survivin mRNA的稳定性,提高其翻译活性和表达,通过抑制促凋亡的caspse蛋白抑制肺癌细胞的凋亡[20]。同时本研究结果显示 SRSF1及caspase-3在口腔鳞癌组织中的表达呈负相关(r=-0.249,P=0.039,P<0.05),表明 SRSF1 可能通过某种通路抑制了caspase-3蛋白的表达,提示二者关系密切,共同调控口腔鳞癌细胞的凋亡,并在口腔鳞癌发生发展过程中发挥了重要的作用。
综上所述,SRSF1在口腔鳞癌组织中高表达,且其表达程度与病理分级以及肿瘤的转移有关。Caspase-3蛋白与SRSF1的表达程度呈负相关。提示SRSF1可以作为新的肿瘤标志物,与caspase-3联合用作口腔鳞癌的诊断、治疗以及预后状况的判断。

