KSHV RTA通过上调宿主细胞survivin表达促进病毒子代产生*
高建明, Erle S. ROBERTSON
(1三峡大学医学院生理与病理生理学系, 湖北 宜昌 443002;2宾夕法尼亚大学医学院微生物学系, 美国 宾夕法尼亚州 费城 19104)
卡波西肉瘤相关疱疹病毒(Kaposi sarcoma-associated herpesvirus,KSHV)又称γ-疱疹病毒8型,被发现于1994年,与卡波西肉瘤(Kaposi sarcoma)、原发性渗出性淋巴瘤(primary effusion lymphoa,PEL)和多中心卡斯特曼病(multicentric Castleman disease)有关[1]。
复制及转录激活因子(replication and transcription activator,RTA)是卡波西肉瘤病毒开放阅读框50编码的一种即刻早期蛋白,是促使病毒从潜伏性感染向裂解性复制转变的关键调控因子[2]。我们已经报道KSHV RTA能够增强存活蛋白(survivin)基因启动子活性,上调宿主细胞的survivin表达[3], survivin基因启动子区域的GC/Sp1和p53顺式元件对RTA上调宿主细胞survivin表达具在重要作用[4]。本文进一步探讨KSHV RTA介导的survivin表达上调对宿主细胞增殖、凋亡、病毒子代产生及裂解基因表达的影响。
材 料 和 方 法
1 抗体与细胞
抗survivin小鼠单克隆抗体购自Santa Cruz;抗GAPDH抗体购自Novus Biologicals;偶联IR Dye 800的羊抗鼠IgG购自Rockland。BJAB为KSHV和EB病毒均阴性的B细胞淋巴瘤细胞系;JSC是感染KSHV的B细胞淋巴瘤细胞系。
2 实验方法
2.1RNA干扰慢病毒载体的构建 Survivin小发夹RNA(small hairpin RNA,shRNA)用shSur表示;对照shRNA(control shRNA)以shC表示;pGIPZ 是一种shRNA慢病毒载体,用来表达survivin shRNA,均购自Open Biosystems。RNA干扰慢病毒载体构建实验方法已在相关文献中详细报告[5],本研究中,我们构建了JSC-shSur细胞、BJAB-shSur细胞及其对照JSC-shC细胞和BJAB-shC细胞。
2.2Western blot实验 JSC-shSur细胞、BJAB-shSur细胞及其对照细胞用20 μg/L 12-氧-十四烷酰佛波醇-13-乙酸酯(12-O-tetradecanoylphorbol-13-acetate, TPA)和1.5 mmol/L butyrate诱导,培养48 h收集细胞,加入RIPA 缓冲液裂解,用Bradford 比色法测定蛋白浓度。取相同质量的细胞裂解液上样,行SDS-PAGE,转移蛋白样品至PVDF膜,分别用抗survivin抗体、抗GAPDH抗体及偶联IR Dye 800的羊抗鼠IgG II抗进行Western blot实验。用Odyssey红外线成像系统(LI-COR Biosciences)观察结果。
2.3病毒子代DNA的PCR扩增 JSC-shSur细胞及其对照JSC-shC细胞经TPA诱导后培养48 h,离心弃细胞,用0.45 μm 孔径的过滤器收集上清, 23 500 r/min离心20 min沉淀病毒颗粒。加50 μL 0.2× PBS重悬病毒颗粒,95 ℃ 15 min,加入1 μL 蛋白酶K(10 g/L)于56 ℃孵育1 h,95 ℃ 30 min灭活蛋白酶K。取5 μL 病毒裂解液作模板,PCR扩增KSHV编码的K9,K9引物见表1。以JSC细胞中分离的KSHV基因组DNA为对照。PCR产物条带的灰度采用Kodak 1D 3.6软件定量。
2.4Real-time PCR实验 JSC-shSur细胞和JSC-shC细胞经TPA诱导后培养24、48和72 h,用TRIzol(Invitrogen)法细胞总RNA抽提,以高容量RNA-to-cDNA试剂盒(Applied Biosystems)逆转录合成cDNA。用SYBR Green实时荧光定量PCR试剂盒(Applied Biosystems)进行PCR 扩增,病毒裂解基因ORF57、TK 及内参照GAPDH的引物序列见表1。10 μL体系含5 μL Master Mix、 1 μL 5 μmol/L的引物和4 μL稀释的cDNA。反应条件: 95 ℃变性5 min; 95 ℃ 30 s, 55 ℃ 30 s, 72℃ 30 s,30个循环。每个样品重复3次。数据采集与分析使用StepOnePlus 实时荧光定量PCR系统(Applied Biosystems)。

表1 PCR扩增引物序列
2.5流式细胞术检测细胞凋亡 收集细胞(1×109/L),1 000 r/min离心5 min,弃去培养液。3 mL PBS洗涤1次。离心去PBS,加入冰预冷的70%的乙醇固定,4 ℃过夜。离心弃去固定液,PBS重悬细胞。加入终浓度50 mg/L PI(Sigma)和1 mg/L RNA酶于4 ℃避光染色1 h。用FACSCalibur流式细胞仪(Becton Dickinson)检测细胞凋亡,采用FlowJo软件分析数据。每个样本重复测定6次。
3 统计学处理
采用SPSS 20.0进行统计学分析。计量资料以均数±标准差(mean±SD)表示。两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 RTA介导的宿主细胞survivin表达上调促进病毒子代产生
Survivin是调节细胞凋亡的重要分子,RTA能够上调survivin表达,因此我们推测RTA介导的survivin表达上调具有抑制宿主细胞的凋亡和促进病毒子代产生的生物学功能。为此,我们应用慢病毒介导的RNA干扰技术构建了survivin抑制的稳定细胞株JSC-shSur和BJAB-shSur及其对照细胞JSC-shC和BJAB-shC。Western blot分析证实JSC-shSur细胞和BJAB-shSur细胞的survivin表达水平均比对照组明显降低,见图1A。JSC-shSur细胞经TPA诱导后培养48 h,制备细胞的病毒悬液,PCR扩增KSHV 编码的K9基因,以K9拷贝数代表病毒子代产生水平,结果显示JSC-shSur细胞的病毒子代产量分别为其2种对照细胞JSC-shC和JSC细胞的1/3和1/9(P<0.05),见图1B。这表明RTA能够利用survivin信号通路促进宿主细胞病毒子的产生。

Figure 1.RTA-mediated survivin up-regulation promoted the production of virus progeny. A: Western blot showed survivin expression in survivin knockdown cells and control cells; B: virus lysates of TRA and butyrate-induced JSC-shC cells and JSC-shSur cells were prepared after induction for 48 h to analyze the production of KSHV progeny by PCR. KSHV genomic DNA isolated from the JSC cells served as control. Mean±SD. n=6. *P<0.05 vs JSC control or JSC-shC-IN group.
2 RTA介导的宿主细胞survivin表达上调促进病毒裂解基因表达
Real-time PCR结果表明,JSC-shSur细胞经TPA诱导后24~72 h,病毒裂解基因ORF57和TK的表达水平逐渐升高,但JSC-shSur细胞2种裂解基因的表达水平在诱导后48 h和72 h均显著低于survivin表达正常的对照组JSC-shC细胞(P<0.05),见图2。

Figure 2.RTA-mediated survivin up-regulation promoted the expression of KSHV lytic genes. Real-time PCR was used to analyze the ORF57 and TK transcripts in induced and uninduced JSC-shC and JSC-shSur cells. Mean±SD. n=6. *P<0.05 vs JSC-shC group.
3 RTA介导的宿主细胞survivin表达上调延缓宿主细胞凋亡
KSHV阴性细胞BJAB-shC与BJAB-shSur经TPA诱导24 h,细胞凋亡率分别为7.0%和10.9%;TPA诱导48 h,细胞凋亡率分别为55.0%和57.7%,在相同时点,2种细胞诱导后的凋亡率差异无统计学显著性。KSHV阳性细胞JSC-shC与JSC-shSur经TPA诱导24 h后细胞凋亡率分别为32.0%和39.6%;TPA诱导48 h的细胞凋亡率分别为74.0%和85.2%。在相同时点,2种细胞诱导后的凋亡率差异有统计学显著性(P<0.05),见图3。
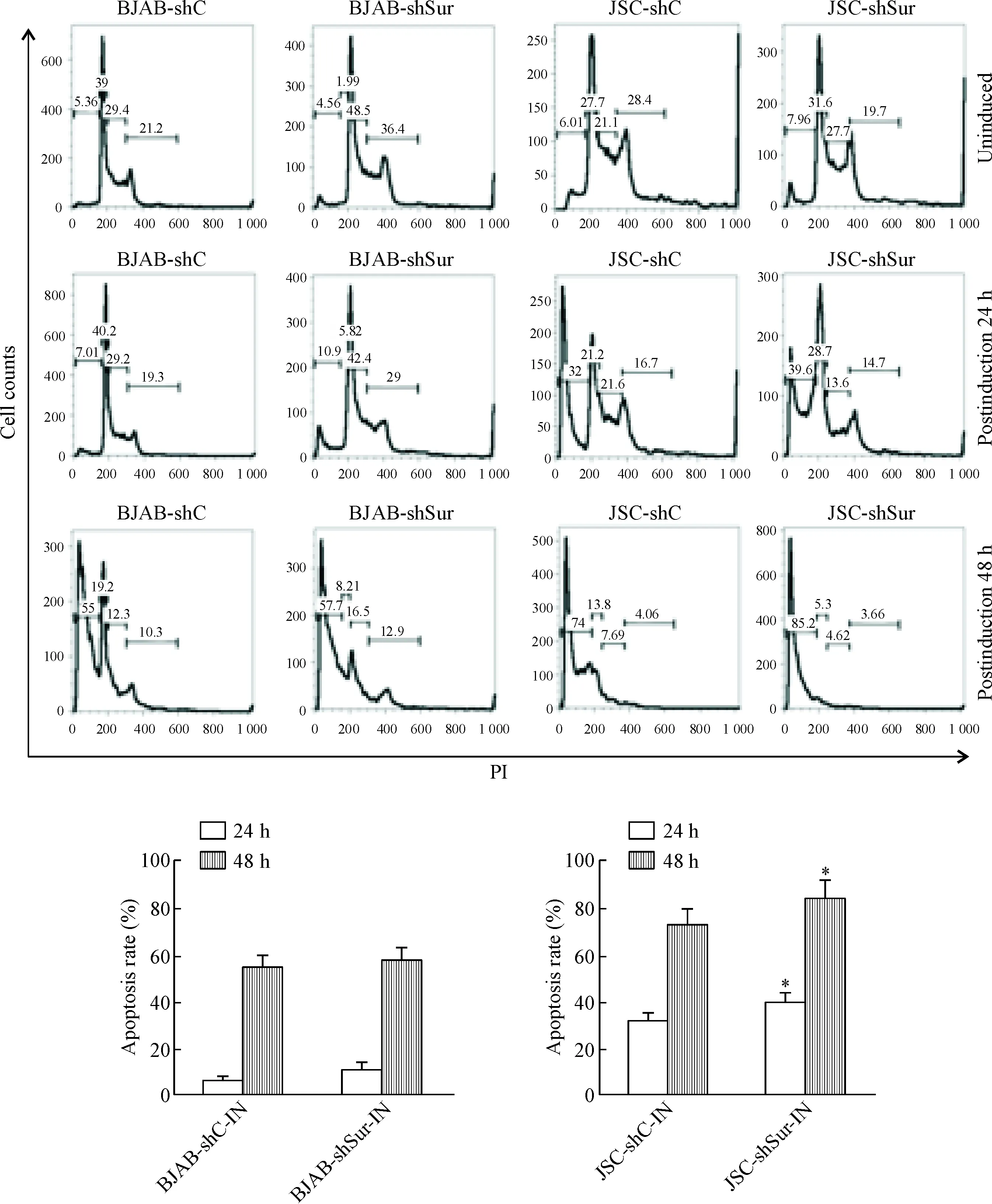
Figure 3.Survivin knockdown enhanced the apoptosis of TPA and butyrate-induced KSHV-infected cells. Mean±SD. n=6. *P<0.05 vs JSC-shC-IN group.
讨 论
KSHV存在2种不同的生活周期,即潜伏性感染与裂解性复制[6-7]。病毒在潜伏性感染时以游离体的形式存在,只表达少数潜伏基因;在裂解性复制期,感染性病毒子代释放,一系列病毒编码基因以级联反应的方式激活,调控多种细胞信号转号通路[2, 8-9]。KSHV阳性细胞经TPA诱导后1 h就可检出RTA的表达[10]。无论是外源性还是内源性来源引起的RTA表达增高,均可介导病毒裂解性基因的级联表达[11]。
Survivin是哺乳动物凋亡抑制蛋白家族的一个成员,具有抑制细胞凋亡及参与细胞有丝分裂调控的双重功能[12]。感染细胞的凋亡是机体抗病毒的一种防御机制;反之,病毒亦可通过多种途径干扰机体介导的感染细胞的凋亡。我们的前期研究发现KSHV RTA能够与survivin基因启动子结构中的GC/Sp1和p53 顺式元件相互作用,上调宿主细胞survivin表达[3-4]。
应用RNA干扰技术抑制survivin表达后, KSHV阳性的JSC细胞经TPA诱导后与对照组细胞相比病毒子产生减少,裂解基因表达下调,凋亡率增加。由此可见RTA介导的survivin表达上调可以延缓宿主细胞的凋亡,促进病毒的裂解性复制,有利于病毒的生存与传播。

