卵巢占位,下肢深静脉血栓,感染性心内膜炎:一场与“出凝血紊乱”的赛跑
赵多多,苗 齐,刘兴荣,陈跃鑫,曹 玮,徐 燕,王小亭,江 欣,黄宇光,潘凌亚,金 滢,庄俊玲0
中国医学科学院 北京协和医学院 北京协和医院 1内科 2心外科 3血管外科 4感染内科 5呼吸内科6重症医学科 7输血科 8麻醉科 9妇产科 10血液内科, 北京 100730
1 病历简介
患者女性,56岁,主诉“发现卵巢囊肿5年,双下肢肿痛3个月”,于2017年06月23日收住北京协和医院妇产科。
1.1 现病史
2012年患者体检发现卵巢囊肿,约3 cm×3 cm大小,未复查。2017年3月初无诱因出现双下肢肿痛,当地医院行血管超声检查,结果示双下肢大隐静脉血栓、左胫后静脉血栓,予口服华法林抗凝治疗。4月1日因出现全身红斑、瘙痒,停止口服华法林,改为口服利伐沙班(10 mg×2次/d)。4月23日出现咳血、牙龈出血,改用低分子肝素钙(5000 IU×2次/d)皮下注射。4月28日出现胸闷憋气,当地医院行肺动脉CT血管造影提示肺栓塞(pulmonary embolism,PE),予放置下腔静脉滤网,改服达比加群酯。5月底复查D-二聚体9.73 mg/L,癌抗原125 1902.21 U/ml。下肢静脉超声检查示左侧股总、股浅、股深、腘静脉实质性回声充填,左侧大隐静脉可见部分血栓形成,右下肢深静脉无明显异常。超声心动图示左室射血分数68.1%,左室增大,主动脉瓣中度关闭不全。妇科超声检查示盆腔8.6 cm×8.3 cm×5.2 cm囊实性回声。正电子发射断层显像/计算机体层成像(positron emission tomography/computed tomograghy,PET/CT)提示子宫前方囊实性肿块,8.8 cm×5.8 cm,代谢活跃,考虑为恶性病变。给予利伐沙班(10 mg×2次/d)、贝前列素片(40 μg×3次/d)、替米沙坦(80 mg×3次/d)及利尿治疗。患者入院前1个月体重下降5 kg。
1.2 既往史
患者有高血压病,开腹子宫肌瘤切除手术史,输血史,阿司匹林过敏史。
1.3 个人史及家族史
月经史:15岁初潮,月经周期及经量正常,51岁自然绝经,围绝经期间断口服“妈富隆、大豆异黄酮”等药物3年。绝经后无阴道出血。
婚育史:孕2产1。
家族史:父母及妹妹均有心血管系统疾病。
1.4 入院查体
血压 113/60 mm Hg(1 mm Hg=0.133 kPa),呼吸19次/min,脉搏 88次/min,血氧饱和度 95%,体重80 kg,体质量指数 31.25 kg/m2。心肺听诊无特殊,各瓣膜区未闻及明显杂音。腹部可见纵行手术疤痕,腹软,未及明显包块,无压痛、反跳痛,肝脾肋下未及。双下肢、双足可凹性水肿。双合诊:子宫左上方可触及7~8 cm囊实性包块,边界清,活动可,无压痛。
1.5 诊疗经过
入院后查血常规示白细胞 5.47×109/L,血红蛋白124 g/L,血小板(blood platelet,PLT) 39×109/L,凝血指标:血浆凝血酶原时间(prothombin time,PT)17.7 s, 活化部分凝血活酶时间(activited partial thomboplastin time,APTT)38.2 s, D-二聚体 2.97 mg/L,空腹血糖(fasting blood glucose,FBG) 0.61 g/L。血生化无异常。抗核酸抗原抗体、抗心磷脂抗体、抗β2-糖蛋白1、狼疮抗凝物均(-)。6月24日停用利伐沙班,改用低分子量肝素 (low molecular weight heparin,LMWH)(6000 U×2次/d)抗凝后监测PLT 60×109/L左右,FBG 1.3~1.5 g/L;APTT 50~70 S,D-二聚体1~2 mg/L,间断输注PLT、纤维蛋白原支持治疗。住院期间患者再发胸闷憋气,血氧饱和度下降(86%),复查肺动脉CT血管造影仍提示多发PE(图1)。下肢血管彩色多普勒超声提示左侧股总、股浅、腘静脉新发血栓形成。7月13日超声心动图示左室射血分数 59 %,主动脉根部增宽,主动脉瓣轻度狭窄并重度关闭不全,左心增大,轻度二尖瓣关闭不全,轻度肺高压。7月8日起改为普通肝素(unfractionated heparin,UFH)抗凝,根据APTT(目标50~70 s)调整为10~18 U/(kg·h)泵入维持。7月12日起咳少量鲜血痰。
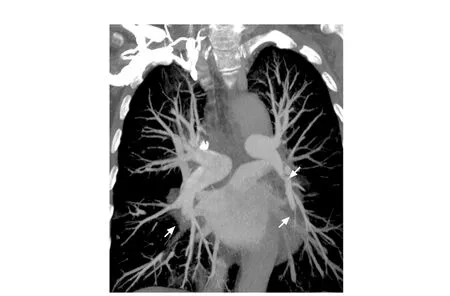
图 1 肺动脉CT血管造影(2017年7月)示双肺动脉分支内多发低密度充盈缺损,提示多发肺栓塞(箭头)
2 第一次多学科讨论
2.1 妇产科
患者中年女性,慢性病程,盆腔包块进行性增大,癌抗原125显著升高,PET/CT提示卵巢局部高摄取,考虑恶性肿瘤可能大,有手术切除指征。但患者存在深静脉血栓(deep venous thrombosis, DVT)、PE,且有弥散性血管内凝血(disseminated intrava-scular coagulation,DIC)可能,考虑肿瘤继发高凝倾向所致,若不切除肿瘤,出凝血异常难以控制;若行手术,则术中出血风险大,且围手术期停用抗凝,手术应激可能致血栓和PE加重甚至危及生命。因此请相关科室协助制定围手术期出凝血管理方案。
2.2 血液内科
患者DVT、PE明确,存在恶性肿瘤基础,入院后FBG、PLT降低、D-二聚体升高,抗凝治疗有效,均支持肿瘤继发慢性DIC的诊断。如不对肿瘤进行控制,出凝血失衡难以纠正。患者曾应用LMWH抗凝,但因体重大、药物分布异常等原因未达到预期效果,仍有新发血栓形成,理论上可通过检测Xa因子活性调整剂量。围手术期可改为UFH持续泵入,根据APTT监测抗凝效果调整剂量。UFH抗凝后FBG升高,PLT稳定,说明抗凝有效。同时应注意监测PLT,警惕肝素诱导的血小板减少症(heparin-induced thrombocytopenia, HIT)。外科患者更容易出现HIT,与手术打击易诱发产生PLT因子4抗体有关,且UFH抗凝后凝血指标已有改善,不支持HIT诊断。患者围手术期高危因素多,可术前2~4 h停用UFH,如监测APTT比值<1.5,可行手术,且术后12 h腹腔如无活动性出血,应尽早恢复UFH抗凝治疗。
2.3 呼吸内科
对比我院(2017年7月7日)与外院(2017年4月)肺动脉CT血管造影结果,未见明确新发栓塞,但双肺明显小叶间隔增厚,考虑慢性DIC、微循环内瘀血、静脉扩张等所致肺水肿。结合脑钠尿肽升高,可给予利尿治疗,维持液体负平衡。目前咳血考虑与APTT延长有关。呼吸道方面暂无明确手术禁忌,同意血液内科围手术期抗凝治疗方案。
2.4 血管外科
患者2017年3月出现下肢DVT,给予抗凝治疗后发生PE,进而放置下腔静脉滤网。同意围手术期抗凝方案,术前应完善腹部盆腔CT血管造影,查看滤网位置及周边有无新发血栓形成;如滤网位置偏斜,则降低过滤血栓效果;如滤网上方有新生血栓形成,则有继发严重PE、呼吸、心脏骤停风险,必要时可再次放置滤网,但困难较大。
2.5 麻醉科
患者围手术期手术、麻醉风险较高,行全麻手术应充分告知患者风险。
2.6 输血科
患者凝血功能异常,术前可输注PLT 2 U,术中必要时再给予PLT、新鲜冰冻血浆和红细胞。术后根据出血和凝血指标补充。
3 第一次多学科讨论后处理
完善腹部盆腔CT血管造影,见下腔静脉滤网位置尚可,未见血栓形成。
7月14日全麻下行“经腹全子宫+双附件+大网膜+阑尾切除术”。术中发现盆腔包块来源于左卵巢,直径约10 cm,实性为主,表面光滑,少量黄色腹水。术后病理:(左附件)符合卵巢透明细胞癌, 卵管未见特殊(图2);免疫组化结果示PAX- 8(+),胰岛素样生长因子ⅡmRNA结合蛋3 (-),癌抗原125(+),雌激素受体(-),Ki- 67(index 30%),P16(散在+),P53(-),孕激素受体(+),Wilms瘤基因产物- 1(-),肝细胞核因子1b(+);子宫平滑肌瘤;(腹水)找到瘤细胞。
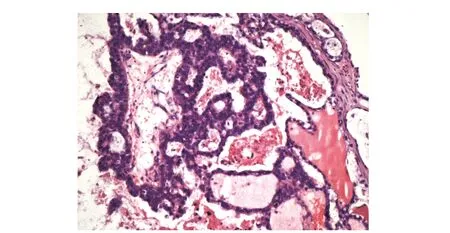
图 2 子宫、双附件切除术后病理符合卵巢透明细胞癌(HE染色,×10)
术后先后予UFH、LMWH抗凝,予血浆、人纤维蛋白原输注,监测患者PT、APTT、纤维蛋白原浓度、PLT逐渐恢复正常。
7月21日予第一程紫杉醇+卡铂化疗。7月23日出现发热,体温38.2~39.2 ℃,伴咳嗽、咳黄白色痰且带有血丝,胸闷、憋气逐渐加重,夜间不能平卧,血常规示白细胞 20.45×109/L,中性粒细胞比例97.4%,氨基末端脑钠肽前体20 000~56 000 pg/ml,痰细菌培养提示肺炎克雷伯菌、鲍曼不动杆菌,对头孢类、亚胺培南等药物敏感;考虑肺部感染,予亚胺培南西司他丁钠(泰能)抗感染。7月26日起体温正常,仍有胸闷憋气,体格检查双肺呼吸音粗,闻及胸骨左缘3~4肋间Ⅱ~Ⅲ级收缩期杂音,复查超声心动图:左室射血分数 38 %;主动脉瓣病变(无冠瓣、右冠瓣可见8.9 mm×9.0 mm、7.9 mm×8.0 mm团块状赘生物)、重度主动脉瓣关闭不全;双房、左室增大;轻度二、三瓣关闭不全。血需氧菌及厌氧菌培养3次均(-)。考虑感染性心内膜炎可能性大、心功能不全, 7月28日起予哌拉西林钠他唑巴坦钠(特治星)+阿米卡星,7月31日改为头孢曲松钠(罗氏芬)抗感染。期间监测白细胞(18→2.7)×109/L,中性粒细胞计数(20→0.8)×109/L,血红蛋白(115→90)g/L,PLT在正常范围内。
4 第二次多学科讨论
4.1 妇产科
患者术后病理提示卵巢透明细胞癌,腹水发现瘤细胞,FIGO分期IC期,术后已给予紫杉醇+卡铂化疗1程(计划给予4~6程),文献报道其5年生存率>50%[1]。术后出现肺部感染,抗感染后体温控制。目前表现心功能不全,主动脉瓣赘生物形成,考虑感染性心内膜炎可能性大。目前妇科情况和凝血指标稳定,但心脏瓣膜问题可能危及生命,待多科讨论下一步治疗计划。
4.2 感染内科
患者术后出现发热及新发心脏瓣膜赘生物,根据改良Dukes标准,患者目前符合1条主要临床标准(瓣膜赘生物)及2条次要标准(发热、基础心脏瓣膜病变),诊断感染性心内膜炎可能性大。建议罗氏芬联合阿米卡星治疗,监测体温,警惕药物副作用。但目前主动脉瓣重度关闭不全且瓣膜赘生物已显著影响心功能,请心外科评估明确手术指征。如患者原发病预期生存期较长,应积极推进手术。
由于存在血栓高危因素,多次血培养均未获得病原学证据,因此鉴别疾病不能除外瓣膜血栓。
4.3 心外科
患者术后出现发热,心功能进行性下降至Ⅳ级。与术前心脏超声比对,新出现主动脉瓣膜赘生物,考虑感染性心内膜炎诊断相对明确。虽然无右心衰、肺动脉高压表现,但氨基末端脑钠肽前体最高>50 000 pg/ml,左心衰严重,随时危及生命,保守治疗难以纠正,有心脏瓣膜置换指征。妇科肿瘤预期生存期至少1年,因此具有心脏手术价值。患者心功能差,术后可能需体外循环支持,血栓、出血、感染等问题也可能随之加重。如患者及家属接受手术风险,可于术后转入重症医学科,并继续抗凝治疗。
4.4 血液内科
患者PE、DIC与肿瘤相关,目前妇科肿瘤已切除,PLT、纤维蛋白原升至正常,抗凝治疗风险较小。同意各科室提出感染性心内膜炎诊断,且高凝状态易于形成瓣膜周围血栓,需警惕特鲁索综合征。鉴别疾病包括无菌性血栓性心内膜炎(nonbacterial thrombotic endocarditis,NBTE)不能除外。同意心外科意见,尽快进行瓣膜置换术,术后继续抗凝。另外患者白细胞下降,考虑为化疗副反应,建议予粒细胞集落刺激因子治疗至中性粒细胞>1.5×109/L可停药。
4.5 呼吸内科
患者胸部CT示左下肺叶、右舌叶有新发影,痰细菌培养提示肺炎克雷伯菌、鲍曼不动杆菌等多种细菌,考虑肺内感染,同意目前抗生素方案。患者围手术期有肺内感染加重、脱机困难等风险,需向家属充分交待。
4.6 麻醉科
患者围手术期高风险,涉及术中插管、术后呼吸道管理问题;肺功能差,手术拟解决心功能不全;术后需机械通气、转入重症医学科进一步支持治疗。
5 第二次多学科讨论后处理
转入心外科后于8月4日行“主动脉瓣机械瓣置换、左右心辅助泵安装术”,术中可见主动脉瓣各瓣叶左室面均有赘生物,瓣周未见钙化、脓肿。术后病理:(主动脉瓣)瓣膜组织,一侧附大量不规则纤维素样坏死物,部分机化,伴泡沫细胞聚积及纤维组织增生;符合感染性心内膜炎所致瓣膜损伤表现(图3)。
术后体外膜肺氧合转运至重症医学科。病情稳定后于8月7日停止体外膜肺氧合,观察心功能无恶化后行手术关胸,术后继续予米力农强心,UFH抗凝,头孢哌酮钠舒巴坦钠、万古霉素、阿米卡星等抗感染治疗,疗程4周。
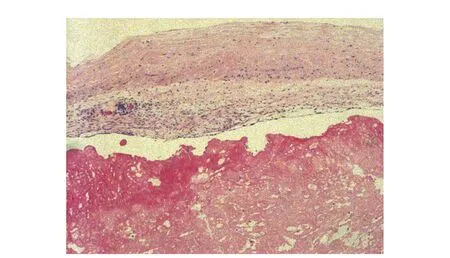
图 3 主动脉瓣置换术后病理符合感染性心内膜炎所致瓣膜损伤(HE染色,×10)
6 最终诊断
左卵巢透明细胞癌,特鲁索综合征,感染性心内膜炎可能性大
7 术后转归
术后恢复可,规律华法林2.25 mg×1次/d口服抗凝,心功能I级,复查超声心动图:左室射血分数59%;主动脉瓣人工机械瓣置换术后;瓣膜功能正常;左室松弛功能减低。2017年9月28日出院,按期返院行后续化疗。
8 讨论
本例患者卵巢癌诊断明确,以DVT、PE起病,围手术期新发血栓,与DIC并存,妇科手术及化疗后凝血指标稳定,后新发感染性心内膜炎,行心脏换瓣手术,继续抗凝和妇科肿瘤治疗。整个过程疑难复杂,出现多种并发症,治疗上矛盾重重。最终经多学科协作,转危为安。
对于不明原因多发血栓的患者需警惕恶性肿瘤可能。卵巢透明细胞癌是一种少见的卵巢上皮细胞来源恶性肿瘤,早期常无症状,20%~40%的患者会合并DVT及肺栓塞事件,是其他卵巢上皮细胞癌的2倍[1],与该患者的病史相符。恶性肿瘤是获得性静 脉 血 栓 栓 塞 症 (venous thromboembolism, VTE)的主要诱因之一。肿瘤患者发生VTE 的风险较非肿瘤患者至少增加 4~7倍[2],且存活率显著下降。VTE包 括 DVT和PE。1865年 Trousseau首先报道了一例胃癌合并静脉血栓,随后人们将恶性肿瘤合并游走性血栓性静脉炎称为特鲁索综合征。经典的特鲁索综合征包括恶性肿瘤合并慢性DIC、微血管病性溶血性贫血、疣状心内膜炎、血栓形成等,随后该定义逐渐扩展,目前认为恶性肿瘤合并下肢DVT即可诊断特鲁索综合征[3]。本例患者以下肢DVT、PE起病,进而发现盆腔占位,手术病理证实为卵巢透明细胞癌,符合特鲁索综合征的定义。
在本例患者诊治过程中,高凝倾向及凝血障碍是诊断难点,治疗上抗凝与手术也存在矛盾。第一次MDT讨论,确立了纠正出凝血障碍同时积极去除诱因的策略,为患者创造了手术机会。手术切除肿瘤后,出凝血异常基本纠正。关于肿瘤患者合并VTE的抗凝问题,根据2016美国胸科医师学会抗栓指南介绍,对于下肢DVT或PE并有活动期癌症(癌症相关血栓)患者,出血风险不高者,建议延长抗凝治疗[4]。国内外指南均首选LMWH,对于 LMWH 禁忌患者,新型口服抗凝药可作为二线方案用于VTE慢性期药物治疗。另外UFH半衰期短,可根据APTT调整剂量,适用于围手术期。如有抗凝绝对禁忌或抗凝后VTE复发,可放置下腔静脉滤网。
该患者术后发热且新发主动脉瓣赘生物,需鉴别感染性心内膜炎及NBTE。但由于主动脉瓣受累,心衰危及生命,根据2015年欧洲心脏病学会发布的指南,瓣膜功能障碍引发心衰为换瓣手术Ⅰ类适应证[5]。因此,第二次多学科讨论确立了积极抗感染同时尽快进行换瓣手术的策略。NBTE是指一系列心脏瓣膜的非感染性病变,最常见于晚期恶性肿瘤患者[6]。与感染性心内膜炎不同,NBTE患者常无发热,以全身栓塞为主要表现,高达50 %的NBTE患者会出现栓塞现象[7]。NBTE确诊需要尸检或手术标本明确赘生物为无菌性血小板血栓,而感染性心内膜炎的赘生物是由纤维蛋白、PLT、白细胞、红细胞碎片和密集的细菌群聚集形成的无定形物质。两者鉴别需结合术后病理,患者心内膜赘生物病理可见大量纤维素样坏死,而NBTE赘生物主要成分为聚集的血小板。尽管无病原学证据,结合累及左心系统、瓣膜损伤等特点[8],考虑感染性心内膜炎可能性大。NBTE的治疗通常包括全身抗凝以及治疗潜在恶性肿瘤或相关疾病。感染性心内膜炎的治疗以抗生素治疗为主,若无合并冠心病、房颤等其他需独立抗血栓治疗的疾病,则无需抗凝或抗PLT治疗。
本案例中多学科共同解决患者诊疗决策中的种种难题,处理了诊疗过程中出现的多种危重并发症,体现了多学科讨论在疑难病诊治中的必要性和有效性。
9 专家点评
血液内科庄俊玲教授
肿瘤相关性出凝血事件是临床医生应关注的问题,本例卵巢癌患者起病时血栓和DIC同时存在,说明矛盾的双方是一个问题的两个方面。“扬汤止沸,不如釜底抽薪”,除了积极抗凝和补充凝血因子之外,最根本的治疗在于去除肿瘤。肿瘤患者免疫力下降,易合并出现感染,多学科协作有益于临床转归。只有肿瘤得到满意控制,其他问题才能从源头上得到解决。

