围手术期营养干预加速胃肠外科术后康复:单中心前瞻队列研究
薛志刚,于健春,康维明,马志强,叶 欣,闫 超,李子建,蒋 林,林国乐,肖 毅,陆君阳,吴 斌,牛备战,裴丽坚,黄宇光
中国医学院科学院 北京协和医学院 北京协和医院 1基本外科 3麻醉科,北京 1007302中国医学院科学院 北京协和医学院研究生院, 北京 100005
加速康复外科(enhanced recovery after surgery, ERAS)指采用一系列有循证医学证据支持的围手术期优化措施,减少患者生理及心理应激,实现术后快速康复的过程。该理念最早由丹麦外科医生Kehlet和美国外科医生Wilmore提出[1- 2],后由黎介寿院士将其引入中国,进一步阐述了临床营养与ERAS的联系[3- 4]。此后国内外颁布了一系列ERAS在胃肠外科与结直肠外科的应用指南[5- 8],但临床实践与指南推荐之间尚存在一定差距[9- 11]。
ERAS流程应用于胃肠外科围手术期管理,可明确减少术后并发症、缩短术后住院天数(postoperative day,POD)、缓解术后疼痛、降低住院总费用[12- 16],而术前营养评估与干预和术后早期肠内营养是ERAS流程的关键环节[13,17- 18]。遗憾的是,围手术期营养评估与干预在胃肠外科中的研究十分有限。为此,我们设计了该项前瞻性队列研究,意在评估围手术期营养管理作为ERAS关键环节应用于胃肠外科的安全性和有效性。
1 对象与方法
1.1 研究对象
本研究为前瞻性队列研究,2015年12月至2018年4月间在北京协和医院基本外科接受手术治疗的胃肠道肿瘤患者连续纳入本研究,其中在胃肠与营养代谢专业组接受手术治疗的患者进入ERAS组,在其他专业组接受传统围手术期管理者进入对照组。
纳入标准:(1)拟行择期手术者;(2)年龄在18~80岁;(3)签署知情同意书。
排除标准:(1)年龄超过80岁;(2)存在严重合并疾病,包括严重心肺疾病、肝肾功能不全,或术后转入ICU;(3)合并代谢性疾病,如糖尿病,难以稳定控制者;(4)妊娠或哺乳期患者;(5)合并炎性肠病患者;(6)可能行急诊手术者;(7)拒绝参加研究者。
本研究获得北京协和医院伦理委员会的批准。
1.2 围手术期管理流程
1.2.1 ERAS组管理流程及营养干预环节
ERAS组管理流程:(1)在门诊及入院后术前宣教的同时进行术前焦虑评估。(2)术前采用营养风险筛查(Nutrition Risk Screening 2002,NRS 2002)量表筛查营养风险[19],存在营养风险者(NRS 2002评分≥3分)术前口服或管饲营养补充(oral nutrition supplement,ONS)作为营养预康复措施,每天通过肠内营养制剂额外补充热量超过500 kcal、连续补充超过3 d。(3)优化肠道准备:至少术前3 d予全肠内营养(exclusive enteral nutrition,EEN),肠道准备不满意者在EEN基础上予1/3~1/2标准剂量的聚乙二醇电解质散(深圳万和制药有限公司,标准剂量68.56 g/袋×2袋+1000 ml水)导泻。(4)缩短术前禁食禁饮时间:术前6 h禁食、术前2~3 h口服17.5%葡萄糖补液盐300 ml。(5)皮肤切开前和手术切口缝合前行切口局部浸润麻醉(罗哌卡因0.1 g/10 ml+利多卡因0.1 g/5 ml各1 ml混合)。(6)手术方式:腹腔镜手术,必要时转开腹手术;对全胃切除、胃瘫高风险如合并糖尿病、幽门梗阻以及老年患者,由于术后营养风险高、长期(超过30 d)肠内营养支持治疗的可能性较大,故选择性行空肠营养置管术或留置鼻空肠营养管,同时作为术后早期EN途径。(7)术中体温保护:加热补液,手术台加温床垫,术中向患者吹暖风。(8)术后镇痛:以非甾体类抗炎药为主,术后第1~3天(postoperative day 1- 3,POD1- 3)静脉注射,不使用或少使用阿片类药物镇痛。(9)不常规留置导尿管、胃管、引流管,或术后早期拔管(导尿管和胃管POD1- 2、引流管POD2- 3拔除)。(10)术后早期肠内营养:手术当天少量饮水,POD1- 2开始序贯肠内营养支持治疗,由多肽型逐步过渡到整蛋白型,逐步增加剂量和泵速。(11)术后当天或术后第1天床旁活动(表1)。
1.2.2 对照组管理流程
对照组为传统围手术期管理流程,具体包括:(1)常规门诊及入院后术前宣教。(2)机械性肠道准备:术前2~3 d口服聚乙二醇电解质散剂(标准剂量),肠道准备不满意者术前1 d口服40 ml硫酸镁溶液。(3)术前禁食禁饮至少6~8 h。(4)腹腔镜或开腹手术,术中不留置EN途径。(5)无特殊体温保护措施。(6)术后镇痛:以阿片类药物镇痛为主,多在盐酸曲马多注射液镇痛效果不佳基础上应用。(7)常规留置导尿管、胃管、引流管;引流管拔除时间:导尿管POD1- 2,胃管POD3- 5,引流管出院前1~2 d。(8)排气后逐步进食少量流质、半流质饮食,术后常规予以肠外营养(parenteral nutrition,PN)至少3 d。(9)术后第1天翻身,POD2-3床旁活动。
1.3 结局指标
主要结局指标为POD,次要结局指标为住院总费用、术后并发症Clavien-Dindo分级[20]Ⅱ级及以上比例、术后60 d再入院率。其中,术后感染相关并发症定义采用美国国家疾病控制预防中心关于“医疗相关感染并发症”的标准执行[21]。
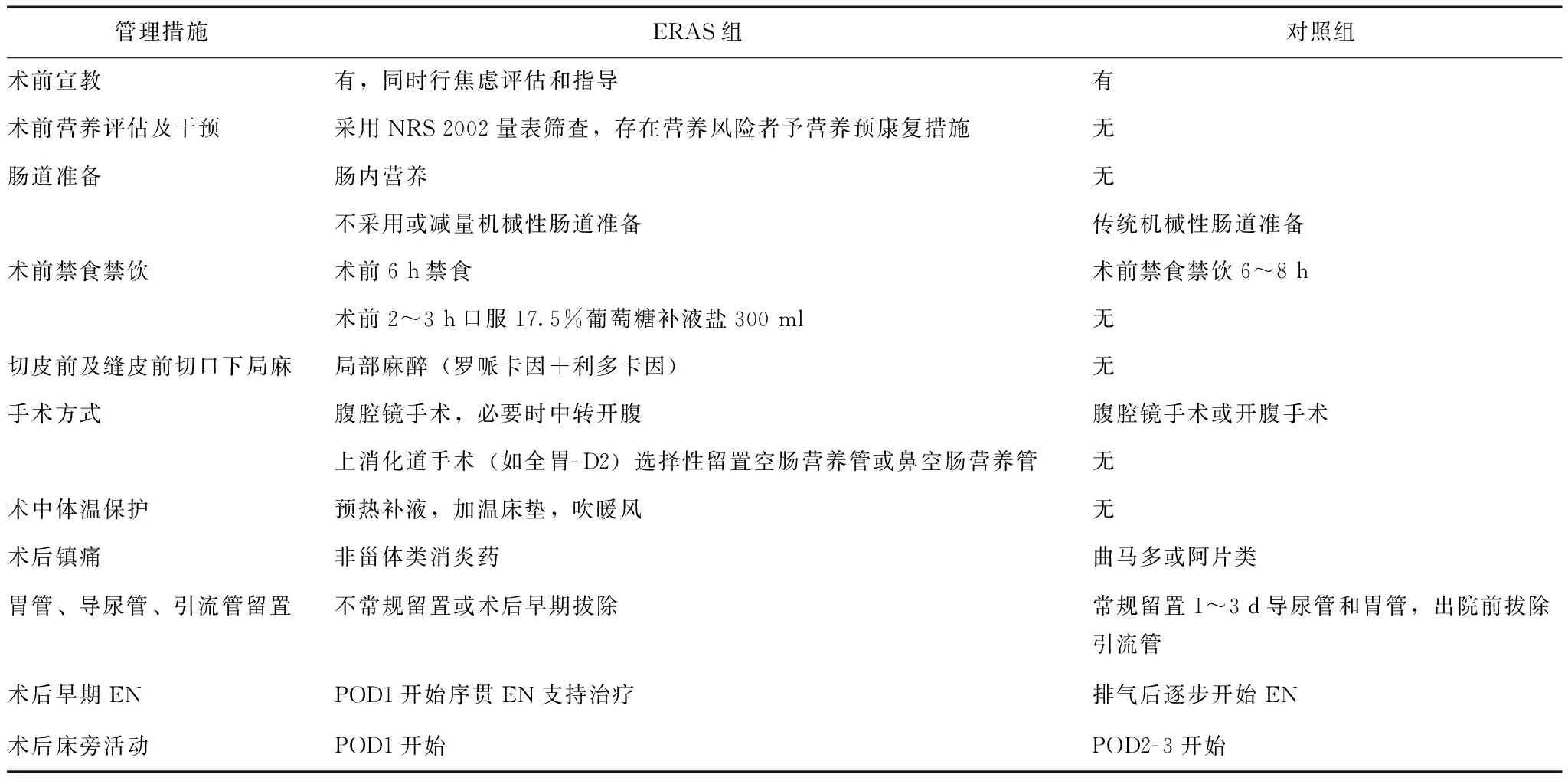
表 1 胃肠外科ERAS组与对照组围手术期流程主要措施比较
ERAS:加速康复外科; NRS:营养风险筛查; EN:肠内营养; POD:术后住院天数
1.4 统计学处理
统计分析采用SPSS 21.0软件。计数资料结果以百分数(%)表示,采用卡方检验或Fisher精确检验进行统计学分析;计量资料结果以均数±标准差或中位数(四分位数)表示,采用t检验或Mann- Whitney检验进行统计学分析,所有数据检验均为双侧。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
研究共纳入符合入选和排除标准的204例连续病例,其中ERAS组和对照组各102例。
两组患者的临床特征和基线资料无统计学差异(表2),ERAS组和对照组的患者年龄分别为(53.6±13.3)岁和(55.0±15.7)岁,男性比例分别为57.8%和54.9%,体质量指数(body mass index,BMI)分别为(23.76±4.59)kg/m2和(23.49±2.76)kg/m2。两组患者均为胃肠道肿瘤,以胃癌和结直肠癌为主,分别占64.7%和69.6%,此外还包括胃肠道间质瘤、神经内分泌肿瘤、淋巴瘤等。ERAS组术前营养风险筛查显示,存在营养风险(NRS 2002评分≥3分)者为54.9%(56/102),均予营养干预。
2.2 术后一般情况
ERAS组患者术后开始EN的时间早于对照组 [(2.4±1.8)d比(5.1±1.2)d,P<0.001],而应用PN的时间短于对照组 [(1.96±1.67)d比(6.03±1.92)d,P<0.001]。与对照组相比,ERAS组术后留置胃管和引流管的比例显著降低(68.6%比37.2%,99.0%比48.0%,P均<0.001),引流管留置时间明显缩短 [2(0,6)d比6(5,7)d,P<0.001],但胃管留置时间未见显著差异 [0(0,1)d比2(1,3)d,P>0.05]。ERAS组POD短于对照组 [(7.2±4.5)d比(9.8±4.8)d,P<0.001],住院总费用显著低于对照组 [(41 125±18 593)元比(51 512±19 453)元,P<0.001](表3)。
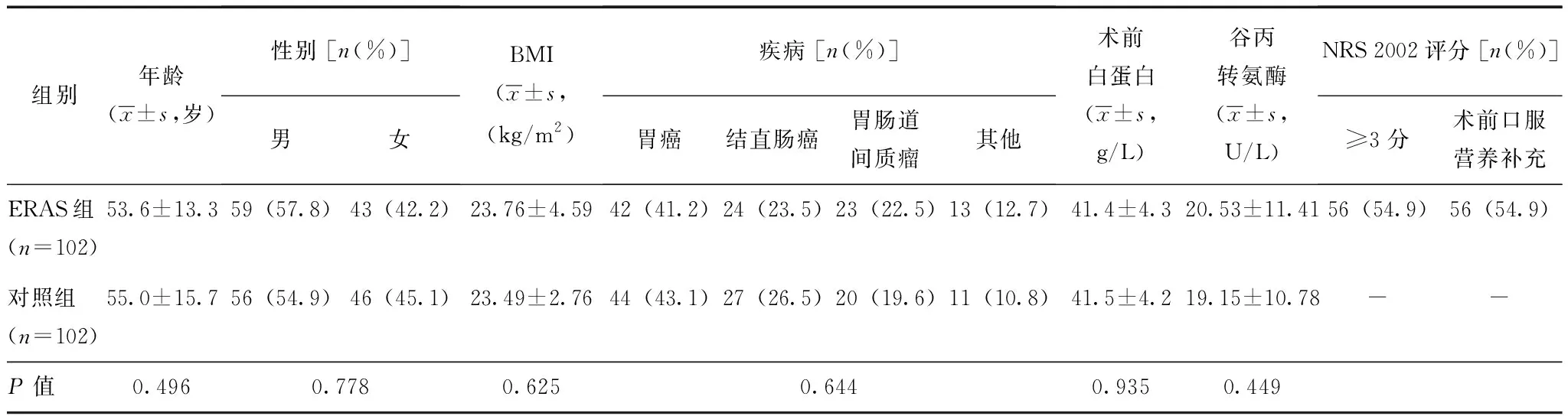
表 2 胃肠外科ERAS组与对照组患者基线资料比较
ERAS、NRS:同表1; BMI:体质量指数

表 3 胃肠外科ERAS组与对照组术后营养干预模式及临床一般情况比较
ERAS、EN:同表1; PN:肠外营养
2.3 术后并发症
ERAS组和对照组术后Clavien-Dindo分级Ⅱ级及以上并发症发生率分别为9.8%和13.7%,无统计学差异(P=0.393)。ERAS组术后并发症包括医疗相关感染7例(吻合口漏3例、腹腔感染2例、肺炎2例)、胃排空障碍1例、肠梗阻1例、脂肪液化1例,对照组包括医疗相关感染9例(吻合口漏4例、肺炎2例、腹腔感染2例、切口感染1例)、腹泻2例、胃排空障碍1例、脂肪液化1例、肝功能受损1例。两组术后60 d内再入院率分别为2.9%和2.0%,无统计学差异(P=1.000)。
3 讨论
研究显示,ERAS组的POD和住院总费用较对照组显著降低,同时不增加术后并发症发生率和术后60 d内再入院率。鉴于围手术期临床营养在国内外ERAS指南推荐中均居关键地位[5- 8],本研究进一步证实围手术期强化营养评估与干预对术后康复是安全有效的,具体措施包括术前营养评估与干预、口服营养补充预康复、选择性术中留置空肠营养管或鼻空肠置管、术后早期EN。
Aarts等[11]在2018年发表的研究中,将“最佳康复”定义为术后5 d内出院、无严重术后并发症、无再入院和不良事件发生,该研究纳入15家医学中心2876例结直肠手术患者,POD为5 d(1~116 d),49.7%实现最佳康复。本研究ERAS组和对照组术后住院时间分别为(7.2±4.5)d和(9.8±4.8)d,长于最佳康复定义的标准,可能与本组患者以上消化道疾病尤其是胃癌为主,术后恢复较结直肠手术慢有关[16,22],且恶性肿瘤比例(85%)高于Aarts的研究(77.6%)。ERAS流程在胃癌及胃切除手术中的研究尚不及在结直肠手术广泛,最近多项胃手术ERAS研究[15- 16,23- 25]表明,ERAS组较传统组的POD平均缩短1~2.5 d,与本结果一致,POD缩短及优化的术后营养干预(早期EN,减少PN)是住院费用降低的重要原因。
本研究中ERAS组与对照组的术后并发症发生率和种类无统计学差异,这与另一项关于胃癌患者ERAS流程管理的单臂Ⅱ期临床试验[15]结果一致,该研究显示Clavien-Dindo分级Ⅱ级及以上并发症发生率为10.7%,前3位并发症依次是腹腔感染或脓肿(2.5%)、肝功能异常(2.5%)、胃排空障碍(1.7%);本研究两组术后并发症主要为医疗相关性感染,包括腹腔及肺部感染(3.9%~4.9%)及吻合口漏(2.9%~3.9%)所致感染。但Tanaka等[16]关于胃癌患者ERAS流程与传统流程的随机对照研究发现,两组术后并发症的发生率和种类有统计学差异,ERAS组术后Clavien-Dindo分级Ⅲ级及以上并发症发生率为4.1%,显著低于对照组的14.5%。ERAS流程是否能减少术后并发症的发生尚存争议,但可以明确的是,减少引流、早期EN等ERAS流程不会增加术后并发症,尤其不增加术后吻合口漏的发生风险。
胃肠肿瘤患者存在营养风险或营养不良比例高达46.2%~62.7%,术后并发症和住院日增加不利于实现加速康复[12,26- 28]。术前营养风险筛查十分必要,尤其在胃肠肿瘤患者中应常规开展[29]。最新研究[30]显示,术前行3周营养预康复ERAS组比常规ERAS组的术后并发症发生率显著减少。本研究ERAS组中存在营养风险的患者均进行了营养预康复,但术后并发症未见显著降低,可能由于ERAS组营养干预时间短(术前3~7 d),难以显示营养预康复对术后短期临床结局的影响所致;此外,研究对象中高营养风险比例不高,对照组虽未进行营养预康复,对术后并发症发生的影响亦不大。术中选择性留置EN途径主要是针对行D2全胃切除术、高龄、术后辅助化疗等患者,术后可能存在持续高营养风险,利于实现术后早期EN和出院后继续营养支持治疗[31]。本研究ERAS组术后EN开始时间早于对照组,吻合口漏等并发症未见增加,以EN为主的术后营养支持模式有助于降低住院总费用、缩短术后住院日[5- 7]。整合的围手术期营养理念配合ERAS流程,使ERAS得以安全有效地开展。
本研究尚存在一些不足。第一,单中心临床实践难以确定更大范围的适用性,有必要进一步扩大样本量,开展多中心、前瞻性、随机对照研究。第二,研究有明确的纳入和排除标准,需进一步探索合并症多、疑难、危重的外科患者是否适合ERAS流程。第三,研究采用POD作为主要结局指标,是否为目前最恰当的科学指标尚不明确,有学者指出患者健康状态、术后生活质量等可能是更好的评价指标[10]。第四,作为一项关注围手术期营养干预的ERAS研究,营养预康复干预尚不充分,对于存在营养风险的胃肠道肿瘤患者术前宜进行时间更久的ONS等营养预康复,对术后临床结局可能更有意义。
综上,强化术前营养评估与干预以及术后早期EN的ERAS流程在胃肠外科应用安全有效,不增加术后并发症发生和术后60 d内再入院率的同时,显著减少POD和住院总费用,有利于胃肠手术患者更合理地实现加速康复。

