构建化学发光-绿色荧光稳定标记的鼠伤寒沙门氏菌
廖何斌, 徐 磊, 杨国淋, 马 强,2,, 邹 江, 孙 茹, 蔡 燕,2,, 郭晓兰,2,*
(1.川北医学院 转化医学研究中心,四川 南充 637000;2.川北医学院附属医院 检验科,四川 南充 637000;3.川北医学院 医学检验系,四川 南充 637000;4.川北医学院 动物实验中心,四川 南充 637000)
鼠伤寒沙门氏菌属于肠杆菌科,沙门氏菌属,是一种肠道致病菌,营胞内寄生,能通过多种途径逃避宿主的免疫系统,在宿主体内较长时间存活并造成持续感染。由于其宿主广泛,能感染包括人在内的多种动物,能通过定殖在肠道相关组织有效地刺激机体产生体液免疫和细胞免疫,容易表达外源抗原或其他蛋白等并呈递给宿主,使宿主产生特异性抗体,所以鼠伤寒沙门氏菌常被改造为弱毒疫苗活载体,广泛应用于多种病毒[1-3]、细菌[4-6]、寄生虫[7-8]等的免疫研究,并取得了良好的效果。此外,鼠伤寒沙门氏菌也被应用于多种肿瘤治疗的研究[9],其中VNP20009株已用于一期临床试验[10-11]。在弱毒疫苗活载体研究中,鼠伤寒沙门氏菌经常被用于细胞学实验和动物学实验,所以对其进行信号标记,使其可视化,将有利于相关的实验研究。在动物实验中,利用LUX系统对细菌进行标记,在活体成像系统中便能实时检测细菌在动物体内的分布及转移情况。发光杆菌的Lux operon编码5个相关蛋白,包括LuxA、LuxB、LuxC、LuxD和LuxE,其中LuxA和LuxB组成异源二聚体,构成荧光素酶,LuxC、LuxD和LuxE编码脂肪酸还原酶复合体,荧光素酶氧化底物FMNH2和长链脂肪醛生成FMN和长链脂肪酸,同时产生生物光现象,长链脂肪酸又能被脂肪酸还原酶还原为长链脂肪醛[12]。所以,能表达完整Lux operon的细菌不需要外源底物便能持续产生生物发光。这种生物发光信号即使在动物组织的深部也能被检测到,所以是一种非常方便有效的小动物活体检测技术[13-14]。绿色荧光蛋白(GFP)是一类存在于腔肠动物的生物发光蛋白,由于其生色基团的形成没有物种特异性,所以在原核和真核细胞都能合成有功能的GFP蛋白,GFP蛋白也被广泛应用于多学科的研究和生产中。GFP蛋白有诸多优点,包括易于检测、灵敏度高、蛋白质稳定、荧光性质稳定、对细胞无毒害作用、能与其他多种蛋白融合表达且不影响两者的功能、能用于活细胞检测等[15]。在细胞水平研究细菌,GFP是一种理想的细菌标记物,只需要荧光显微镜便能检测到细菌在细胞内的定殖和转移情况。本研究拟对鼠伤寒沙门氏菌强毒株SalmonellatyphimuriumATCC 14028s进行化学发光和绿色荧光的双标记。使其同时能在动物水平和细胞水平具有较好的可视化,为其后续的改造改良提供参考。
1 材料与方法
1.1 材料
1.1.1 质粒、菌种与细胞株 质粒p1217由西北农林科技大学王华岩教授惠赠;质粒pRE112、大肠埃希菌7213和7232由四川农业大学孔庆科教授惠赠;鼠伤寒沙门氏菌ATCC 14028s(Salmonellatyphimurium)由本实验室保存;食管癌细胞TE1和乳腺癌细胞468(MDA-MB-468)由本实验室保存。
1.1.2 主要试剂 一步克隆试剂盒pEASY-Uni Seamless Cloning and Assembly Kit、PCR试剂盒TransStart FastPfu Fly DNA Polymerase Kit、内切酶BamHI购自北京全式金生物公司;质粒小提试剂盒、DNA纯化回收试剂盒购自天根生化科技有限公司;RPMI1640购自Gibco;氯霉素(Cm)、青链霉素、胎牛血清(FBS)、二氨基庚二酸(DAP)、蔗糖购自Sigma;Marker 10000购自康维试剂。
1.2 方法
1.2.1 自杀质粒的构建 根据GenBank收录的鼠伤寒沙门氏菌ATCC 14028s的基因组序列,选择两个特定的位点,分别设计扩增同源臂I1-U、I1-D、I2-U、I2-D的引物Insert1 UP1/UP2、Insert1 DP1/DP2、Insert2 UP1/UP2、Insert2 DP1/DP2;根据质粒p1217和pRE112序列,分别设计扩增Lux操纵子的引物LUX P1/P2,扩增绿色荧光蛋白基因gfp的引物GFP P1/P2,扩增质粒pRE112的引物112 P1/P2,序列及产物理论长度见表1。用PCR试剂盒,按照使用说明书扩增各DNA片段,再用DNA纯化回收试剂盒纯化PCR产物;用一步克隆试剂盒按顺序将I1-U、LUX、I1-D以及BamHI酶切-回收的pRE112等4个片段进行重组,或按顺序将I2-U、GFP、I2-D和112等4个片段进行重组;重组产物转化到大肠埃希菌7232中,在LB+Cm(20 μg/mL)平板进行筛选,提取阳性转化子中的重组质粒pRE112-I1和pRE112-I2进行测序鉴定,序列无误则克隆成功。

表1 本研究所用引物Table 1 The primers used in this study
1.2.2 基因插入细菌基因组 基因插入利用同源重组的原理。首先将构建的自杀质粒pRE112-I1和pRE112-I2转化到接合转移供体大肠埃希菌7213中,在LB+Cm+DAP(50 μg/mL)平板中筛选阳性转化子;分别将阳性转化子7213 pRE112-I1(或7213 pRE112-I2)和S.typhimurium野生株(WT)液体震荡培养至对数生长期,按照2∶1的比例混合两种菌液,取500 μL菌液浓缩后涂布于LB平板,37 ℃孵育8 h,刮取菌体,涂布于LB+Cm筛选阳性接合子;将阳性接合子接种于LB+Cm液体培养基中震荡培养至对数生长期后,稀释50倍,取100 μL涂布于LB+Sucrose(10%)平板,室温培养;PCR鉴定长出的菌落是否为基因插入的菌株,阳性菌落的PCR产物进行DNA测序以确定插入序列正确。
1.2.3 生长曲线测定 接种S.typhimuriumWT、S.typhimuriumLux和S.typhimuriumLux-gfp于2 mL LB中,过夜培养;分别稀释100倍接种于15 mL LB中,37 ℃、180 r/min培养;每1 h测定一次OD600值,共培养8 h。分别进行3次独立实验。
1.2.4 动物实验 购买体重相近的SPF级5周龄雌性BalB/C小鼠30只,随机均分为10组;在LB中培养接种S.typhimuriumWT和S.typhimuriumLux-gfp至对数生长期,分别稀释至适当浓度,取0、103、104、105、106和107CFU的活菌(悬于100 μL 生理盐水)腹腔注射小鼠;各组小鼠饲养于清洁级动物房,自由采食、饮水,光照12 h,饲养15 d,计算S.typhimuriumWT和S.typhimuriumLux-gfp对BalB/C小鼠的LD50。当小鼠需要活体成像时,用45 mg/kg的戊巴比妥钠腹腔注射以麻醉小鼠,用小动物活体成像系统显影。
1.2.5 细胞实验 食管癌细胞TE1培养于RPMI1640+10%FBS,乳腺癌细胞468培养于DMEM+10%FBS,均在37 ℃、5%CO2条件下培养。每种细胞接种105个细胞于6孔板中,S.typhimuriumWT和S.typhimuriumLux-gfp培养至对数生长期,用RPMI1640洗涤并调整浓度,分别用1.5×108个CFU细菌与每孔中的细胞孵育2 h,去除细胞培养液,用PBS洗涤细胞,然后添加新鲜培养基培养,并加入100 μg/mL的庆大霉素。
2 结果与分析
2.1 S. typhimurium Lux-gfp构建及其表型
通过分析S.typhimuriumATCC 14028s的基因组,选择基因组上的两处位置(图1),这两处位置的特点是均在两侧编码基因的下游区域,且和两侧编码基因均不在同一操纵子内部,在理论上避开了启动子区域,不会对相邻的基因造成极效应。首先根据插入位点的序列设计了相应同源臂扩增引物,根据p1217和pRE112序列设计引物扩增Lux operon和gfp基因。PCR扩增结果如图2所示,各PCR产物条带与Marker进行比较,均符合其理论值大小(表1)。利用一步克隆法将各个片段依次进行无缝连接,构建成重组的自杀质粒,经测序鉴定构建成功。基于同源重组的原理,用构建的重组自杀质粒先后在基因组对应的位点插入Lux operon和gfp基因,对应的菌株分别获得了化学发光和绿色荧光的特性。如图3所示,野生型S.typhimuriumWT不具备化学发光和绿色荧光特性;S.typhimuriumLux获得了化学发光特性,S.typhimuriumLux-gfp同时获得了化学发光和绿色荧光的特性,表明成功构建了化学发光-绿色荧光标记的鼠伤寒沙门氏菌。在体外进行了超过20代的培养,该菌株仍保持稳定的基因型和表型特征(数据未展示),这与插入的DNA片段在染色体上稳定遗传是相符的,也是相对于质粒携带外源DNA的优势所在。

图1 基因组插入位点Fig.1 The insertion sites

图2 重组自杀质粒片段扩增Fig.2 The amplification of fragments used to construct suicide plasmid

图3 化学发光-紫外荧光检测Fig.3 The detection of chemiluminiscence and ultraviolet fluorescence
2.2 稳定遗传的S. typhimurium Lux-gfp生长特性和毒力
为了确定在S.typhimurium基因组中插入一段序列后对细菌的影响,对构建菌株进行了生长曲线测定,结果见图4。结果表明,在基因组上2个独立位点先后插入两段基因序列,并未对细菌的生长造成显著影响;继续测定S.typhimuriumWT和S.typhimuriumLux-gfp对5周龄BalB/C小鼠的半数致死量,均小于2×103CFU,表明S.typhimuriumWT和S.typhimuriumLux-gfp毒力均极强。
鼠伤寒沙门氏菌常作为疫苗载体递呈内源性和外源性的抗原进行免疫,或者作为基因治疗载体针对某些疾病进行治疗等,这往往依赖其生长迅速,操作简单,以及强毒力使其在宿主体内进行适当的感染与定殖等特征。测定了S.typhimuriumWT、Lux和Lux-gfp的生长曲线,各菌间均无显著性差异,结果表明Lux operon和gfp基因的插入并未显著影响其快速的生长和极强的毒力,所以S.typhimuriumLux-gfp作为亲本株进行各种基因工程改造,在研究细菌的生命活动、细菌与宿主的相互作用、减毒活疫苗载体研发等领域比S.typhimuriumWT更具优势。
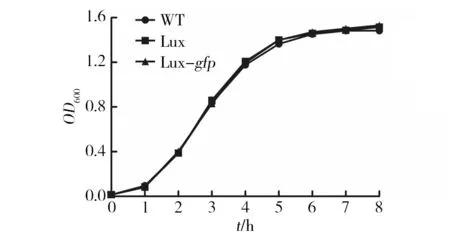
图4 生长曲线测定Fig.4 The growth of S. typhimurium WT, Lux and Lux-gfp
2.3 S. typhimurium Lux-gfp在细胞内的荧光信号
在S.typhimurium基因组中插入gfp基因,使得该菌具备绿色荧光的特性,在平板上生长的菌落,紫外荧光明显(图3),进一步检测在细胞水平下该菌的荧光情况。鼠伤寒沙门氏菌是胞内侵袭菌,能入侵到细胞内部。用S.typhimuriumLux-gfp感染食管癌细胞TE1和乳腺癌细胞468约15 h后在荧光显微镜下观察,结果如图5所示,感染了S.typhimuriumLux-gfp的细胞内部有明显的绿色荧光。被S.typhimuriumLux-gfp感染的细胞形态均有变圆趋势,易漂浮死亡,这可能是由于该菌株毒力强,对细胞杀伤力大造成的。若要作为疫苗载体或者基因治疗载体,则应该使其毒力弱化,减小对正常细胞的杀伤作用;或使进入细胞的细菌裂解以释放基因治疗药物等,这样才能更好地发挥作为载体的作用。
2.4 S. typhimurium Lux-gfp在活体小动物上的化学发光信号
在S.typhimurium基因组中插入Lux operon,使得该菌有化学发光的特性,在平板上生长的菌落具有良好的化学发光能力(图3),化学发光特性可用作小动物活体成像,所以进一步在BalB/C小鼠体内进行化学发光的检测。高剂量攻毒(107CFU)的小鼠,全身感染,2 d死亡,化学发光成像如图6所示。未攻毒的对照组小鼠,同时间的化学发光成像如图6所示。结果表明,构建的菌株S.typhimuriumLux-gfp在含有正常皮毛的BalB/C小鼠体内的化学发光信号能被检测到,那么在裸鼠的效果将更明显。化学发光信号可由小动物成像系统采集信号,也可以用普通的化学发光显影仪采集信号,对仪器的要求不高,大部分实验室均能完成。所以,菌株S.typhimuriumLux-gfp在动物实验中提供了易操作的可视化手段。
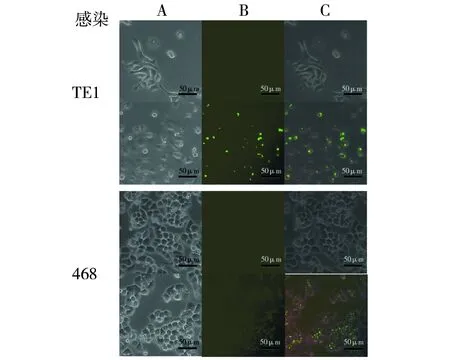
图5 S. typhimurium Lux-gfp感染TE1和468细胞Fig.5 The infection of S. typhimurium Lux-gfp in cancer cells: TE1 and 468

图6 S. typhimurium Lux-gfp感染小鼠Fig.6 The infection of S. typhimurium Lux-gfp in BalB/C mouse
3 讨 论
使细菌带有化学发光特性的操纵子Lux op-eron和绿色荧光基因gfp被广泛应用于微生物学和分子生物学的各个领域。通常是由质粒作为载体携带Lux operon或gfp基因进入细菌表达,这样则会由于外源质粒的引入同时代入1~2种抗生素抗性基因,这是作为疫苗载体或治疗载体的细菌应尽量避免的;质粒具有不稳定性,可能会丢失;而且由于质粒不相容性,这些质粒的存在将增加该菌株表达外源目的蛋白或核酸质粒的选择难度。因此,本研究直接将Lux operon或gfp基因通过同源重组的方式插入S.typhimuriumATCC 14028s基因组中,这样不引入任何外源抗性基因,又能保证两种标记能得到稳定的表达,其在体外传代20代以上均十分稳定(数据未展示),而且还避免了引入质粒带来的其他问题。在基因组中插入的外源基因相对质粒携带的缺点在于目的基因的单拷贝,其表达量受到极大的限制。本研究结果表明,这种单拷贝的标记基因表达量能使其表现型达到被检测的水平,既在紫外光和化学发光检测仪器检测到该菌的菌落具有紫外发光和化学发光特性,同时该菌感染癌细胞后,在细胞水平也能检测到绿色荧光信号,在感染的小鼠体内也能检测到化学发光信号。细菌基因组插入一段序列后可能会带来极效应,即对插入位点下游基因的表达造成影响,所以插入Lux operon或gfp基因的位点均选择在两端基因相隔较远,且同时在两端基因的下游区域,这样理论上不会影响到上下游基因的启动子,不会对其表达造成影响。此外,还检测了双信号菌株的生长曲线和毒力,与亲本株比较无显著性差异,侧面说明了Lux operon或gfp基因的插入并未造成极效应。
在基因组中稳定标记化学发光-绿色荧光信号的基因是完全可行的,本研究构建的化学发光-绿色荧光稳定标记的鼠伤寒沙门氏菌将为后期改造其作为弱毒活疫苗载体或抗肿瘤载体的研究提供可视化手段,同时为相关的细菌信号检测研究提供理论参考。

