2株北虫草菌株系统发育及其活性成分含量分析
冯 敏, 李剑梅, 郭玲玲, 李 赞
(辽宁省微生物科学研究院,辽宁 朝阳 122000)
北虫草[Cordycepsmilitaris(Vuill.)Fr.]也称蛹虫草,属于子囊菌亚门(Ascomycotina),麦角菌科(Clavicepitaceae),虫草属(Cordyceps),是我国一种兼具食用和药用珍贵价值的优质大型真菌[1]。研究表明,其子座除了富含蛋白质、氨基酸、维生素及钙、锰、锌、硒等微量元素外, 还含有虫草素、腺苷、过氧化物歧化酶等生物活性物质,具有增强动物机体免疫力、抗肿瘤、抗辐射、降血糖、降血脂、抗疲劳、延缓衰老等多种生理功效, 具有与天然冬虫夏草相似活性成分及保健功效[1-6]。2009年根据《中华人民共和国食品卫生法》和《新资源食品管理办法》的规定,北虫草被批准为新资源食品,且于2014年5月变更了标准中的食用量、质量指标要求及食用范围,认定北虫草为新食品原料,极大地促进了北虫草规模化人工栽培的发展,但在菌种使用方面多为小作坊式,缺乏优良菌种质量标准及优良品种的认定标准,市场上通常以北虫草子实体品相作为子实体品质高低的评估标准,严重干扰了北虫草产业的健康发展[7-12]。本研究对收集到的2株子实体形态差异显著、市场广泛栽培的尖头及大孢子头北虫草菌株进行了形态观察及ITS序列特征分析,并基于ITS序列进行核酸序列数据库GenBank同源性比对,构建系统发育树,探讨其亲缘关系,同时对不同来源的两种北虫草子实体中的主要活性成分进行了含量测定,为两种北虫草子实体应用提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株 可育性尖头北虫草菌株(JF1)和大孢子头北虫草菌株(BF1)为本研究室保藏;所用子实体分别来源于本研究室、敖汉北虫草栽培基地及江苏大米基质北虫草。
1.1.2 主要仪器与试剂 高效液相色谱仪(Waters e2695,美国),超净工作台(HFsafe-1200,上海力申科学仪器有限公司), 恒温培养箱(SPH-2102,上海世平实验设备有限公司), 高压灭菌锅(LDZX-75KBS,上海申安医疗器械厂);硫酸镁、磷酸二氢钾、葡萄糖、甲醇(色谱纯)、蛋白胨、柠檬酸三胺。
1.1.3 培养基 ①PDA加富培养基:土豆200 g,葡萄糖20 g,蛋白胨1 g,硫酸镁0.5 g,KH2PO41 g,琼脂16 g,加蒸馏水至1 000 mL,pH 6.5,121 ℃灭菌15 min。②液体培养基:土豆200 g,葡萄糖20 g,蛋白胨1 g,硫酸镁0.5 g,KH2PO41 g,琼脂16 g,加蒸馏水至1 000 mL, pH 6.5,121 ℃灭菌15 min。③营养液:葡萄糖10 g, MgSO41 g,KH2PO42 g,蛋白胨5 g,柠檬酸三铵1 g,VB15 mg, 配制成1 000 mL 溶液,pH自然。④麦粒培养基:650 mL罐头瓶每瓶装小麦35 g,按照1∶1.7的比例(质量比)添加营养液。用聚乙烯膜包裹瓶口,再用橡皮筋扎紧,121 ℃灭菌1 h。
1.2 方法
1.2.1 实验菌株菌落形态及菌丝显微观察 将供试的2株北虫草菌株接种于PDA加富培养基,每个菌株做3次重复,20 ℃培养5 d,观察菌落形态及菌丝长势,显微镜观察菌丝形态特征。
1.2.2 人工栽培实验 将实验用菌株分别接入含有50 mL液体培养基的三角瓶中,20 ℃、130 r/min震荡培养72 h,用吸管取北虫草液体培养液5 mL均匀接种于麦粒培养基料面上,18 ℃暗培养7 d。菌丝盖面并吃透培养料后,20 ℃见光转色,光照培养24 h,转色时白天温度控制在18~20 ℃,夜间室温降至15~17 ℃进行催蕾管理,待培养料表面形成原基后用消毒牙签在封口膜上扎4个小孔,于湿度40%、温度20 ℃环境下进行出草管理, 每天早、晚各通风30 min, 每天光照12 h以上,培养50~60 d即可采收、测量及观察。
1.2.3 分子鉴定和系统发育研究 ①基因组DNA提取:供试菌株基因组DNA的提取采用CTAB法。将纯化的供试菌株接于PDA加富平板,22 ℃避光倒置培养,当菌丝布满2/3平板时,刮下约0.2 g,置于1.5 mL的离心管中,加入0.2 g灭菌的石英砂,研磨5~10 min,再加入500 μL 65 ℃预热的2×CTAB,65 ℃水浴60 min,每隔5~10 min颠倒一次;加500 μLV氯仿∶V异戊醇=24∶1,颠倒混匀10 min,12 000 r/min,4 ℃离心10 min,取上清,加等体积V氯仿∶V异戊醇=24∶1,混匀,12 000 r/min,4 ℃离心10 min,重复1次;取上清加入2/3体积的-20 ℃异丙醇,1/10 体积的3 mol/L NaAc (pH 5.2),混匀,-20 ℃放置90 min;4 ℃、12 000 r/min离心10 min,取沉淀,加入-20 ℃的75%乙醇500 μL,上下颠倒洗涤,重复1次;弃乙醇,晾干,加入100 μL TE溶解DNA,-20 ℃保存备用。②ITS-PCR扩增:以ITS 1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS 4(5′-TCCTCCGCTTATTGATATGC-3′) 为引物。50 μL反应体系:10×TaqPCR Buffer 5 μL,dNTP 4 μL,F Primer 2 μL,R Primer 2 μL,TaqDNA聚合酶1 μL,DNA模板3 μL,ddH2O 33 μL。PCR扩增程序:94 ℃预变性2 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸2 min。③PCR产物测序及系统发育分析:PCR扩增产物送华大基因(北京)经纯化后进行单向测序。对测得的供试菌株 rDNA ITS序列运用GenBank核酸序列数据库,应用 Blast程序分别对所测得的ITS1-5.8S-ITS2序列进行相似性比对。用软件clustalX1.81进行多序列比对,比对结果用Mega3.0软件构建系统进化树。
1.2.4 子实体中虫草素、腺苷含量测定 按照高效液相色谱法(药典2000版附录VID)[16]。色谱柱:C18,流动相:甲醇∶水=15∶85,检测波长:258 nm,进样量:5 μL,流速1 mL/min;计算方法:外标法。
2 结果与分析
2.1 两种供试菌株菌落形态
图1结果显示,在PDA加富培养基上,尖头北虫草与大孢子头北虫草菌落形态存在明显差别,尖头北虫草菌落为圆形,菌落边缘菌丝洁白、整齐,菌丝为绒毛状,气生性弱,菌落背面产橘黄色色素;大孢子头北虫草生长初期均为半球形,后期菌落为圆形,菌落中心明显凸起,菌落边缘整齐,菌丝绒毛状,气生性强,菌落背面产淡黄色色素。
2.2 供试菌株菌丝显微形态
图2显示,显微镜下两株供试菌株气生菌丝形态相似,菌丝无色、有隔、有分枝,分生孢子着生在孢子梗的顶端,拟球型或拟卵圆型。分生孢子产孢结构有两种类型,分别为分生孢子着生在孢子梗顶端呈迭瓦状长链的拟青霉型和分生孢子粘结成头状的头孢霉型。
2.3 供试菌株子实体形态差异
图3显示,大孢子头北虫草生长初期子实体为棒状,生长后期子实体顶端膨大成球形,子实体呈蝌蚪状,子实体上半部着生丰富的子囊壳,子实体平均长度4.5~5 cm,淡黄色。尖头北虫草子实体形状为上细下粗,初期顶端为针状,后期膨大多为钝圆型,子实体色泽较深,为橘黄色,成熟的子实体高8~10 cm,表面有明显的裂纹。在显微镜下,大孢子头北虫草子囊壳着生部位较浅,容易脱落;而尖头北虫草的子囊壳稀少,着生部位较深。可见,两种供试北虫草在子实体形态、子囊壳数量及着生状态等形态特征存在明显差异。

图1 两种北虫草在PDA加富培养基上的菌落形态Fig.1 Colony morphology of two Cordycep militaris strains on PDA enriched medium

图2 在PDA加富培养基上供试北虫草菌丝显微形态及分生孢子Fig.2 Microscopic morphology and conidia of two Cordycep militaris strains on PDA enriched medium

图3 两种北虫草子实体表观形态Fig.3 Apparent morphology of two Cordycep militaris strains sporocarp
2.4 ITS序列测定及同源性分析
由图4可见,2株供试菌株的ITS序列扩增片段清晰,大小在750~500 bp之间,且扩增结果稳定,重复性好,可进行系统发育学分析。基于ITS序列测定结果分析:2种供试菌株的ITS序列长度分别为512 bp(尖头北虫草菌株J)、518 bp(大孢子头北虫草菌株B),GC含量均为51%,二者相同。将所获得的2株供试菌株的ITS序列与GenBank核酸序列数据库中的序列进行Blast检索比对,结果显示2株菌均与虫草属真菌蛹虫草(Cordycepsmilitaris)具有高度的同源性,同源性高达100%。

图4 尖头及大孢子头北虫草菌种的ITS序列电泳图谱Fig.4 ITS sequences electrophoresis atlas of pointed cephalon and megaspore cephalon C. militaris strains
2.5 系统发育分析
根据Blast检索结果,筛选9株最相似菌株的ITS序列与供试菌株的序列进行系统发育树的构建,如图 5、6所示。结果显示2株菌均与蛹虫草聚为一个大簇,进化距离为“0”,分类学地位均属蛹虫草,二者序列基本相同,属于种内差异。
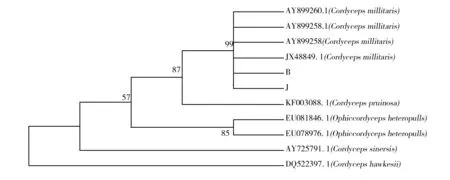
图5 虫草属真菌的系统发育树

图6 虫草属真菌的进化距离 Fig.6 Evolution distance of the genus of Cordycep fungi
2.6 腺苷、虫草素含量分析
表1显示,本实验室栽培的两种北虫草腺苷成分相近,但尖头北虫草的虫草素含量是大孢子头北虫草的2倍;两种北虫草同一品种不同栽培方法及同一种源不同栽培地获得的子实体中两种活性成分的含量有所不同,尤其是腺苷的含量相差悬殊。因此,实验范围内,北虫草子实体中两种活性成分的含量与品种没有相关性,不同的培养基及培养方法是影响北虫草子实体中活性成分含量的主要因素。

表1 两种北虫草子实体中活性成分检测结果Table 1 Determination results of active components in sporocarp of two Cordycep militaris strains
3 讨 论
在我国北虫草已经实现规模化培植,且根据其子实体顶端形态特征区分,市场上常见的人工栽培品种有尖头北虫草及圆头北虫草,在子实体应用的过程中,通常通过子实体的外观评判子实体优劣,并且价格较悬殊,大孢子头北虫草因其外观及口感好,每千克的市场价格高于尖头北虫草价格多达20%。本研究结果表明,实验范围内,北虫草子实体中两种活性成分的含量与品种没有相关性,不同的培养基及培养方法是影响北虫草子实体中活性成分含量的主要因素。因此,以北虫草子实体的品相作为品质优劣的评估标准缺乏科学依据。
北虫草子实体人工栽培的环境因子主要是培养基配比、温度、光照、湿度、通风,有研究发现在北虫草子实体不同的发育阶段,各个环境因子的变化都能显著影响北虫草的子实体形态、生物量、腺苷、虫草素等有效成分的含量。因此在北虫草菌种选育及栽培生产过程中,应注重促进活性物质合成条件的优化,提高优良菌种选育及栽培技术,获得富含北虫草特有的活性物质且含量稳定的子实体,建立北虫草菌种及子实体质量标准,以解决北虫草质量参差不齐的现象,实现北虫草标准化栽培,保障北虫草产业的健康发展。

