从乙烷氧化富集物中分离到的乙醇氧化不动杆菌的生理生化特点
张盼盼, 黄 莹, 朱 婷, 全哲学
(复旦大学 生命科学学院,上海 200438)
一般将乙烷、丙烷及丁烷归为非甲烷气态碳氢化合物[1]。乙烷作为天然气的第二主要成分,是甲烷通过氧化偶联转化的主要产物。和甲烷相比,乙烷的好氧生物氧化作用很少受到人们的关注[2]。因此,乙烷氧化相关微生物的分离培养及其生物氧化途径值得人们关注和进一步研究。微生物学上习惯用琼脂固体培养基对细菌进行分离培养。然而,此类借助琼脂固化的培养基并不适合所有类型细菌的分离[3],迄今可分离培养的微生物仅约占自然界中存在的微生物的1.0%或者更少[4]。为了分离培养不易在琼脂固体培养基上生长的菌株,科学家们开发了floating filter方法:首先,把梯度稀释后的样品过滤至灭菌滤膜正面,然后,将滤膜正面向上漂浮至液体培养基表面,使得滤膜表面的细菌可从液体培养基中获得营养,且不易在滤膜表面扩散,进而就像在固体培养基表面一样在滤膜表面形成菌落。研究者采用此方法从黄铁矿氧化富集物中分离出用琼脂固体培养基无法分离获得的嗜酸细菌[5]。2007年,有研究者利用floating filter方法,从火山泥泉和混合土壤样品中首次分离出1株属于疣微菌门的嗜酸嗜热甲烷氧化菌[6];此方法最近也应用于常规pH条件下的甲烷氧化菌的分离培养[7]。有些乙烷氧化微生物可能像甲烷氧化微生物一样不易在琼脂固体培养基上生长,本研究采用floating filter方法对营养土乙烷富集样品进行分离培养,试图找到新的乙烷氧化相关微生物;虽然分离到的是没有乙烷氧化活性的乙醇氧化菌菌株Z1,但此菌可应用于利用floating filter方法的乙烷氧化菌的分离培养以及污染石油烃的降解。为此,对分离菌株Z1进行了生理生化特点的研究。
1 材料与方法
1.1 材料
1.1.1 土壤样品 采集自长白山有机营养花卉黑土,密封于无菌采样袋中,4 ℃保存。
1.1.2 培养基 NMS培养基(Nitrate Mineral Salts Medium):七水硫酸镁1 g,硝酸钾0.05 g,十二水磷酸氢二钠0.717 g,六水氯化钙0.2 g,EDTA铁铵5 mg,微量元素(EDTA钠盐0.5 g,七水硫酸亚铁0.2 g,硼酸0.03 g,六水氯化钴0.02 g,五水硫酸铜0.03 g,七水硫酸锌0.01 g,二水氯化锰3 mg,六水氯化镍2 mg,蒸馏水1 000 mL)1 mL,蒸馏水1 000 mL,pH值6.8,121 ℃灭菌15 min。可用于甲烷、乙烷及丙烷等气态烃类物质氧化菌的富集、分离和培养[8-9]。R2A琼脂培养基是一种常用于分离培养环境样品中异养型细菌的培养基。为了避免高浓度营养物质对菌株生长造成的影响,本研究采用降低一半浓度营养物质的R2A培养基(50%R2A)。50%R2A液体培养基:1.575 g R2A干粉,蒸馏水1 000 mL。50%R2A固体培养基在50%R2A液体培养基基础上需再加入15 g Agar Noble,121 ℃灭菌15 min。
1.1.3 仪器与设备 GTTP滤膜(Millipore,直径47 mm,孔径0.2 μm);小型培养皿(直径5 cm,江苏海门试剂耗材);Epoch分光光度计(BioTek);Agar Noble(BD DifcoTM);825-A 型厌氧菌培养罐(沈阳市第五人民医院);EDC-810 PCR仪(东胜国际贸易有限公司);Pico17微型离心机(赛默飞世尔科技有限公司);铝箔采样袋(大连德霖气体包装有限公司);Vortex-Genie®2振荡器(MO BIO);DKB型低温恒温槽、生物化学培养箱SHP-150、台式恒温振荡器THZ-312(上海精宏实验设备有限公司);XW-80A旋涡混合器(上海医科大学仪器);GC2020气相色谱仪(上海析默分析仪器有限公司)。
1.2 方法
1.2.1 乙烷氧化富集培养 为了得到乙烷氧化相关微生物,对长白山有机营养花卉黑土进行了好氧条件下的乙烷富集培养。具体方法:称取长白山有机营养花卉黑土5 g于灭菌的体积为120 mL的空培养瓶中,盖上橡皮塞盖,充入2 mL乙烷,置于28 ℃恒温水浴槽中培养,每隔5~8 d用气相色谱(GC2020)检测乙烷浓度,每次检测后打开瓶子换气,之后再充入2 mL乙烷继续培养,连续培养4个周期。
1.2.2 floating filter方法 称取0.2 g营养土乙烷氧化富集样品,加入1 mL无菌水充分混匀,5 000 r/min离心30 s,取上清,用无菌水将上清液梯度稀释后过滤至47 mm的无菌聚碳酸酯滤膜正面(孔径0.2 μm, Millipore),然后将滤膜正面向上悬浮于直径为5 cm的含有15 mL NMS液体培养基的小型培养皿上方,用酒精灯加热灭菌镊子尖端,均匀地在培养皿盖侧面扎4个大小、形状一致的小孔,盖上培养皿盖,最后将培养皿置于2.5 L密闭罐中,充入25 mL乙烷,置于28 ℃恒温培养箱培养。
1.2.3 分离菌株的鉴定 将滤膜上长出的单菌落四区划线至50%R2A固体培养基,置于28 ℃恒温培养箱培养,待培养基上长出单菌落后,以细菌16S rDNA为通用引物(27F: 5′-AGAGTTTGATCCTGGCTCAG-3′,1492R: 5′-GGTTACCTTGTTACGACTT-3′)进行菌落PCR,得到长约1 500 bp的16S rDNA片段[10]。测序结果通过数据库EzTaxon(https://www.ezbiocloud.net/identify)分析比对。
1.2.4 扫描电镜实验 从50%R2A固体培养基上挑取1个单菌落,菌株编号为Z1,固体培养纯化后用于以下各种理化实验。首先,于灭菌的体积为100 mL的锥形瓶中加入50 mL灭菌NMS液体培养基,用接种环从50%R2A固体平板上挑取菌株Z1单菌落于锥形瓶中,37 ℃、170 r/min摇床振荡培养,长菌后置于4 ℃冰箱备用。其次,于灭菌的直径为50 mm,孔径为0.2 μm的混合纤维素微孔滤膜中滴1滴备用的菌株Z1菌悬液,自然风干后,将菌液分布区的滤膜剪至0.5 cm大小,依次将样品浸泡在50%、75%、90%、100%的乙醇溶液以及50%、75%、90%、100%的叔丁醇溶液中各10 min左右,样品处理后置于含有100 μL 100%的叔丁醇溶液中保存,用于扫描电镜TM3000观察。
1.2.5 乙烷氧化活性的鉴定 于灭菌的体积为120 mL的橡胶塞培养瓶中加入50 mL NMS液体培养基,用接种环从50%R2A固体平板上挑取菌株Z1单菌落于培养瓶中,封紧橡胶塞盖,并注入1 mL乙烷。对照组除不接菌外,其余条件与实验组相同。使用气相色谱检测乙烷浓度变化,根据培养基浑浊度观察菌的生长情况。根据实验组的乙烷浓度是否下降、培养基是否浑浊来判断菌株Z1是否具有乙烷氧化活性。
1.2.6 中长链烷烃氧化活性实验 于250 mL锥形瓶中装入100 mL NMS液体培养基,分别加入滤膜过滤过的壬烷、十三烷至3 g/L作为唯一碳源,对照组用等量无菌水代替。实验组再分别加入100 μL的菌株Z1菌悬液,37 ℃、300 r/min摇床振荡培养,用微孔板分光光度计测OD600值。
1.2.7 甲醇、乙醇氧化活性的鉴定 于150 mL锥形瓶中装入50 mL NMS液体培养基,分别接入50 μL滤膜过滤过的甲醇、乙醇,两个实验组中分别接入50 μL菌株Z1菌悬液,对照组除不接菌外,其余条件与两个实验组相同,37 ℃、170 r/min摇床振荡培养,测OD600值检测菌株的生长。
1.2.8 生理生化实验 ①温度:于150 mL锥形瓶中加入50 mL 50%R2A液体培养基,灭菌后接种50 μL菌株Z1菌悬液,分别置于4、10、20、28、37、40、45 ℃摇床,170 r/min振荡培养,在指数期间隔取样,用微孔板分光光度计测OD600值。②pH:于150 mL锥形瓶中加入50 mL 50%R2A液体培养基,加入0.2 mol/L的二水磷酸二氢钠和0.2 mol/L的十二水磷酸氢二钠(最终浓度为0.02 mol/L)作为缓冲液,分别调pH至5.0、5.5、6.0、7.0、7.5、8.0,灭菌后再次调整pH之后接种50 μL菌株Z1菌悬液,37 ℃、170 r/min摇床振荡培养,在指数期间隔取样,测OD600值。③盐度:于150 mL锥形瓶中加入50 mL 50%R2A液体培养基,分别加入氯化钠至终浓度为0、0.2、0.5、1.0 mol/L,灭菌后接种50 μL菌株Z1菌悬液,37 ℃、170 r/min摇床振荡培养,在指数期间隔取样,测OD600值。④碳源和酶活类型的鉴定:用接种环挑取菌株Z1菌悬液四区划线至50%R2A固体培养基,37 ℃培养12 h,长出单菌落后用于API检测。使用梅里埃API 20NE和API 50 CH试剂盒,按照操作说明书进行,之后置于30 ℃恒温箱培养18~24 h,观察每个小管培养前后的颜色变化,参照试剂盒说明记录实验结果。⑤过氧化氢酶活性:取1块干净的载玻片,滴1滴3%过氧化氢溶液,用玻璃棒挑取50%R2A固体培养基上37 ℃培养12 h的菌株Z1菌苔涂在3%过氧化氢溶液中,若有大量气泡产生,则为阳性,反之为阴性。⑥氧化酶活性:平皿上铺1张滤纸,用1% tetramethyl ρ-phenylenediamine溶液(新鲜配置)浸润,将在50%R2A固体培养基上37 ℃培养12 h的菌株Z1菌苔涂在滤纸上,10 s内出现红色者为阳性,反之为阴性。
2 结果与分析
2.1 营养土乙烷富集培养实验
营养土乙烷富集培养实验共连续培养4个周期,每个周期的乙烷消耗速率见图1。
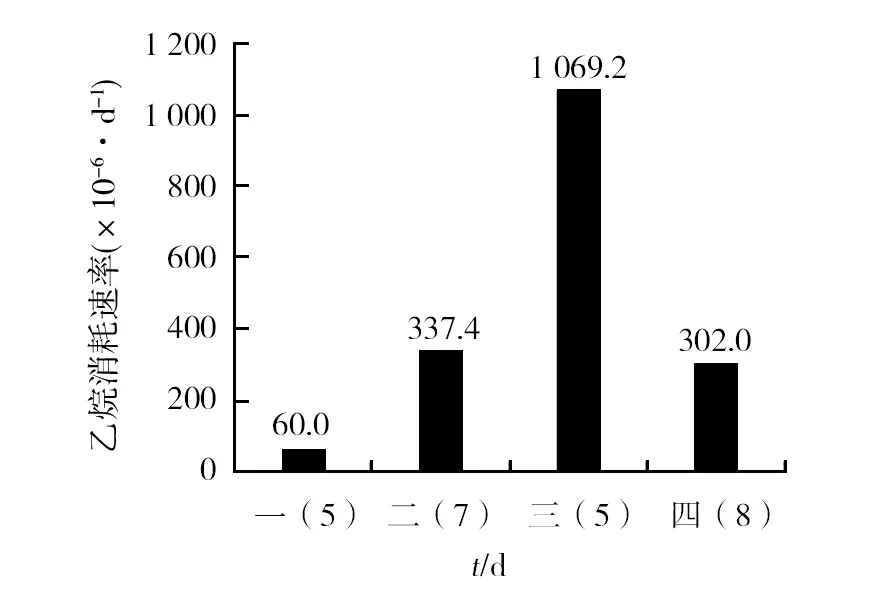
图1 营养土乙烷富集培养实验Fig.1 Ethane enrichment culture experiment of nutrient soil
由图1可知,培养初期,营养土乙烷富集物的乙烷消耗速率较低,在第三阶段达到顶峰为1 069.2×10-6/d,第四阶段因营养土的乙烷氧化活性有所下降,终止培养。乙烷的消耗说明营养土在此培养过程中富集了乙烷氧化菌。因此,尝试用floating filter方法将营养土富集样品中的乙烷氧化相关微生物分离出来。
2.2 菌种的分离鉴定与形态观察
营养土乙烷富集样品在乙烷条件下用floating filter培养近3周后,滤膜上长出单菌落,随意挑取其中10个单菌落进行16S rDNA PCR扩增,得到长约1 500 bp的片段,测序结果处理后通过数据库EzTaxon分析比对,所有序列与AcinetobacterpittiiCIP 70.29T的16S rDNA序列完全一致,判定这些菌为不动杆菌属(Acinetobacter)细菌。随后,将滤膜上长出的单菌落四区划线至50% R2A固体培养基28 ℃培养24 h后,即可观察到表面光滑、湿润、微凸、不透明的圆形菌落(图2),随机挑取几个单菌落进行16S rDNA的PCR扩增,测序结果均与floating filter上菌落测序结果一致。选取其中一个不动杆菌菌株Z1用于以下各种生理生化实验。扫描电镜显示其细胞为杆状,长度为1.0~2.0 μm,直径约0.6~1.0 μm(图2)。革兰染色结果为阴性。本研究分离出的不动杆菌菌株Z1的形态特点与已报道的不动杆菌属一致[11]。

图2 不动杆菌菌株Z1菌落形态和扫描电镜结果Fig.2 Morphology of colonies and scanning electron microscope result of Acinetobacter sp. Z1
2.3 乙烷氧化活性的鉴定
在进行乙烷NMS液体培养时,对照组和实验组起始均充入1.5%乙烷。培养至第11天时,对照组和2个实验组的乙烷浓度分别为1.3%、1.4%、1.3%,培养至第48天时,对照组和实验组的乙烷浓度分别为1.1%、1.3%、1.1%。气体检测数据表明实验组在整个培养过程中并无乙烷下降趋势;此外,在整个培养过程中,实验组始终无长菌迹象,对照组也维持最初的无菌状态。气体检测数据和培养结果表明不动杆菌菌株Z1无乙烷氧化活性。
2.4 中长链烷烃活性实验
不动杆菌菌株Z1分别以3 g/L壬烷、十三烷为唯一碳源下的生长趋势见表1。由表1可知,虽然不动杆菌菌株Z1能以壬烷为碳源生长,但与十三烷相比,其在壬烷条件下生长非常缓慢。
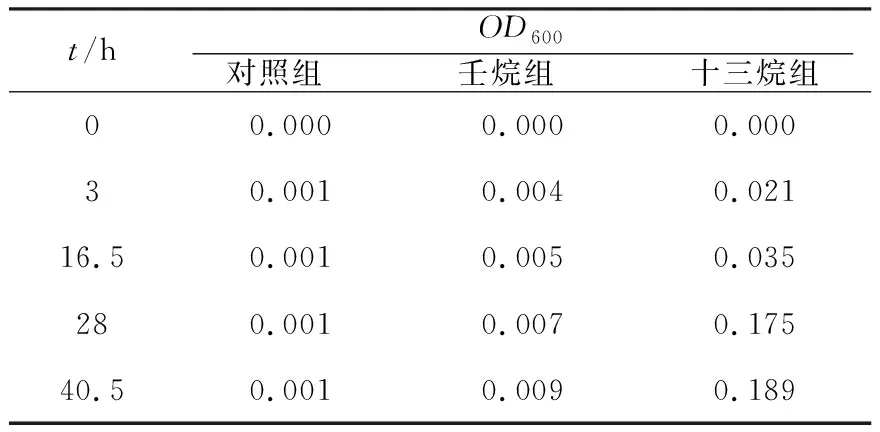
表1 不动杆菌菌株Z1中长链烷烃培养实验Table 1 Culture experiment of Acinetobacter sp.Z1 with medium long chain alkanes
2.5 甲醇、乙醇氧化活性的鉴定
不动杆菌菌株Z1分别以1‰甲醇、乙醇为唯一碳源下的生长趋势见表2。 由表2可知,不动杆菌菌株Z1可以甲醇、乙醇为碳源生长。虽然该菌能以甲醇为碳源生长,但与乙醇组相比,其在甲醇条件下生长较为缓慢。
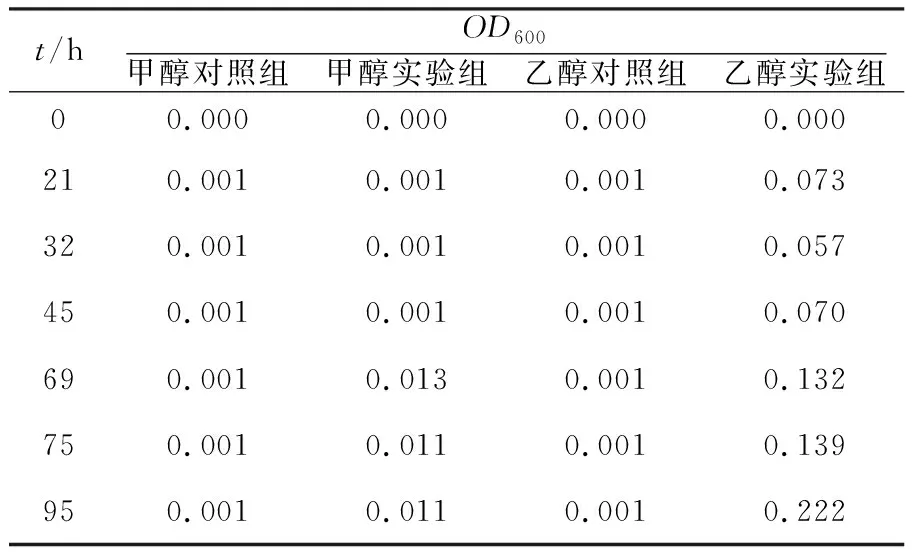
表2 不动杆菌菌株Z1甲醇、乙醇培养实验Table 2 Culture experiment of Acinetobacter sp. Z1 with methanol and ethanol
2.6 生理生化实验
2.6.1 温度 温度梯度实验表明不动杆菌菌株Z1可在10~40 ℃范围内生长,耐受温度范围较广,最适温度为37 ℃,40 ℃可呈现微弱的增长,45 ℃条件下不能生长。
2.6.2 pH 不动杆菌菌株Z1在不同pH梯度下的生长趋势见图3。由图3可知,不动杆菌菌株Z1可在pH 5.5~8.0范围内生长,可耐受pH范围较广,最适pH为6.0,在pH 8.0条件下生长良好,这与文献报道不动杆菌可在pH 5.5~8.0条件下能生长的结果一致[12]。

图3 不动杆菌菌株Z1的pH梯度实验Fig.3 The pH gradient experiment of Acinetobacter sp. Z1
2.6.3 盐度 不动杆菌菌株Z1在不同盐度梯度下的生长趋势见图4。由图4可知,不动杆菌菌株Z1可在0~0.5 mol/L的NaCl范围内生长,最适盐浓度为0.2 mol/L,在1.0 mol/L盐度条件下不生长。

图4 不动杆菌菌株Z1的盐度梯度实验Fig.4 The salinity gradient experiment of Acinetobacter sp. Z1
2.6.4 碳源和酶活类型的鉴定 不动杆菌菌株Z1的碳源利用和酶活特征见表3。其过氧化氢酶实验显示为阳性,氧化酶实验显示为阴性。

表3 不动杆菌菌株Z1的碳源利用和酶活特征Table 3 Characteristics of carbon source and enzyme activity for Acinetobacter sp. Z1
3 讨 论
营养土经乙烷直接富集培养时,乙烷浓度的下降表明营养土富集物具有乙烷氧化活性。本研究采用floating filter方法从营养土乙烷氧化富集物中分离出1株不动杆菌菌株Z1。液体培养实验证明甲醇、乙醇、壬烷、十三烷作为碳源可以生长,但无乙烷氧化活性;基因组结果表明其具有乙醇氧化及中长链烷烃氧化等功能基因,但无短链烷烃氧化相关功能基因(未发表数据)。该菌株的实验结果和基因组结果一致。
本研究从营养土乙烷氧化富集物的floating filter滤膜中随机挑取的10个菌落均为不动杆菌,说明在乙烷floating filter培养过程中生长量最大的是不动杆菌。先前关于环境样品的研究发现:在甲烷氧化过程中,甲醇氧化菌的量远大于甲烷氧化菌,是因为前者将甲醇氧化至二氧化碳所获得的能量远高于后者将甲烷氧化为甲醇所获得的能量,甲醇氧化菌利用甲烷氧化菌产生的甲醇等中间代谢产物得以大量生长繁殖[13-14]。乙醇氧化不动杆菌在乙烷floating filter滤膜上的量最多,说明乙烷氧化过程可能和甲烷氧化过程类似,乙醇氧化菌在乙烷氧化过程中占主导地位。在乙烷floating filter培养过程中,乙醇氧化菌可能与乙烷氧化菌混合在一起,利用乙烷氧化菌代谢产生的乙醇得以生长繁殖从而为乙烷氧化菌除去培养过程中的乙醇毒性。因为乙醇氧化菌获得的能量高于乙烷氧化菌,所以其生物量远高于乙烷氧化菌。
鉴于乙醇氧化菌的生长量大于乙烷氧化菌,若要利用floating filter方法分离乙烷氧化菌,则需降低乙醇氧化菌在滤膜上的生长量。在利用floating filter方法分离培养乙烷氧化菌的过程中,若将已分离得到的不动杆菌菌株Z1加入到floating filter滤膜下方 NMS液体培养基中,利用它的乙醇氧化功能使得其及时消耗滤膜上方乙烷氧化菌产生的乙醇,则样品中的乙醇氧化菌因缺乏营养物质进而不易在floating filter滤膜表面生长,从而更容易分离到真正的乙烷氧化菌。不动杆菌菌株Z1作为没有乙烷氧化活性的乙醇氧化菌,其生理生化特点的研究结果表明此菌株可应用于较广范围环境下基于floating filter方法的乙烷氧化菌的分离培养。
不动杆菌属细菌一般通过β脂肪酸氧化降解石油烃,其产生的生物表面活性剂可以促进石油烃乳化,进而促进石油烃降解。因此,不动杆菌属细菌可有效应用于处理海洋石油污染[15],而其对石油烃的降解效率与温度、pH、盐度以及底物浓度等多种因素有关[16-17]。有研究报道,不动杆菌属细菌在30 ℃、pH 7.0~8.0条件下,能够有效去除海洋中的石油污染[18]。本研究分离到的不动杆菌菌株Z1在20~37 ℃、pH 5.5~8.0,0~0.5 mol/L盐度(接近海水盐度)下生长良好,因此可应用于包括海洋在内的各种环境中石油污染的去除,值得进一步研究。

