抗肿瘤肽QX3-1融合蛋白在大肠埃希菌中表达条件的优化
费迎心, 陈 豪, 李慧婷, 吴文惠, 王春晓
(上海海洋大学 食品学院,上海 201306)
恶性肿瘤严重威胁着人类的生命健康,其发病率及死亡率居高不下,已经成为人类健康的最大杀手[1]。传统的恶性肿瘤治疗方法在杀伤肿瘤细胞的同时,对正常细胞损害极大,而药物靶向治疗则为肿瘤的根治带来了希望。多数肿瘤细胞的增殖均通过生成新生血管来实现,而肿瘤新生血管的生成部位就是重要的药物治疗靶标[2],设计一种可以靶向肿瘤新生血管的多肽即可抑制多数肿瘤细胞的增殖。RGD肽是含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)的短肽,能与肿瘤细胞或肿瘤组织新生血管的某些整合素结合从而将治疗药物如抗肿瘤活性肽靶向性地导入肿瘤细胞,有效地降低肿瘤治疗过程中对正常细胞的损害[3-5]。再利用细胞穿膜肽与RGD肽结合可以携带大分子物质靶向性地进入细胞的性质将多肽携带进入肿瘤新生血管内皮细胞,对于突破细胞膜屏障,促进药物分子进入细胞,提高治疗效果具有重要意义[6]。本研究设计的QX3-1肽,同时含有RGD肽和细胞穿膜肽等片段,利用PCR的方法进行拼接和扩增,并通过大肠埃希菌表达出可能具有抑制肿瘤新生血管生成能力的多肽。QX3-1蛋白是将L-天门冬酰胺酶C末端127肽与QX3-1肽通过基因工程的方法共同表达的融合蛋白。构建pED-QX 3-1/BL21原核表达质粒,并在大肠埃希菌中诱导表达。以提高外源蛋白表达量为目标,从重组质粒高效表达的最适培养基、诱导的最适温度、最适诱导浓度和最适诱导时间4个方面优化重组质粒在大肠埃希菌中的表达条件,为后续的分离纯化及活性实验提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 pED质粒由pET28a改造修饰而来,E.colipED和E.coliBL-21均由中国药科大学刘景晶教授馈赠。
1.1.2 培养基 LB培养基、大豆肉汤培养基(TSB)、TB培养基、酪蛋白胨培养基(质量分数,%:酵母提取物 0.5,胰蛋白胨 1.0,NaCl 1.0,酪蛋白胨 0.5)。
1.1.3 试剂及仪器 广谱预混型蛋白分子量标记物(宝生物工程(大连)股份有限公司);酪蛋白胨(杭州百思生物技术有限公司);Yeast extract、Tryptone、硫酸卡那霉素、乳糖、三(羟甲基)氨基甲烷(Tris)、甘氨酸、过硫酸铵(APS)、丙烯酰胺、甲叉双丙烯酰胺、十二烷基硫酸钠(SDS)、TEMED、溴酚蓝(生工生物工程(上海)股份有限公司);甲醇、冰醋酸、考马斯亮兰R-250、β-巯基乙醇(国药集团化学试剂有限公司);甘油(丙三醇)(中国医药(集团)上海化学试剂公司),氯化钠(无锡市亚泰联合化工有限公司)。TGL-16B型高速离心机(上海安亭科学仪器厂);KYC-100C型空气恒温摇床(上海新苗医疗器械制造有限公司);ATX224型分析天平(Shimadzu Corporation);DYCZ-24DN型电泳仪、DYY-6C型电泳仪电源(北京六一生物科技有限公司);HHS11-2-S型水浴锅(上海新苗医疗器械制造有限公司);SW-CJ-1F型单人双面净化工作台(苏州净化设备有限公司);81-2型恒温磁力搅拌器(上海司乐仪器有限公司);Bio Spectrum 500 Imaging System(UVP);UV1102紫外可见分光光度计(Techcomp)。
1.2 方法
1.2.1 重组质粒的构建 试验中所用载体为pED质粒,pED质粒是在商品化质粒pET28a的基础上改造的,是适合于短肽高效表达的重组质粒,该重组质粒是将消去唯一酸水解位点的L-天门冬酰胺酶C末端127肽基因以及一组多克隆位点引入质粒pET28a的NocI和BamH I 位点之间构建而成。将目的基因片段插入到pED质粒中L-天门冬酰胺酶C末端127肽基因后面,构成融合蛋白基因,并预留酸水解位点,构建成表达载体pED-QX3-1。图1为pED-QX3-1重组质粒构建示意图。
1.2.2 SDS-PAGE电泳[7]由于目的蛋白的分子量约为24.0 kDa,因此选用12% SDS-PAGE电泳。将适当体积样品与2×蛋白质加样缓冲液混合后,煮沸5 min,待冷却后,轻度离心,即可上样,首先将电压调至60 V,待溴酚蓝电泳至分离胶时将电压调至120 V,至电泳结束。凝胶的组分见表1。
1.2.3 培养基的选择 将pED-QX 3-1/BL21重组菌分别接种于5 mL含卡那霉素(终浓度为50 μg/mL)的LB培养基、TSB培养基、TB培养基和酪蛋白胨培养基中活化过夜,次日分别转移至150 mL含卡那霉素(终浓度50 μg/mL)的4种培养基,待OD600达到0.6后,在相同时间、温度和乳糖浓度的条件下进行诱导表达。根据预实验的结果,分别于第18、20、22、24、26、28、30小时取样并离心,加入2×蛋白质加样缓冲液,煮沸5 min,然后进行12%的SDS-PAGE验证,并用Band Scan凝胶分析软件分析各组目的蛋白的表达量。
1.2.4 诱导温度的选择 将pED-QX 3-1/BL21重组菌分别接种于3支5 mL含卡那霉素(终浓度50 μg/mL)的酪蛋白胨培养基中活化过夜,次日将pED-QX 3-1/BL21重组菌分别接种于3瓶含卡那霉素(终浓度50 μg/mL)的酪蛋白胨培养基,待OD600达到0.6后,在相同的乳糖诱导条件下,分别在20、25和37 ℃诱导培养30 h,并定时取样1 mL,8 000 r/min,离心1 min,去上清,沉淀加2×蛋白质加样缓冲液后煮沸5 min,然后进行12%的SDS-PAGE验证,并用Band Scan凝胶分析软件分析各组目的蛋白的表达量。

图1 pED-QX3-1重组质粒构建示意图Fig.1 Illustration of recombinant plasmid pED-QX3-1

表1 12%SDS-PAGE凝胶组分Table 1 12%SDS-PAGE gel fraction
1.2.5 乳糖诱导浓度的选择 将pED-QX 3-1/BL21重组菌分别接种于3支5 mL含卡那霉素(终浓度50 μg/mL)的酪蛋白胨培养基中活化过夜,然后将pED-QX 3-1/BL21重组菌分别接种于含卡那霉素(终浓度50 μg/mL)的酪蛋白胨培养基,待OD600达到0.6后,加入乳糖,使其终浓度分别为1、5、10、 15和20 mmol/L,在37 ℃环境中振荡培养相同时间,分别取样并离心后,进行12%的SDS-PAGE验证,并用Band Scan凝胶分析软件分析各组目的蛋白的表达量。
1.2.6 诱导时间的选择 将pED-QX 3-1/BL21重组菌分别接种于3支5 mL含卡那霉素(终浓度50 μg/mL)的酪蛋白胨培养基中活化过夜,次日将pED-QX 3-1/BL21重组菌接种于含卡那霉素(终浓度50 μg/mL)的酪蛋白胨培养基,待OD600达到0.6后,加入乳糖,使其终浓度为10 mmol/L,37 ℃震荡培养42 h,分别于第18、20、22、24、26、28、30、42小时取样并离心,进行12%的SDS-PAGE验证,并用Band Scan凝胶分析软件分析各组目的蛋白的表达量。
2 结果与分析
2.1 培养基的选择
在其他诱导条件相同的情况下,pED-QX 3-1/BL21重组菌在LB、TSB、TB和CP 四种培养基中的生长速度及目的蛋白的表达情况均不一样。试验选用诱导温度为37 ℃,诱导剂浓度为5 mmol/L,诱导时间为30 h,结果显示融合蛋白在酪蛋白胨培养基中表达量最高(见图2)。

图2 不同培养基中融合蛋白的表达量Fig.2 Illustration of recombinant plasmid pED-QX3-1
2.2 诱导温度的选择
在其他诱导条件相同的情况下,pED-QX 3-1/BL21重组菌在不同温度下,融合蛋白的表达量均不相同。有研究[8-9]指出重组蛋白在大肠埃希菌中的表达通常在低温下进行,以提高表达蛋白质的溶解度和稳定性,然而,低温的使用严重限制了表达宿主的生长速度,导致蛋白质生产率降低。因此本实验选择20、25和37 ℃ 三个温度值,考察温度条件对融合蛋白表达量的影响。结果显示在37 ℃的条件下,融合蛋白的表达量最高(见图3),但表达出来的蛋白存在于包涵体中,属于不可溶性蛋白,因此,后续实验还将围绕如何将包涵体中的蛋白进行复性而展开。
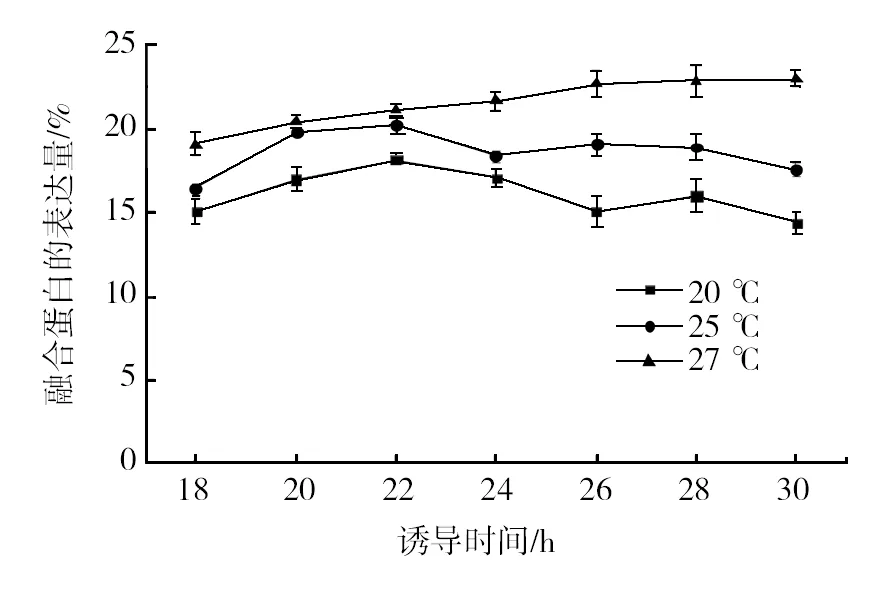
图3 不同诱导温度下融合蛋白的表达量Fig.3 Expression level of fusion protein in different temperatures
2.3 乳糖诱导浓度的选择
在其他诱导条件相同的情况下,pED-QX 3-1/BL21重组菌在诱导剂乳糖不同浓度的条件下,融合蛋白的表达量均不相同。试验选择将重组菌接入酪蛋白胨培养基中,在37 ℃条件下培养,分别于诱导后第10小时、第20小时和第30小时时取样,实验结果显示乳糖浓度在10 mmol/L时诱导效果最好(见图4)。

图4 不同乳糖诱导浓度下融合蛋白的表达量Fig.4 Expression level of fusion protein in different concentration of inducer
2.4 诱导时间的选择
在其他诱导条件相同的情况下,pED-QX 3-1/BL21重组菌在不同诱导时间,目的蛋白的表达量均有所不同。试验选择将重组菌接入酪蛋白胨培养基中,在37 ℃条件下加入10 mmol/L乳糖进行诱导,结果显示其表达量随时间的延长在不断增多,但当诱导时间超过24 h后,目的蛋白的表达量不再增加,并有稍许下降(见图5),加上时间及成本方面的考虑,因此选择24 h为最佳诱导时间。

图5 不同诱导时间下融合蛋白的表达量Fig.5 Expression level of fusion protein in different time
2.5 优化条件下融合蛋白的表达
按已优化的最适条件对QX3-1融合蛋白进行诱导表达,即将菌种活化后,转接至150 mL含卡那霉素的酪蛋白胨培养基中,于37 ℃, 震荡培养至OD600约为0.6 时加入乳糖(使其终浓度为10 mmol/L)进行诱导,分别于第0、18、20、22、24、26、28、30、42小时取样,8 000 r/min,离心1 min,取沉淀进行12%的SDS-PAGE 分析,用Band Scan凝胶分析软件分析目的蛋白的表达量。结果如图6和表2所示,表明研究中所选择的条件适合融合蛋白的表达,QX3-1融合蛋白的表达量达到了31.2%。图6中指示的目的蛋白的分子量约为48.0 kDa,比预测的分子量高出了一倍,推测可能是由于设计的融合蛋白形成了二聚体的原因。

图6 优化条件下融合蛋白的表达量Fig.6 Expression level of fusion protein in the best condition

表2 目的蛋白电泳密度扫描数据Table 2 Protein density scanning data after electrophoresis
3 讨 论
乳糖操纵子是一个在大肠埃希菌及其他肠道菌科细菌内负责乳糖的运输及代谢的操纵子。在小规模培养中用IPTG做诱导剂诱导乳糖操纵子的用途已得到充分的确立,然而,对于大规模培养,诱导剂的成本是一个很严重的限制[10]。IPTG的诱导条件非常简单,极低的浓度就可以达到很好的诱导效果,且在大肠埃希菌中不易被代谢和降解,效果持久。但IPTG具有潜在毒性,且价格昂贵,因而只作小规模诱导用。乳糖是二糖,对于乳糖操纵子具有天然的诱导作用,且价格低廉易得,有望成为IPTG的替代品。但是乳糖本身也会被细胞用作碳源代谢利用,其诱导机制比IPTG更为复杂,因此需要对菌体的生长及诱导条件进行更为精细的研究及优化[11-13]。比较两者,乳糖具有无毒、低廉的优点,在大规模发酵生产中比IPTG更具有优势[10]。而且,在Chunxiao等[14]和鲁健章等[15]的研究中,均用乳糖做诱导剂来诱导不同的蛋白表达,其表达量分别为50.975%和40.02%。Tian等[16]在研究中指出通过乳糖诱导蛋白表达可实现每升培养基培养获得255 mg纯的rhKGF-2,比通过IPTG诱导获得的高52%。以上研究表明乳糖作为诱导剂具有良好的稳定性和可靠性。
pED-QX 3-1/BL21重组菌在普通LB培养基中融合蛋白的表达量最高只有16.7%,表达量较低。为提高融合蛋白的表达量,对培养基的成分做了相应的调整。通过分析目的肽序列中氨基酸的含量,发现目的蛋白中含谷氨酸、亮氨酸、赖氨酸和精氨酸较多,因此选用了含这四种氨基酸较多的培养基—酪蛋白胨培养基。本实验室自制的酪蛋白胨培养基,是在普通LB培养基的基础上添加了0.5%的酪蛋白胨,使融合蛋白的表达量达到了31.2%,提高了近1倍。融合蛋白在改良的培养基中得到了较为高效的表达,为后续融合蛋白的分离、纯化及活性检测等实验奠定了基础。
重组菌在不同培养基中的生长速率均不相同,在普通LB培养基中达到OD600≈0.6的时间约为2.5 h,在TSB培养基中达到OD600≈0.6的时间约为2.7 h,在TB培养基中则需要的时间约为3.5 h,而在酪蛋白胨培养基中需要的时间更长,约为4.7 h。LB培养基是大肠埃希菌生长的最适培养基,但是这仅仅是就大肠埃希菌表达自身蛋白而言的,对于外源基因的插入,LB培养基所提供的营养成分或许已不再适用于外源蛋白的表达。而酪蛋白胨培养基中含有的营养成分虽适合外源蛋白的表达,但对于大肠埃希菌自身蛋白的表达却不一定适用,因此,重组菌在酪蛋白胨培养基中的生长速率最慢,但同时其外源蛋白的表达量也最高。目前,从融合蛋白中分离纯化目的蛋白的工作正在进行中,该目的蛋白是否具有生物活性及其是否具有抑制肿瘤新生血管的生成作用也有待在后续实验中进行评估。

