固相支持液-液萃取/液相色谱-串联质谱法测定人全血中环孢素A
利 利,贾叶青,张倩影,张爱国,王曼曼,李冬梅,3*,王学生*
(1.华北理工大学 公共卫生学院,河北 唐山 063210;2.华北理工大学附属医院,河北 唐山 063000;3.华北理工大学 药学院,河北 唐山 063210)
环孢素A(Cyclosporin A,CsA,图1)是一种强效、高选择性的免疫抑制剂,临床上用于治疗肝、肾等器官移植的排斥反应和其他自身免疫性疾病,但存在治疗窗窄、副作用多、口服生物利用度不稳定、个体间及个体内的药代动力学差异大等问题[1]。在临床应用中,肾脏和心脏移植患者的CsA安全用药浓度范围为100~200 ng/mL,肝脏移植患者为100~400 ng/mL[2]。因此,在患者治疗过程中,为提高CsA免疫抑制作用,减少其毒性作用,准确监测CsA的血药浓度具有重要的临床意义。

图1 环孢素A和环孢素D的化学结构式Fig.1 Chemical structures of CsA and CsD
目前,CsA血药浓度分析方法主要包括光谱法、色谱法和免疫法等,其中色谱法为常用方法[3-6]。由于血液成分复杂,所含杂质干扰测定,且血液中待测组分含量较低,难以检出,因此在仪器分析前需对样品中的待测物进行富集和净化。目前,生物样品中CsA的前处理方法主要有液-液萃取法(LLE)[7-9]和固相萃取法(SPE)[10],但LLE法溶剂使用量大、耗时,不适用于高通量分析检测;SPE法通常需活化、上样、淋洗和洗脱,步骤较多,易出现操作误差和污染。因此,建立简单、快速测定血液样品中CsA的方法具有重要的研究意义和实际价值。
固相支持液-液萃取(Solid supported liquid-liquid extraction,SLE)法作为一种新型前处理方法,是在传统液-液萃取法的基础上,采用硅藻土为吸附剂,利用其吸水性强、性质稳定的特点,快速吸附样品基质中的水分,在吸附剂表面形成液膜,从而使目标物与水相分离,实现对目标物的富集与净化。SLE不仅避免了活化和淋洗步骤,操作简单,且具有不易产生乳化、基质效应低和样品用量少等优点[11]。Yoshikawa等[12]利用SLE前处理结合液相色谱-串联质谱分析,建立了鸡肉中多种兽药残留的分析方法;Gao等[13]发展了一种SLE结合高效液相色谱-串联质谱法同时测定人尿中阿米他唑、杀螨甲菊酯、甲胎菊酯及其主要代谢物的方法。SLE方法已成功应用于医药、食品和环境等[12-16]样品的前处理。
本研究采用SLE对全血样品中CsA进行净化和萃取,结合液相色谱-串联质谱法(LC-MS/MS),以环孢素D(Cyclosporin D,CsD,图1)为内标物进行定量,建立了人全血中CsA的准确定量分析方法,可为临床CsA血药浓度监测提供新的技术支持。
1 实验部分
1.1 仪器与试剂
LCMS-8040液相色谱-串联质谱仪(日本岛津公司):液相色谱包括CBM-20A控制器、LC-30AD泵、DGU-20A5R脱气系统、SIL-30AC自动进样器和CTO-20AC柱温箱;质谱为三重四极杆串联质谱仪,电喷雾电离源,软件控制系统为LabSolutions LCMS Ver.5.53。ET-3301A型氮气浓缩仪(天津恒奥科技发展有限公司);Sigma 3K-15型离心机(上海精宏实验设备公司);Milli-Q水纯化系统(美国Millipore公司)。
甲醇、乙腈(色谱纯,美国Sigma-Aldrich公司);正己烷(n-Hex,99.5%)、二氯甲烷(DCM,99.8%)、甲基叔丁基醚(MTBE,99.7%)均购自北京迪马科技有限公司;乙酸乙酯(EA,99.0%,上海阿拉丁试剂公司);石油醚(PE,天津富宇精细化工有限公司);SLE柱(1 mL)购自上海拜泰齐贸易有限公司。
标准物质CsA(99.0%,Toronto Research Chemicals公司(加拿大)),CsD(99.0%,上海同田生物技术股份有限公司)。使用甲醇分别配制1 g/L的CsA和CsD标准储备溶液,4 ℃下避光储存。
1.2 样品制备
收集河北省某医院10例骨髓移植术后患者的全血样品,于-80 ℃下冷冻保存,使用前自然解冻至室温。本试验经医学伦理委员会批准。
取全血样品200 μL置于1.5 mL离心管中,加入200 μL硫酸锌溶液(0.1 mol/L)涡旋1 min后,2 500 g离心4 min,转移上清液(约120 μL),用甲醇-水(体积比5∶95)定容至0.8 mL待用。
1.3 SLE方法
将0.8 mL样品上样至SLE柱,静置10 min,使样品溶液充分浸润并均匀分布在吸附剂表面,用7 mL甲基叔丁基醚对分析物进行洗脱。收集洗脱液,25 ℃氮吹至干,用甲醇定容至200 μL。
1.4 LC-MS/MS条件
色谱条件:Shim-pack XR-ODS色谱柱(75 mm×3.0 mm i.d.,2.2 μm,日本岛津公司);流动相为乙腈-水(体积比95∶5);流速为0.3 mL/min;进样量为10 μL;柱温60 ℃。
质谱条件:电喷雾电离源,正离子模式ESI(+);扫描方式:多反应监测(MRM)模式;雾化气流速:3 L/min;干燥气流速:15 L/min;离子源温度:300 ℃;加热块温度:450 ℃;碰撞气电压:230 kPa。CsA及其内标物CsD的保留时间分别为2.1、2.5 min,质谱分析参数离子对(m/z)分别为1 219.8/1 202.7、1 233.8/1 216.6,碰撞能量(eV)分别为17、28。
2 结果与讨论
2.1 SLE萃取条件的考察
SLE进行样品前处理时,无需活化和淋洗步骤,水溶液样品直接上样,完全吸附后,利用有机溶剂洗脱,即可达到快速萃取和净化的目的,因此洗脱溶剂的选择决定了SLE的准确度。另外,洗脱后需对样品进行氮吹浓缩。因此,本实验对氮吹蒸发压力、洗脱溶剂种类及体积进行优化,实验平行进行3次。
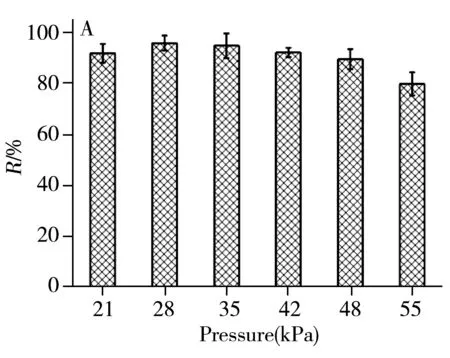
2.1.1氮吹蒸发压力在25 ℃条件下,考察了氮吹蒸发压力(21~55 kPa)对5 mg/L CsA标准溶液回收率的影响(图2A)。结果显示,氮吹蒸发压力为28 kPa时CsA的回收率最高,因此最终选择氮吹蒸发压力为28 kPa。
2.1.2洗脱溶剂种类SLE的洗脱溶剂应与水不混溶,且对CsA有良好的溶解性。在CsA上样质量浓度为5 mg/L,上样体积为0.8 mL,洗脱溶剂体积为7 mL的条件下,分别考察了正己烷、石油醚、乙酸乙酯和甲基叔丁基醚作为洗脱溶剂时CsA的回收率(图2B)。结果表明,甲基叔丁基醚对目标物的回收率最高,故采用甲基叔丁基醚作为SLE的洗脱溶剂。
2.1.3洗脱溶剂体积在CsA上样质量浓度为5 mg/L,上样体积0.8 mL的条件下,考察了甲基叔丁基醚体积(5、6、7、8 mL)对CsA回收率的影响(图2C)。结果显示,当甲基叔丁基醚用量为7 mL时CsA的回收率最高,用量为8 mL时回收率反而降低,可能是由于氮吹时间延长导致了CsA损失。因此,实验选择甲基叔丁基醚的体积为7 mL。

图3 空白血样加标(A)和标准溶液(B)的MRM谱图Fig.3 MRM chromatograms of spiked samples of whole blood(A) and standard solution(B)CsA:100 μg/L;CsD:200 μg/L
2.2 线性关系、检出限及定量下限
采用“1.4”条件对0、1.5、5、15、50、150、500 μg/L的CsA和200 μg/L CsD内标物溶液(n=3)进行分析,测定目标物峰面积,以CsA与CsD峰面积的比值(y)为纵坐标,CsA的质量浓度(x,μg/L)为横坐标,建立标准曲线,结果显示,CsA在1.5~500 μg/L范围内呈良好的线性关系,线性方程为y=0.004 6x+0.003,相关系数(r)为0.998,检出限(LOD,S/N=3)为0.5 μg/L,定量下限(LOQ,S/N=10)为1.5 μg/L。
2.3 回收率与相对标准偏差
以空白全血加标样品进行回收率和精密度实验,分别添加50、100、400 μg/L 3个水平的CsA标准溶液和200 μg/L的CsD标准溶液,每组平行实验3次。CsA的平均加标回收率为78.6%~83.5%,日内和日间相对标准偏差(RSD)分别为3.1%~5.6%和4.5%~8.3%。图3为空白血样加标和标准溶液的MRM谱图,由图可见,在最优条件下,将加标100 μg/L CsA和200 μg/L CsD的健康人全血经SLE萃取后,目标物在出峰位置无明显基质干扰,特异性良好。表明本方法能够有效净化和萃取全血基质中的CsA。
2.4 实际样品分析
在最优实验条件下,使用SLE结合LC-MS/MS测定10例骨髓移植术后患者全血样品中CsA的浓度。结果显示10例样品的CsA质量浓度为100~400 μg/L,均在安全血药浓度范围内。分别向实际样品添加100 μg/L的CsA标准溶液和200 μg/L的CsD标准溶液,每组平行实验3次,计算得10例骨髓移植术后患者的平均加标回收率为79.5%±2.1%。
2.5 方法比较
为进一步说明所建方法的可行性,将本方法与文献方法进行对比(表1)。与血样中CsA的常用前处理方法LLE、SPE法相比,本方法的回收率与文献方法相当,但灵敏度更高,且避免了活化和淋洗步骤,溶剂用量少,操作简单。

表1 本方法与文献方法的分析结果对比Table 1 Comparison of the present method with the reported methods for determination of CsA in the whole blood samples
3 结 论
本研究建立了基于SLE前处理技术结合LC-MS/MS测定全血中CsA的分析方法,该法简便快速,灵敏度和准确度良好,可为临床CsA血药浓度监测提供技术支持和个性化用药依据,有助于更加准确指导临床进行剂量调整,优化药物治疗方案。

