大鼠死后肠道菌群演替规律
李 欢 ,刘睿娜 ,张思若 ,袁 璐 ,徐纪茹
(1.西安交通大学医学部基础医学院,陕西西安710061;2.西安交通大学医学部法医学院,陕西西安710061)
死亡时间(postmortem interval,PMI)推断方法较多,但利用微生物学方法推断PMI相对很少。死亡微生物组[1-7]是一个相对较新的名词,是对动物死后定植于内脏与孔道的微生物群的研究。由于微生物在人死后尸体腐烂整个过程中呈现连续、不间断的变化(种类、数量、位置等),可以用于PMI的推断。有研究结果[8]显示,在腐败过程中,变形菌门(丙型变形菌纲)在口腔和直肠中成为主要的门类,而厚壁菌门和拟杆菌门在口腔和直肠都减少,与直肠相比较而言,活鼠的口腔微生物群落结构与立即死亡的SD大鼠之间有显著不同。该研究结果表明,微生物群落可以估算“微生物钟”。国内外学者对于死亡微生物组的研究,所选择标本的来源除了人的尸体以外,还有猪[9-14]或者幼小的啮齿类动物[11-12,15]的尸体。本研究旨在探索大鼠死后肠道菌群在不同时间点的变化规律。
1 材料与方法
1.1 研究对象
雄性SD健康大鼠3只,体质量 200~220 g,由西安交通大学动物实验中心提供,并获动物伦理委员会批准。
1.2 仪器和试剂
一次性无菌棉签拭子(江苏康健医疗用品有限公司),C1000 TouchTMThermal Cycler PCR 仪、DCodeTM变性凝胶电泳仪、Gel DocTM2000凝胶成像仪(美国Bio-Rad 公司),InGenius3 Gel Documentation System成像仪(英国Syngene公司),粪便基因组DNA提取试剂盒[DP328-02,天根生化科技(北京)有限公司],丙烯酰胺、甲叉双丙烯酰胺、尿素、去离子甲酰胺、琼脂糖、溴化乙啶(ethidium bromide,EB)、DL2000 DNA标记(日本TaKaRa公司)。
1.3 实验方法
1.3.1 收集标本
3只大鼠于鼠笼中置于室内,适应性喂养两周,不做任何干预(编号A、B、C),允许昆虫接触。颈椎脱臼处死后置于室内[平均温度为(8.22±3.04)℃,湿度为20%~30%]提前准备的鼠笼中,用无菌棉签蘸取无菌生理盐水擦拭直肠60 s[12],分别于处死后第 1、5、10、15、20、25、30天收集肠道菌群标本,观察尸体随时间的变化情况,并按照新鲜期、膨胀期、腐烂活跃期、腐烂晚期和干腐期[13-14]进行分类。
1.3.2 肠道菌群结构分析
(1)DNA提取。应用粪便基因组DNA提取试剂盒提取粪便样品中菌群总DNA。
(2)DNA 扩增。 利用 C1000 TouchTMThermal Cycler PCR仪扩增所得DNA产物,第一轮选择引物1492R(5′-GGTTACCTTGTTACGACTT-3′)和 27F(5′-AGAGTTTGATCCTGGCTCAG-3′)扩增16S rRNA基因,第二轮选择细菌16S rRNA-V3区通用引物534R(5′-ATTACCGCGGCTGCTG-3′)和 GC 夹(5′-CGCCCG CCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGG-3′)的 341F(5′-CCTACGGGAGGCAGCAG-3′)扩增16S rRNA V3区。第一轮PCR体系为25 μL,包含2.5 μL MgCl2(25 mmol/L)、2.5 μL 10×缓冲液、dNTP 0.5μL、上下游引物各 0.5μL(均为 10mmol/L)、0.2μL Taq DNA 聚合酶(日本 TaKaRa公司)、4 μL 的 DNA模板(细菌基因组DNA)、14.3 μL H2O。反应程序:95℃ 5min;95℃ 30s,55℃ 30s,72℃ 90s,35 个循环;72℃ 10min,4℃恒温保持。第二轮PCR体系为50 μL,包含 5 μL MgCl2(25 mmol/L)、5 μL 10×缓冲液、上下游引物各 1 μL(10 μmol/L)、1 μL 的 dNTP混合物(均为 10 mmol/L)、0.4 μL Taq DNA 聚合酶(5U/μL,日本 TaKaRa 公司)、4μL DNA 模板、32.6μL H2O。采用“touchdown”反应程序:95℃ 5 min;95℃40 s,65℃ 40 s,72℃ 1 min;退火温度每两个循环下降1℃,直至温度下降到55℃,在此温度再进行10个循环,最终72℃ 10min,4℃恒温保持。PCR产物利用2%琼脂糖凝胶、100V电压电泳50min验证,EB染色15 min,InGenius3 Gel Documentation System 成像仪观察凝胶电泳结果。
(3)变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)指纹图谱分析。扩增产物使用DCodeTM变性凝胶电泳仪进行指纹图谱分析,PCR片段由8%聚丙烯酰胺凝胶电泳在1×TAE缓冲液中分离。聚丙烯酰胺包含30%~65%线性变性梯度:30%的变性剂(100mL)包含 40%双丙烯酰胺 20mL,50×TAE缓冲液2mL、甲酰胺12 mL、尿素12.6 g,超纯水定容到100mL。65%的变性剂(100mL)除甲酰胺(26mL)和尿素(27.3g)与30%的变性剂不同,其余试剂均不变。100%变性剂包含7.0 mol/L尿素和体积分数为40%去离子甲酰胺。90V恒定电压、1×TAE缓冲液保持 60℃,电泳 14 h,EB 染色 30 min,Gel DocTM2000凝胶成像仪获得胶图并完成标记工作。
肠道菌群的多样性利用Quantity One®1-D分析软件(美国Bio-Rad公司)分析指纹图谱中条带数目、灰度值,采用微生物群落多样性Shannon-Wiener指数(H’)分析肠道菌群细菌类型的多样性,公式如下[16]:

式中:H’为样品的信息含量,即群落的多样性指数;S为种数;Pi为样品中属于第i种的个体的比例,如样品总个体数为N,第i种个体数为ni,则Pi=ni/N。利用Quantity One®1-D分析软件对群落进行非加权的配对分析(unweighted pair-group method with arithmetic means,UPGMA)、聚类分析,利用 Microsoft Excel计算Dice相似性系数(coefficient of similarity,Cs),并制作肠道菌群Cs累积曲线,x轴为样本之间的Cs,y轴为所有小于或等于某特定Cs数值所占的百分比。利用SPSS 17.0计算组内Cs,对7组的DGGE条带数、H’值、组内Cs进行方差分析(analysis of variance,ANOVA)和 t检验。 检验水准 α=0.05。
1.3.3 条带回收和切胶测序
在紫外线照射下,用干净刀片仔细切下所选条带(尽量去除多余的凝胶),采用胶回收试剂盒,获取凝胶中DNA片段,溶解在Elution缓冲液中4℃保存。以回收的DNA为模板,再次PCR扩增。反应体系按照前述进行。改用V3区通用(不需GC夹)引物V3-F:5′-CCTACGGGAGGCAGCAG-3′和 V3-R:5′-ATT ACCGCGGCTGCTGG-3′。扩增程序改为普通PCR程序:95℃ 5min;95℃ 1min,55℃ 1min,72℃ 1min,进行35个循环;72℃ 7min,4℃保存。
取PCR产物2μL,琼脂糖凝胶电泳检测后,直接将PCR产物送生工生物工程(上海)股份有限公司测序。将测序结果进行序列比对。
2 结 果
2.1 尸体情况
本研究发现:大鼠尸体前4d未发生肉眼可见的明显变化,归为新鲜期;第5天开始膨胀,5~6 d为膨胀期;第7天破裂,流出液体,7~8d为破裂期;第11天出现蛆虫,并逐渐增多,11~13d为腐烂活跃期,在腐败菌作用下,尸体产生大量腐败气体,包括硫氢化物、甲烷、尸胺、腐胺[17]。随着蛆虫的侵蚀以及自身水分的流失,第18天尸体变干,之后时间点归到干腐期。
2.2 DGGE指纹图谱分析
肠道菌群DGGE指纹图谱如图1、表1所示,其条带数量、位置和亮度在不同样本中呈现不同的特征。方差分析显示,各组条带数之间差异有统计学意义(P<0.05),表明随死亡时间的推移,肠道菌群种类呈现减少趋势。组间两两比较发现:第1天菌群多样性高于其他组;第 5、10、15、20、25、30 天的条带数两两之间差异有统计学意义(P<0.05)。
方差分析显示,各组间H’值差异具有统计学意义(P<0.05)。组间两两比较发现:第1天与其他组的H’值之间差异有统计学意义(P<0.05),表明第1天菌群种类多于其他组。 第 5、10、15、20、25、30 天的条带数之间差异有统计学意义(P<0.05)。

图1 DGGE指纹图谱
表1 DGGE指纹图谱相似性与多样性分析 (n=3,±s)

表1 DGGE指纹图谱相似性与多样性分析 (n=3,±s)
注:1)第 5、10、15、20、25、30 天两两比较,P 均<0.05;2)与第 1 天比较,P<0.05;3)与第 5 天比较,P<0.05;4)7 组间组内比较
时间/d 细菌多样性 组内Cs/%DGGE 条带数/条1) H’1)1 30.00±5.35 3.40±0.18 47.20±10.29 5 18.00±4.352) 3.21±0.472) 40.72±10.292)10 14.67±3.792) 2.66±0.252) 27.37±9.752)15 15.00±1.732) 2.70±0.112) 30.84±11.542)20 14.33±1.152) 2.66±0.082) 25.58±10.292)25 11.00±1.002) 2.40±0.092) 22.43±10.002)3)30 10.33±2.082) 2.32±0.212) 24.43±13.962)3)P 值 4) 0.015 0.013 0.000
组内Cs的方差分析显示,各组间差异有统计学意义(P<0.05)。各组组内Cs的两两比较发现:第1天与其他组间差异有统计学意义(P<0.05);第5天和第25、30天的组内Cs之间差异有统计学意义(P<0.05);其他组间的两两比较差异无统计学意义(P>0.05)。
UPGMA聚类分析结果(图2)显示,7个时间点的大鼠肠道菌群聚集为3个主要分支:第1天聚集在最下支,第 5、10、15 天聚集于中间支,第 20、25、30 天聚集于最上支。有些时间点存在交叉,同一天的样本至少有两个聚集在了一起(除外30天)。Cs累积分布曲线(图3)显示:第1天个体之间相似性最高,第30天最低(曲线越靠近X轴,组内相似性越高);除第15天,随着死亡时间推移各组个体之间相似性呈现下降趋势。
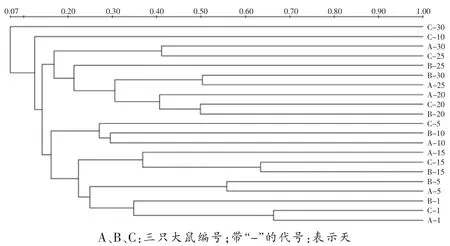
图2 DGGE指纹图谱聚类分析(基于Cs的UPGMA分析)
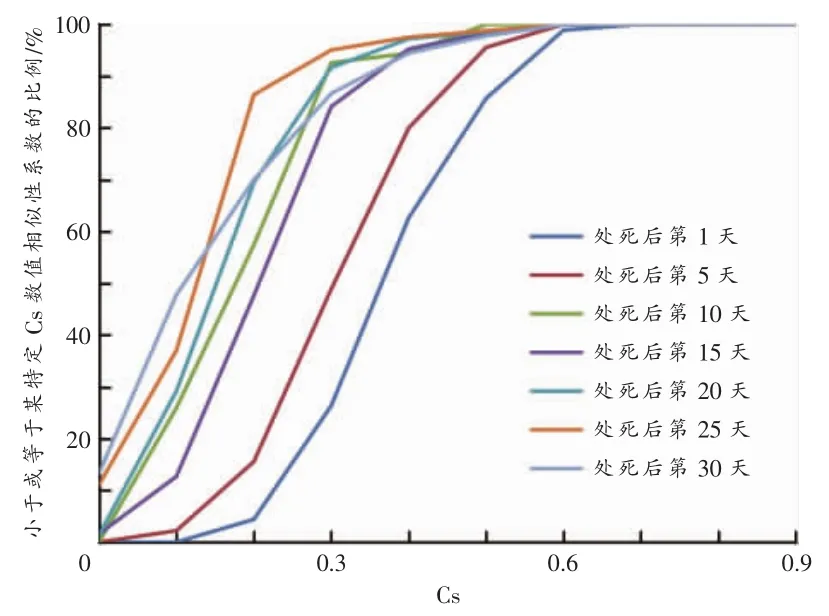
图3 大鼠处死后肠道菌群Cs累积曲线
2.3 DGGE指纹图谱条带切胶测序和测序比对结果
从图4可以看出,处死后第1天菌群种类明显多于其他时间组。处死后第1、5天大鼠肠道菌群以肠球菌属(Enterococcus sp.)为主;处死后第 10、15、20 天以苏云金芽孢杆菌(Bacillus thuringiensis)为主,松鼠葡萄球菌(Staphycococcus sciuri)消失;处死后第 25、30天以粪肠球菌(Enterococcus faecalis)为主。
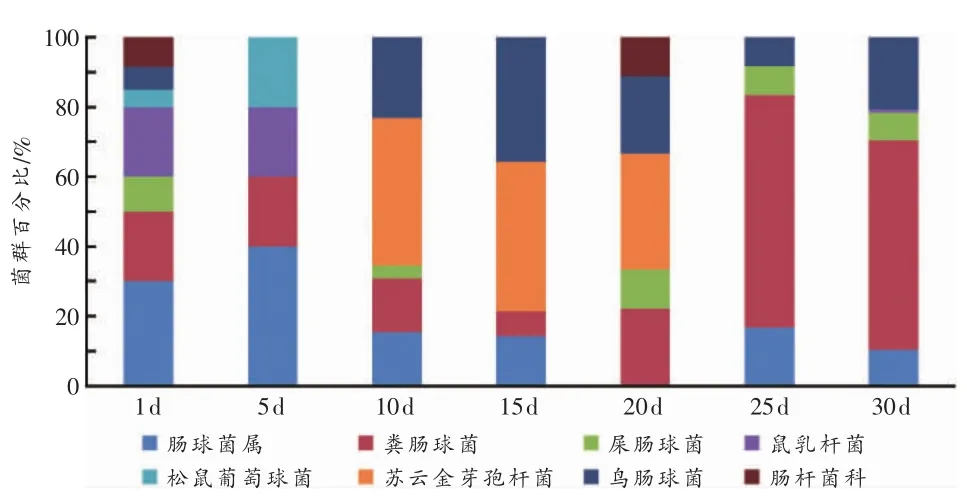
图4 处死后大鼠肠道菌群分布
3 讨 论
微生物的研究至今主要致力于共生菌和病原菌,以促进人类健康,但是对于宿主死后微生物的连续变化却知之甚少。在成人肠道中,微生物数量可达1012~1014个,细菌的种类达1 000多种。宿主死亡后其尸体的降解各个环节都有微生物的参与,除外其固有菌,随PMI的延续,肠道、皮肤以及其他组织器官菌群的多少、种类、组成结构都可能发生显著变化,并且菌群也会随环境,如温度、湿度、pH值等条件的变化而变化,从而对尸体的腐败发挥不同的作用。本研究利用DGGE对DNA在不同浓度的变性剂中解链行为不同,将片段大小相同而碱基组成不同的DNA片段分开,检测片段大小在500bp(本研究DNA片段为196bp)以内,以检测优势菌群[14]。
本研究结果显示,厚壁菌门为主要门类,与以往研究[8]腐败过程中以变形菌门为主不同。本研究的温度[(8.22±3.04) ℃]、湿度(20%~30%),与文献[8]中的温度(22.71~27.67℃)、湿度(60.29%~89.38%)相差甚远,这两个因素对菌群的种类有很大的影响。
处死大鼠肠道菌群不同时间点多样性具有显著差异,表明大鼠处死后不同时间点之间肠道菌群都有各自组成特点和结构特征,也表明肠道菌群用来估算PMI是可行的,印证和拓展了以往研究[1,8]。大鼠处死后肠道菌群多样性除第15天外均随时间推移呈递减趋势。第15天的突然增长或许是因为:(1)外界环境条件的变化,如温度、湿度等;(2)取样污染;(3)大鼠尸体自身发生的变化所致。
本研究 UPGMA 聚类分析时,第 10、15、20、30 天组内样本未完全聚集,究其原因可能是因为:(1)Quantity One®1-D分析软件对DGGE图谱的分析存在诸多不确定因素,如对条带自动识别时,比较亮的条带可以识别,但对亮度不够的条带则不能识别,此时便需要人为添加,肠道菌群种类繁多,呈现在图谱中的条带数量很大,人为不能将所有的条带都进行标记,便会导致结果偏倚。(2)比对不同泳道同一位置条带时,也需要人为调节,容易产生误差。所以,DGGE图谱的分析结果提示了大致的变化趋势,准确的方法需要依靠高通量测序。
目前,PMI推断仍是法医学的重点、难点问题,法医学者推断PMI的方法[18]包括分子生物学、光谱学、昆虫学、死亡化学等,但仍未实现准确推断PMI的目的。本研究通过对处死后大鼠不同时间点肠道菌群多样性、相似性、变化规律以及不同时间段大致的菌属组成进行分析,表面肠道菌群作为推断PMI的“微生物钟”是可行的。随着研究的不断深入,若可以发现不同时间点不同的菌属便可将其作为该时间点的生物标记。
本研究虽然揭示了大鼠死后肠道菌群变化的规律,但由于采样点选取、一代测序技术的局限以及切胶处理、比对的误差,并未得到所有细菌在各个时间点的组成结构。本研究结果为以后进一步的研究打下了基础,也对后期进一步研究有所启发。例如,除肠道外,还可以增加皮肤、口腔等部位的菌群样本,以寻找最能体现死亡时间的特征菌群,在此基础上增加时间点和样本数量,提高PMI推断的准确性。

