短时程脊髓电刺激治疗头面部平滑肌瘤引起的神经病理性疼痛1例
蔡少康 廖 翔 蔡 毅 熊东林 李颖波 △
(1华中科技大学同济医学院附属武汉市中心医院疼痛科,武汉430061;2深圳市南山区人民医院医院疼痛科,深圳 518000)
多发性皮肤平滑肌瘤好发于头面部、背部和四肢伸侧[1],以疼痛性结节为临床特征表现,多伴有自发性疼痛,国内外临床上多采用平滑肌松弛剂治疗,对疼痛有一定疗效,相关文献报道使用硝苯地平也可缓解皮肤平滑肌瘤的疼痛[2]。然而,目前对于平滑肌瘤引起的疼痛治疗方法有限,且疗效欠佳。我科近几年开展了脊髓电刺激治疗各种神经病理性疼痛,于2017年11月使用短时程脊髓电刺激治疗1例因头面部平滑肌瘤引起的头颈部疼痛的病人,放置电极刺激2周后拔除,病人病情较前好转,现报道如下:
方 法
1.一般资料
男性病人,58岁,诉反复左侧头面部疼痛10余年,加重1年。疼痛部位分布于左侧眶上、额部及左侧头部,呈阵发性放电样、针刺样疼痛,每天发作5次左右,发作持续时间1~2分钟,冷刺激可诱发疼痛感,间歇期无明显疼痛。近1年来疼痛发作次数增加,持续时间延长,曾在外院诊断为“三叉神经痛”并行半月神经节和颈部神经射频治疗(具体不详),疼痛改善欠佳;病人发病期间长期口服镇痛药物,疼痛控制不理想,于2017年11月来我科就诊。
体格及相关实验室检查:一般情况可,病人左侧眶上、额部及左侧颞骨、枕部毛发处可见广泛平滑肌瘤分布,病人情绪焦躁,通过采用疼痛视觉模拟评分(visual analogue scale, VAS)及焦虑自评量表(self-rating anxiety scale, SAS) 和抑郁自评量表 (selfrating depression scale, SDS) 对病人进行评定,提示病人存在中度焦虑及抑郁状态,采用匹兹堡睡眠质量指数评定病人存在睡眠障碍,左面部痛温觉及轻触觉敏感。静息VAS:5分,疼痛状态VAS:10分。实验室及影像学检查未见明显异常。
病人疼痛症状符合神经痛特点,疼痛区域主要局限在平滑肌瘤密集区(左侧眶上、额部及左侧头部),病人每日剧烈疼痛发作2~3次,每次持续5~15分钟,程度剧烈,VAS:10分。考虑病人多次尝试射频等介入治疗,现口服药物治疗效果不佳,科室讨论并取得病人同意,给予短时程脊髓电刺激术治疗。
2.治疗方法
入院给予口服镇痛药等治疗效果欠佳,建议择期行脊髓电刺激术治疗,调节神经功能,缓解疼痛症状,告知病人病情,完善术前准备。于2017年11月12日送介入手术室,局麻下行脊髓电刺激术(见图1、2)。术中病人取俯卧位,由于上胸段硬膜外腔小,为保证穿刺进针安全性,穿刺点定位于T11/T12椎间隙。常规消毒、铺巾,局部麻醉后,持Tuohy穿刺针与皮肤约成30度角进针,后接玻璃空针(空针内约2 ml空气)进针约5 cm后,玻璃空针负压消失,Tuohy穿刺针进入硬膜外腔,回抽无脑脊液及血液,拔出针芯,将球管调至正位,在C形臂机下置入8触点电极,调整电极位置在颈段硬膜外腔正中稍偏左,电极位置位于寰椎椎体上缘和枢椎之间,电极调整到最佳位置后开启测试模式,调节电压2 V、频率40 Hz、脉宽210 μs,病人诉左侧额部顶部、枕部等平滑肌瘤分布区出现酥麻感并覆盖头面部疼痛区域,表示测试成功。将Tuohy穿刺针拔出,将电极插入到接头组件中,缝合皮肤切口,无菌纱布包扎,胶布固定。术中严格无菌操作,术中、术后病人无诉特殊不适。将电极导线接上接收器,给于病人不同触点的测试,根据病人的感觉及舒适度调节至电压1 V、频率60 Hz、脉宽210 μs后病人疼痛缓解。术程顺利,术中麻醉情况满意,出血量约1 ml。术中、术后病人生命体征平稳,安返病房,术后予抗感染、抗炎镇痛等治疗。
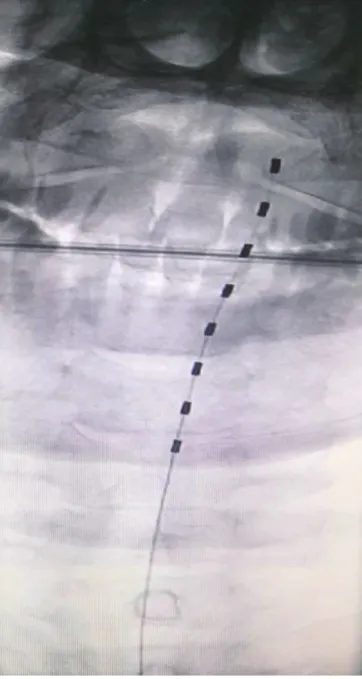
图1 颈椎正位

图2 颈椎侧位
结 果
电极置入后,病人自觉电刺激覆盖疼痛区域60%,体位改变时偶可有左上肢麻木感,静息VAS:1分,疼痛发作时VAS:3~4分。电极置入两周时间内,静息VAS:1~3分,发作时VAS:3~5分,疼痛发作持续时间缩短在3分钟左右,焦虑自评量表 (SAS) 和抑郁自评量表 (SDS) 提示病人情绪较前改善明显,夜间有睡眠时间延长。2周后电极拔除。3个月回访病人疼痛发作时间及间歇期明显延长,静息VAS:2~4分,发作时VAS:4~6分,偶尔疼痛发作评分大于7分时口服非甾体药物即可有效控制疼痛。
讨 论
平滑肌瘤多分布于面、颈、躯干及四肢,呈群集分布或者融合呈斑块状[3],生长缓慢,多伴自发性、阵发性疼痛,压迫或寒冷刺激疼痛感加重。由于平滑肌遇冷收缩,挤压皮肤神经纤维束导致疼痛感觉,所以冰块试验有诊断和鉴别诊断的价值。研究提示[4]:皮肤平滑肌瘤引起的疼痛是由于肌瘤压迫皮肤神经所致,Mann在电镜研究结果也支持皮肤平滑肌瘤直接侵犯皮肤神经引起疼痛[5]。本例病人平滑肌瘤引起的头面部疼痛的原因可能是颈丛神经根的感觉纤维受到刺激。皮肤组织损伤不仅可通过外周机制引起周围性敏化,当伤害性刺激兴奋脊髓神经元后,还可通过兴奋脊髓神经突触改变其兴奋性,导致中枢性敏化[6]。研究发现[7],中枢神经敏化在神经病性疼痛的发病过程中表现为疼痛区域的扩大且反复出现爆发性疼痛,降低病人对疼痛的耐受。在慢性疼痛动物模型上[8],神经损伤后脊髓背角突触前 γ-氨基丁酸 (γ-aminobutyric acid, GABA)释放减少,从而不能抑制痛觉过敏现象,引起自发、持发性疼痛。
短时程脊髓神经电刺激已经被证实能治疗神经性疼痛[9]。其镇痛机理一般认为是基于闸门理论学说,通过不断刺激后柱脊髓背角,减少疼痛信号传导,降低了神经可塑性改变,遏制了神经中枢敏化;同时,神经电刺激双向传导作用亦可改善外周神经有害神经递质释放,从而抑制外周敏化的持续作用[10],进而达到止痛效果[11]。本例病人面部疼痛部位分布于三叉神经体表投影区,将电极放置于颈椎硬膜外间隙后部,紧邻脊髓后柱,行电刺激后,除颈神经支配区域的痛感缓解外,左侧眶上、额面部疼痛感随之缓解。其机制在于头面部所有的表面和深层结构都是由三叉神经及第C2-3神经支配的,神经解剖学研究发现,上部颈神经和三叉神经核团之间联系密切,颈神经和三叉神经在三叉神经尾核水平有解剖和功能重叠[12],所以在治疗中,电刺激可能同时调节并缓解了颈神经和三叉神经支配区域的痛觉感受[13],进而缓解了头面部疼痛。此外,在动物实验研究中发现[14],SCS的镇痛机制可能与调节脊髓内抑制性神经递质有关,电刺激可诱导导水管周围灰质释放GABA,通过激活位于脊髓后角的GABA受体,产生突触前和突触后抑制效应,降低兴奋性神经递质,抑制伤害性信息的传递,发挥内源性镇痛效应。
本例病人2周后取出电极,电话随访术后3个月疼痛评分为静息VAS:2~4分,发作时VAS:4~6分,偶尔疼痛发作评分大于7分时口服非甾体药物即可有效控制疼痛。表明短时程脊髓电刺激不仅可临时还具有较长时间的止痛作用[15]。有研究显示,电刺激在对神经的不断刺激作用下,能增加雪旺细胞活性,促进其分泌神经生长因子,使神经生长因子呈梯度分布,利于神经轴突生长[16];同时电场能引起离子运动,调节细胞内外离子分布,减轻钙离子内流,稳定细胞内环境,阻断神经元凋亡,起到保护修复神经的作用[17]。
综上所述,目前对SCS镇痛机理尚未清楚,SCS并不能完全控制疼痛[18]。对SCS镇痛机制的研究多集中于脊髓节段水平上,SCS刺激脊髓后柱Aβ纤维后,可使脊髓深层(板层Ⅳ和Ⅴ)感受伤害性刺激的神经元受到抑制;同时刺激后柱顺行激活大脑(包括皮质、丘脑感觉核团和脑干),由大脑发出疼痛抑制信号激活下行疼痛抑制通路,期间在多个神经递质(5-HT、ACh、阿片肽、NE等)及受体的参与下,起到镇痛作用[19]。本病例经过SCS测试术治疗后,对头面部的疼痛缓解作用明显,因经济及社会原因,病人未行长时程电刺激植入术,这对于其远期疗效有待在今后临床工作中进一步完善和探讨。

