β-淀粉样蛋白25~35诱导星形胶质细胞增殖模型
黄秀芳 陶彦谷 张茹兰 黄启辉 (广州中医药大学,广东 广州 50080)
阿尔茨海默病(AD)是中枢退行性疾病,β-淀粉样蛋白(Aβ)聚集沉积成老年斑是AD的病理特征〔1〕,在AD患者大脑病理切片中发现明显的星形胶质细胞(AS)增生,尤其是围绕受损的神经元周围有强的AS反应。AS具有对各种损害产生强烈反应的特性,与神经元细胞相互作用,维持神经系统内环境的稳定,AS在AD的病理过程中呈现出清除Aβ的作用〔2〕,但随着病程进展,Aβ能够诱导AS增殖,产生致炎因子,导致神经元细胞损伤〔3〕,因此建立良好的AS培养模型对研究AD有重要作用。本研究探讨Aβ25~35诱导AS增殖的合适浓度,并研究AS的体外培养,为研究药物对AD的治疗作用提供细胞模型的实验依据。
1 材料与方法
1.1 实验动物 新生1 d内的SPF级SD大鼠,体重5~6 g,为南方医科大学实验动物中心提供(合格证号:scxk粤2006-0015)
1.2 主要仪器 CO2细胞培养箱(Eppendorf)公司;常温台离心机(Themo公司);超净台(阿尔泰实验室设备有限公司);流式细胞仪(R&D公司);荧光倒置显微镜(OLYMPUS公司);多功能酶标仪(Molecular Devices公司)。
1.3 主要试剂 Aβ25~35、噻唑蓝(MTT,sigma公司),DMEM培养基、胎牛血清(Hyclone公司),磷酸盐缓冲液(PBS)、0.25%胰蛋白酶-DETA(吉诺生物医药科技有限公司),兔抗神经胶质原纤维酸性蛋白(GFAP)多抗(Santa Cruz公司),FTTC标记的羊抗兔IgG(北京博奥森生物技术有限公司),青霉素-链霉素溶液(Gibco公司),聚丙烯酰胺凝胶(SDS,广州威佳科技有限公司)。Aβ25~35(1 mmol/L)储存液、MTT、三联溶解液配制5 mg Aβ25~35加入4.72 ml超纯水中,250 mg MTT加入50 ml PBS溶液中,完全溶解,另外,10 g SDS、5 ml异丁醇和 0.1 ml HCl(1 mmol/L),用双氯水定容为100 ml,用0.22 μm滤膜过滤除菌后分装,Aβ25~35、MTT-20℃保存,三联溶解液 4℃保存。
1.4 AS的体外原代培养〔4〕新生24 h的SD大鼠,冰冻低温麻醉处死,乙醇浸泡5~10 s消毒后,在超净台取出完整大脑,在解剖显微镜下剔除蛛网膜、软脑膜及血管,取出双侧大脑皮层,冲后转移至盛有DMEM的离心管中,用移液管吹打10次,振荡60 s后,先后用70 μm及20 μm孔径过滤器各过滤两遍,最终滤液加入20%胎牛血清和1% 双抗溶液,吹打混匀,计数后以1×105的密度接种于6孔培养板中,培养板置于CO2培养箱中,饱和湿度、37℃培养,次日换成10% 胎牛血清和1%双抗的DMEM培养液,继续培养5~7 d,每2~3 d换液一次,每次换液前稍加振荡,PBS溶液冲洗一遍。
1.5 细胞的传代培养 原代培养细胞长满80%~90%培养板底面时传代,传代前用PBS溶液冲洗两遍,加入少许胰蛋白酶-DETA溶液消化3 min,置于倒置显微镜下观察细胞形态变圆时,加含血清的培养液终止消化,用吸管反复吹打使细胞从培养皿底面脱落,收集细胞悬液,以4×105的密度接种于6孔培养板中,继续培养,传代细胞4~5 d融合。
1.6 流式细胞技术鉴定GFAP 取3代细胞,按上述方法制成单细胞悬液离心5 min,PBS溶液漂洗3次,制成浓度为以 1×106/ml的细胞悬液,取200 μl,加抗GFAP多抗 1 μl(鉴定组),并设同型对照,冰浴30 min,离心弃上清,PBS充分洗涤,加FTTC标记的羊抗兔IgG,避光反应15 min,重悬细胞,进行流失细胞仪检测
1.7 检测不同浓度Aβ对AS增殖的影响 取3代细胞消化重悬,以每孔4×104个细胞接种于96孔培养板中,24 h 后加入终浓度的 0、5、10、20、30、40、50、60、70、100、200 μmol/L Aβ25~35(预先老化),每组 5 孔,4 h后每孔加入20 μl的MTT(5 mg/L),4 h后加入三联溶解液100 μl终止培养,37℃培养过夜后,以空白对照组(仅加药物、MTT溶液、三联溶解液)调零,酶标仪上585 mm测各孔吸光值(OD值),分别计算各浓度的细胞增殖率。细胞增殖率(%)=各浓度OD值-空白组OD值/空白组OD值×100%)
1.8 统计学分析 采用SPSS22.0软件进行t检验、单因素方差分析、S-N-K法。
2 结果
2.1 细胞生长情况及流式细胞计数仪检测AS比例24 h后,大部分细胞均已贴壁,光晕明显;培养4~5 d后,细胞数目逐渐增多、舒展,部分细胞接触融合;随着培养时间的延长,AS的比例越来越高,7~8 d后,以AS为主的细胞可铺满整个皿底,达到90%的融合。传代后的AS 6 h即可全部贴壁,胞突逐渐舒张;4~5 d长满整个皿底,AS比例进一步增高;连续传代3次,AS的胞体外形不规则,细胞铺展明显,成放射状,细胞核多偏于胞体的一侧,一般为椭圆形,胞质丰富,密度较低。见图1。
流式细胞仪检测发现送检细胞中几乎均为GFAP阳性,GFAP表达阳性的细胞比例为(97.494±0.618)%,而同型对照组为(1.664±0.511)%,差异有统计学意义(P<0.01)。
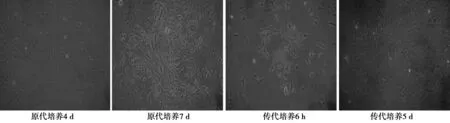
图1 原代培养AS的生长情况(脑皮质细胞,×40)
2.2 不同浓度Aβ25~35对AS增殖能力的影响 不同Aβ25~35浓度作用24 h,对AS增殖能力具有不同的影响(P<0.01),当 Aβ25~35浓度为 5~60 μmol/L时,AS的增殖率明显高于0 μmol/L组(P<0.01);当Aβ25~35 浓度为 70、100、200 μmol/L 时,增殖率低于0 μmol/L 组,且在100、200 μmol/L 浓度时差异有统计学意义(P<0.05)。其中当 Aβ25~35浓度为20 μmol/L时,AS的增殖率最高。见表1。
表1 Aβ25~35对AS增殖能力的影响 (,n=5)

表1 Aβ25~35对AS增殖能力的影响 (,n=5)
与 0 μmol/L 组比较:1)P<0.05
组别 OD值 增殖率(%)0 μmol/L 组 0.357±0.014 0.00±4.01 5 μmol/L 组 0.421±0.011 18.049±3.1301)10 μmol/L 组 0.443±0.009 24.271±2.5811)20 μmol/L 组 0.454±0.023 27.298±6.4751)30 μmol/L 组 0.451±0.015 26.401±4.3191)40 μmol/L 组 0.438±0.012 22.870±3.3081)50 μmol/L 组 0.422±0.012 18.217±3.3771)60 μmol/L 组 0.390±0.009 9.361±2.3981)70 μmol/L 组 0.356±0.016 -0.336±3.531 100 μmol/L 组 0.298±0.013 -16.536±3.5311)200 μmol/L 组 0.279±0.009 -21.917±2.5891)F/P值 103.107/0.000
3 讨论
GFAP是AS的骨架蛋白,可作为特征性标志物,作为AS的成熟标志〔5〕,本实验提示大多数细胞GFAP阳性,说明AS纯度较高,电镜下提示AS生长情况良好,这与本文采用震荡涡旋的方法使细胞混悬为单细胞悬液,避免胰酶残留影响细胞活力,其次采用不同孔径的滤网滤过细胞原液,进一步去除成纤维细胞的干扰,还采用无黏附底物环境培养,以减少神经元细胞干扰有关。
AD病理变化的实验模型一直是AD研究的难点,转基因技术为AD动物模型的制作和应用提供了广阔前景,但成本昂贵,Kerokoski等〔6〕证明低剂量的Aβ1~42作用 AS后,能够促进 AS 增殖,Frozza等〔7〕研究证实,Aβ25~35与Aβ1~42诱导神经细胞损伤的程度相似,本实验证明在 5~60 μmol/L浓度范围内Aβ25~35作用24 h,对细胞没有直接毒性,且对AS增殖具有促进作用,当Aβ25~35浓度为20 μmol/L时,AS的增殖能力最强,故可采用 Aβ25~35 20 μmol/L,24 h建立Aβ诱导AS增殖模型,为研究防治 AD病提供实验模型依据。

