玉米紫色植株色素对氟化钠诱导成骨细胞氧化损伤的保护作用
张 卓 周 波 郭连莹 王晓红 于 叶 (沈阳医学院营养与食品卫生学教研室,辽宁 沈阳 110034)
氟骨症是由于长期摄入过量的氟化物引起氟中毒并累及骨组织的一种慢性侵袭性全身性骨病,是氟中毒的典型症状。氟骨症多发于青壮年,但以老年患者发病率高、病情严重〔1〕。研究显示〔2〕,氟可通过诱导骨组织氧化失衡,进而导致骨代谢紊乱,最终引发氟骨症。其中,氟诱导的氧化应激抑制成骨细胞增殖已成为氟骨症发生发展的重要原因之一〔2,3〕。学者在体内外实验中观察到,外源性抗氧化剂在氟骨症的防治过程中起积极作用〔4,5〕。玉米紫色植株色素(MPPP)属于天然花色苷类色素,以矢车菊素-3-葡萄糖苷(45.96%) 和 3 ',4 '-二 羟 基 花 色 素-3-葡 萄 糖 苷(12.99%)含量最为丰富〔6〕。前期实验已证实,MPPP在体内外均具有较强的抗氧化活性〔7~9〕,且 MPPP可增强染氟成骨细胞的增殖能力〔10,11〕,但机制不详。本研究以MC3T3-E1成骨细胞为体外干预模型,分别观察MPPP对过氧化氢(H2O2)和氟化钠(NaF)所致成骨细胞氧化损伤的保护作用。
1 材料与方法
1.1 主要试剂与仪器 MPPP(辽宁省东亚种业有限公司);NaF(Sigma公司);H2O2(Sigma公司);改良型α-MEM培养基(赛默飞世尔生物化学制品北京有限公司);胎牛血清(FBS,天津灏洋生物制品科技有限公司);MTT试剂(Sigma公司);总抗氧化能力(T-AOC)测试盒(碧云天生物技术公司);二喹啉甲酸(BCA)蛋白浓度测定试剂盒(碧云天生物技术公司)。BB-15型CO2培养箱(美国Heraeus公司);Sonics超声波破碎仪(美国SM公司);H-7650透射电镜(日本日立公司);SPECTRA MAX PLUS 384全光谱扫描仪(美国MD公司)。
1.2 细胞培养 MC3T3-E1成骨细胞购于中科院上海生命科学研究所。复苏后,置于改良型α-MEM培养液(10%FBS)中,于37℃、5%CO2、饱和湿度条件下培养,常规换液传代。
1.3 主要溶液配制 取MPPP 0.5 g、NaF 0.042 g及H2O20.1 ml分别溶解于10 ml培养液(2%FBS),0.22 μm膜过滤除菌,浓度均为10-1mol/L。再根据前期实验结果〔10,11〕,用相同培养液等倍稀释至终浓度:MPPP 为 10-7、10-6及 10-5mol/L;NaF 为 10-3mol/L;H2O2为5×10-4mol/L。上述溶液均现用现配。
1.4 MTT法检测细胞增殖 细胞消化后,调整密度5×104个,并接种于96孔板(每孔150 μl)。48 h后,换培养液150 μl(2%FBS),同步化24 h后,吸弃培养液,并分别进行下列实验,①H2O2对MPPP预处理成骨细胞的影响:共设5组,每组8个复孔,阴性和阳性对照组均换 150 μl培养液(2%FBS),低、中、高浓度色素组均更换色素浓度为 10-7、10-6及 10-5mol/L 的培养液 150 μl(2%FBS),继续培养 24、48、72 h。于结束时间前5 h,吸弃各孔中培养液,阴性对照孔更换培养液(2%FBS),其余各孔更换含 H2O2浓度为5×10-4mol/L的培养液(2%FBS),1 h后磷酸盐酸缓冲液(PBS)清洗,向各孔中加入 MTT溶液 20 μl(5 mg/ml),4 h后吸弃空中培养液,每孔加入二甲基亚砜(DMSO)150 μl,37℃ 混匀 10 min 后,酶标仪490 nm检测OD值;②MPPP对染氟成骨细胞的影响:共设5组,每组8个复孔,分别添加下列培养液150 μl(2%FBS):阴性对照组、阳性对照组(NaF:10-3mol/L)、低浓度色素组(NaF 10-3mol/L+MPPP 10-7mol/L)、中浓度色素组(NaF 10-3mol/L+MPPP 10-6mol/L)和高浓度色素组(NaF 10-3mol/L+MPPP 10-5mol/L),继续培养24、48 h和72 h,实验结束前4 h向各孔加入MTT溶液20 μl(5 mg/ml),继续培养4 h,吸弃孔中培养液,PBS 小心清洗后,每孔加入 DMSO 150 μl,37℃混匀10 min,酶标仪490 nm处检测OD值。
1.5 T-AOC检测 细胞消化后,调整密度2×104个,接种于24孔板,每孔1 ml,继续培养72 h。吸弃孔中培养液,2%FBS培养液同步化24 h后,将细胞分为5组,每组4个复孔,分别按照1.4中①和②的操作过程添加受试物,并置于培养箱分别培养72、48 h后,细胞消化,PBS清洗,转移至1.5 ml离心管中,4℃超声破碎,低温高速离心5 min,取上清液,按试剂盒说明书进行操作,分别测定各组样品中蛋白含量和T-AOC。
1.6 透射电镜标本制备 调整细胞密度2×104个,接种于24孔板,每孔1 ml,继续培养72 h。吸弃孔中培养液,2%FBS培养液同步化24 h后,将细胞分为5组,按照1.4中②的操作过程添加受试物,并置于37℃、5%CO2、饱和湿度培养箱培养48 h后,胰酶消化,PBS清洗离心后收集细胞,2.5%戊二醛固定24 h,冲洗,1%四氧化锇固定,梯度乙醇逐级脱水,环氧树脂定向包埋后做超薄切片,经醋酸铀及柠檬酸铅双重染色后,在HITACHI H-7650透射电镜下观察并拍照。
1.7 统计学分析 采用SPSS13.0统计软件进行单因素方差分析、LSD检验。
2 结果
2.1 H2O2对MPPP预处理成骨细胞增殖的影响 阳性对照组各OD值显著低于阴性对照组(P<0.01或P<0.05);MPPP预处理24和48 h后,低、中、高浓度色素组OD值与阳性对照组比较均无明显变化(P>0.05);而MPPP预处理72 h后,低、高浓度色素组OD值显著高于阳性对照组(P<0.05)。见表1。
表1 H2O2对MPPP预处理的成骨细胞增殖的影响(,n=8)
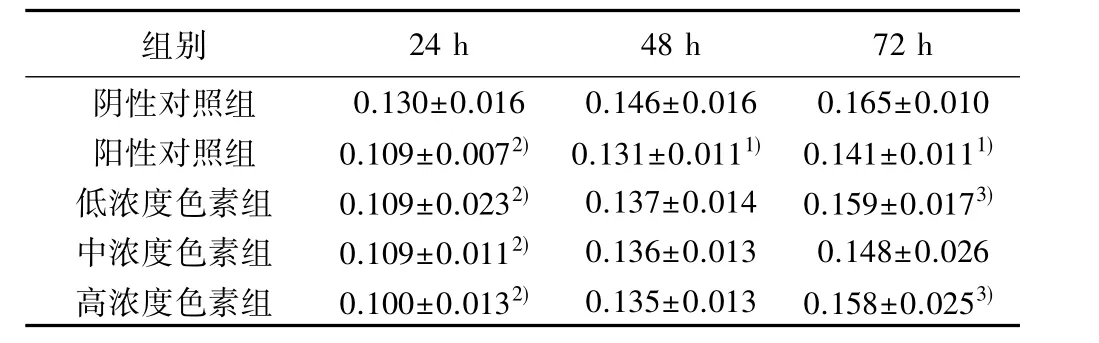
表1 H2O2对MPPP预处理的成骨细胞增殖的影响(,n=8)
与阴性对照组相同培养时间比较:1)P<0.05,2)P<0.01;与阳性对照组相同培养时间比较:3)P<0.05
组别 24 h 48 h 72 h阴性对照组 0.130±0.016 0.146±0.016 0.165±0.010阳性对照组 0.109±0.0072) 0.131±0.0111) 0.141±0.0111)低浓度色素组 0.109±0.0232) 0.137±0.014 0.159±0.0173)中浓度色素组 0.109±0.0112) 0.136±0.013 0.148±0.026高浓度色素组 0.100±0.0132) 0.135±0.013 0.158±0.0253)
2.2 MPPP对NaF处理成骨细胞增殖的影响 阳性对照组和低、中、高浓度色素组OD值均显著低于阴性对照组(P<0.01);48 h高浓度色素组显著高于阳性对照组(P<0.01),见表 2。
2.3 MPPP对H2O2和NaF处理成骨细胞T-AOC的影响 与阴性对照组(100.00%±5.84%)比较,H2O2可显著降低阳性对照组(31.21%±4.85%)和低、中、高浓度色素组(36.01%±8.16%、36.42%±15.87%、60.78%±10.70%)成骨细胞 T-AOC(P<0.01),但高浓度色素组成骨细胞T-AOC明显高于阳性对照组(P<0.01);此外,与阴性对照组(100.00%±8.69%)比较,NaF可显著降低阳性对照组(44.11%±8.69%)和低浓度色素组(49.57%±12.47%)成骨细胞T-AOC(P<0.01),但中、高浓度色素组(68.09%±9.29%、88.56%±10.45%)成骨细胞T-AOC明显高于阳性对照组(P<0.01)。
2.4 MPPP对染氟成骨细胞超微结构的影响 电镜下观察,阴性对照组的成骨细胞,细胞核形状完整、核膜界限清晰、核内染色质均匀分布,胞质内细胞器较多,可见丰富的粗面内质网、线粒体和糖原颗粒;阳性对照组的成骨细胞胞质成分减少,轻度核固缩,染色质浓缩边集,细胞内广泛线粒体明显肿胀,嵴断裂或消失,内质网扩张,部分线粒体肿胀空泡化;而色素干预条件下的成骨细胞细胞器增多,线粒体肿胀程度减弱,细胞核轮廓清晰,细胞的病理学改变减轻。见图1。
表2 MPPP对NaF处理的成骨细胞增殖的影响(,n=8)
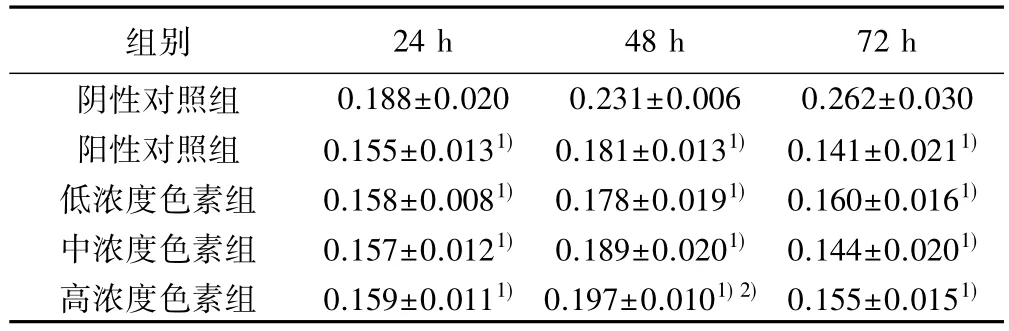
表2 MPPP对NaF处理的成骨细胞增殖的影响(,n=8)
与阴性对照组比较:1)P<0.01;与阳性对照组比较:2)P<0.01
组别 24 h 48 h 72 h阴性对照组 0.188±0.020 0.231±0.006 0.262±0.030阳性对照组 0.155±0.0131) 0.181±0.0131) 0.141±0.0211)低浓度色素组 0.158±0.0081) 0.178±0.0191) 0.160±0.0161)中浓度色素组 0.157±0.0121) 0.189±0.0201) 0.144±0.0201)高浓度色素组 0.159±0.0111)0.197±0.0101)2)0.155±0.0151)
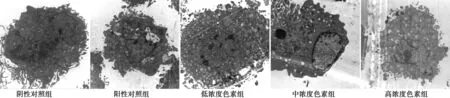
图1 MPPP对染氟成骨细胞超微结构的影响(×10 000)
3 讨论
在正常的骨代谢过程中,由成骨细胞和破骨细胞分别参与的骨形成和骨吸收始终保持着动态平衡,骨组织处于稳定状态。此平衡一旦被打破,骨形成和(或)骨吸收作用相对增强或减弱,即可发生骨量异常,引发相应的骨代谢疾病〔12〕。特别是在氟中毒状态下,成骨细胞和破骨细胞均可呈现不同程度的活跃状态〔2,3〕,打破了骨形成和骨吸收作用之间的平衡,最终导致氟骨症。研究显示,成骨细胞对氟极其敏感,在高剂量氟作用下,其活性受到明显抑制,成骨作用减弱〔13〕,骨重建失衡,表现为骨质疏松或软化型氟骨症,而且成骨细胞抑制与过量氟诱导的氧化应激密切相关〔3,4〕。体内外研究亦证实〔4,14〕,某些外源性抗氧化剂可清除氟诱导产生的自由基,同时提升组织细胞内抗氧化酶活力,进而减弱氟对组织细胞的氧化损伤。另外,细胞凋亡是在某种生理或病理条件下,细胞按照自身既定程序自主有序的死亡形式。本研究镜下观察发现,在NaF诱导下,成骨细胞呈现出核固缩、染色质浓缩边集和广泛线粒体肿胀等典型的细胞凋亡形态特征,而且在抗氧化物质MPPP的干预下,细胞凋亡程度有所减轻,与多项报道结果一致〔3,15〕。可见,高水平氟引起的氧化应激及其诱导的细胞凋亡,已成为抑制成骨细胞增殖的重要原因之一。
MPPP是从新品种玉米的紫色植株中提取,其花色苷类色素含量高达90%以上〔6〕,且具有较强的抗氧化活性〔7~9〕。与 Jin 等〔4〕研究结果相似,本实验发现,MPPP可通过增强成骨细胞内的T-AOC抑制来自H2O2和NaF的氧化损伤,同时促进细胞增殖。这主要与花色苷类物质直接和(或)间接抗氧化机制有关:一是从化学结构上分析,花色苷存在酚羟基,可直接供氢抗氧化;二是通过核因子相关因子2的参与直接作用于DNA反应元件,诱导相关的抗氧化酶高表达〔16〕。此外,随着年龄的增大,机体代谢能力减弱,组织细胞自由基不断积累〔17〕,这就加重了氟骨症的发生发展。因此推测,针对年长者,适量摄入抗氧化食品,在延缓衰老和缓解氟中毒症状方面将发挥积极作用。
总之,MPPP可通过提升成骨细胞T-AOC抑制NaF诱导的氧化损伤,提示富含花色苷的MPPP在氟骨症的防治领域具有一定的应用价值。

