MdWRKY40介导提高苹果与拟南芥对轮纹病菌的免疫抗性
周茜茜,邱化荣,何晓文,王宪璞,刘秀霞,李保华,吴树敬,陈学森
介导提高苹果与拟南芥对轮纹病菌的免疫抗性
周茜茜1,邱化荣1,何晓文1,王宪璞1,刘秀霞1,李保华2,吴树敬1,陈学森1
(1山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018;2青岛农业大学植物医学学院,山东青岛 266109)
【目的】从‘富士’苹果中克隆,研究其在水杨酸(SA)诱导条件下的表达模式及在苹果轮纹病抗病信号通路中的作用,为进一步揭示苹果的抗病机制提供理论依据。【方法】以‘富士’苹果为试材,克隆的全长CDS序列,对其进行生物信息学分析,采用荧光定量PCR(qRT-PCR)分析其在苹果各组织中的表达水平,及对非生物胁迫SA的响应;研究外源SA处理对苹果叶片接种轮纹病菌()的影响,并利用qRT-PCR检测病程相关蛋白基因的表达;将在拟南芥中进行异源表达,对稳定表达的拟南芥幼苗叶片进行接菌处理,观察叶片发病程度及发病叶片数量,并采用qRT-PCR分析病程相关基因的表达;测量拟南芥幼苗的根系长度,并利用qRT-PCR检测生长素相关基因的表达。【结果】包含长为858 bp完整的开放阅读框,编码286个氨基酸,预测其分子量为32.088 kD,等电点为8.15。系统进化树分析表明,MdWRKY40与白梨PbWRKY40序列相似性最高,亲缘关系最近,与拟南芥AtWRKY40在不同的分支上,亲缘关系较远,利用DANMAN软件进行MdWRKY40与AtWRKY40的多序列比对分析发现,MdWRKY40蛋白与AtWRKY40蛋白虽然都含有一个WRKYGQK保守结构域,但相似度仅为29.78%。qRT-PCR分析表明,在根中的表达水平最高,在叶中的表达水平最低,并且在根、茎、叶中,SA均诱导了的表达,且均呈现先升高后降低的趋势,在6 h时表达量最高;外源SA处理提高了苹果叶片对轮纹病菌的抗性,未处理的叶片发病率达92.59%,SA处理后发病率降至79.26%,并显著提高了病程相关蛋白基因、的表达量。与野生型相比,在拟南芥中异源过量表达显著提高了拟南芥叶片对轮纹病菌的抗性,野生型拟南芥发病率达77.5%,而两个转基因拟南芥株系发病率仅为21.5%和17.4%,并显著提高了病程相关基因、、的表达。过表达的拟南芥植株根系生长受到抑制,培养7 d后转基因拟南芥主根长度分别是野生型拟南芥的39.9%和43.1%,培养10 d后主根长度分别是野生型拟南芥的58.5%和55.4%。基因表达结果显示,生长素合成相关基因和生长素运输相关基因、的表达水平在过表达株系中显著低于野生型。【结论】表达受SA和苹果轮纹病菌侵染诱导;是苹果中重要的轮纹病抗病基因,该基因过表达显著提高对轮纹病菌的抗性;具有调控植物根系生长发育的功能,可能通过下调生长素运输相关基因的表达影响植物根系生长发育。
苹果;;水杨酸;苹果轮纹病菌;免疫抗性;根系生长
0 引言
【研究意义】苹果味道鲜美,营养丰富,是世界范围内深受消费者喜爱的水果之一,但苹果的产量及其品质极易受生物和非生物胁迫的危害[1],苹果轮纹病菌(葡萄座腔菌,)是兼性菌,既可以营腐生又可以营活体[2],轮纹病是苹果生产中最重要的病害之一,可危害苹果的枝干和果实,在田间和贮藏期均可使苹果发病[3]。目前生产上主栽品种‘富士’,以及‘元帅’‘嘎啦’等均为轮纹病易感品种,给苹果生产造成巨大的经济损失。近年来,果实套袋技术和化学药剂防治是苹果轮纹病主要的防治措施,但果实套袋无法解决枝干轮纹病危害,化学药剂的使用又会对环境造成影响。进行具有抑菌功能的有效药剂与生防菌筛选,是目前研究者试图解决苹果果实及枝干轮纹病的重要尝试[4-5]。但迄今为止,一直没有低毒环保并能够有效防治苹果枝干及果实轮纹病的有效药剂。因此,抗病品种培育是解决轮纹病对苹果产业造成巨大危害的另一重要尝试。而对于苹果抗病信号转导途径进行研究,揭示和鉴定苹果抗病基因,是利用抗病基因资源进行苹果抗病品种培育和种质资源选育的前提条件。【前人研究进展】WRKY转录因子作为植物中最大的转录因子家族之一,其中一个主要功能是与植物的抗病和生长发育有关,在植物的抗病反应调控网络中起着关键作用[6-7]。WRKY转录因子可以调控抗病信号通路中的关键基因,如在拟南芥中,通过与启动子中的W-box结合来调控下游基因的表达,进而调控植物的抗病性[8]。WRKY转录因子还可以通过与蛋白的直接结合来调控植物的抗病性,如大麦中和编码的蛋白则通过与MLA(mildew- resistance locus A)互作来调控大麦对白粉病的抗性[9]。近年来,越来越多的研究发现,WRKY转录因子参与植物的各种生理过程,包括生长和发育[10-11]、非生物胁迫响应[12-14]和生物胁迫响应[15-19]。WRKY转录因子通过结合靶基因启动子中的顺式作用元件W-box(TTGACC/T)来调控基因表达[20]。除了W-box外,WRKY转录因子还可以结合其他元件,如糖响应(SURE)顺式作用元件(TAAAGATTACTAATAGG AA)和病原体响应元件PRE4(TGCGCTT),表明其功能机制的多样性[21]。进一步的研究显示,WRKY转录因子的主要生物学功能是调控植物的抗病反应及参与信号转导途径的建立。在本氏烟中,沉默降低了本氏烟对半活体营养型寄生疫霉Pp025菌株和死体营养型灰霉病菌的抗性[22],Xu等研究表明和双突变体和三重突变体提高了拟南芥对丁香假单胞菌DC3000的抗性,但降低了拟南芥对灰霉病菌的抗性[23],双突变体也提高了拟南芥对白粉病菌的抗性[24]。除了参与生物胁迫外,WRKY转录因子还广泛参与了非生物胁迫,在拟南芥中,受E-2-己烯醛诱导[14],罗昌国等[25]研究发现,水杨酸(SA)可以强烈诱导的表达。WRKY转录因子在植物的根系生长发育中也发挥着重要作用,如在水稻中,过表达显著降低了植株的株高并增加了根的长度[26]。【本研究切入点】在苹果轮纹病抗病信号通路中的具体功能和作用机制尚未见报道。【拟解决的关键问题】通过鉴定的生物学功能,阐明其在抵御苹果轮纹病菌侵染中的作用,为进一步揭示苹果的抗病机制以及培育抗病新品种提供理论依据。
1 材料与方法
试验于2016—2017年在山东农业大学作物生物学国家重点实验室进行。
1.1 材料
分别以山东农业大学植物生长室生根28 d的‘嘎啦’苹果组培苗的根、茎、叶,山东农业大学南校区果树实验站培育的‘富士’苹果果实和在22℃,相对湿度60%,10 h/14 h光暗周期条件下培养的哥伦比亚野生型拟南芥幼苗为试材。苹果轮纹病菌所使用株系为No.040301[27]。
1.2 RNA提取及cDNA制备
总RNA的提取按照康为世纪生物科技有限公司的OminiPlant RNA Kit(DNaseI)提取试剂盒说明书进行,从‘富士’苹果果皮中提取总RNA,应用RevertAid First Strand cDNA Synthesis Kit(Thermo Scientific)反转录试剂盒并参照其说明书反转录为cDNA,-20℃保存备用。
1.3 荧光定量PCR(qRT-PCR)
荧光定量仪器为伯乐CFX96分析仪,总反应体系为5 µL FastStart Universal SYBR Green Master(Roche),上下游引物各0.3 µL(10 µmol·L-1),模板1 µL,ddH2O补足至10 µL。反应程序:95℃预变性10 min,95℃变性15 s,60℃退火30 s,72℃延伸30 s,40个循环。内参基因为苹果肌动蛋白基因(序列号为GQ339778),基因相对表达量通过2-△△CT法计算,每个PCR反应3次重复。使用SPSS17.0软件进行基因表达差异的显著性分析(<0.05)。所使用qRT-PCR引物如表1所示。
1.4 MdWRKY40超表达载体构建
根据在GDR网站(https://www.rosaceae.org/)中检索到的序列设计引物:MDP0000263349()-HI-F:5′- CGGGATCCATGGATGC TCGTACGCCTAAC-3′;MDP0000263349()-I-R:5′-GAAGGCCTATTTGGCCTGTCTGCAGGT C-3′。以‘富士’苹果果皮cDNA为模板,进行PCR扩增。反应程序:98℃预变性3 min;98℃变性30 s,56℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。应用HI、I酶切PCR产物和pCB302二元表达载体,PCR产物与表达载体骨架用1.5%琼脂糖凝胶电泳分别回收,然后将回收的PCR产物与载体利用T4 DNA连接酶在16℃条件下连接8 h以上,转化大肠杆菌,进行克隆的筛选鉴定并测序。所用限制性内切酶和T4 DNA连接酶均购自NEW ENGLAND Biolabs公司。
1.5 MdWRKY40的生物信息学分析
通过Expasy网站(http://web. expasy.org/protparam/)对MdWRKY40蛋白进行理化性质分析,利用DANMAN软件进行多序列比对分析,采用MEGA5.0软件neighbor-joining(NJ)法构建系统进化树,建树参数No. Of Bootstrap Replications为1 000,其他参数默认。

表1 荧光定量PCR引物序列
1.6 农杆菌介导的拟南芥的遗传转化
将构建的过表达载体转化农杆菌GV3101,PCR筛选获得阳性农杆菌,然后采用农杆菌介导的浸花法进行拟南芥的遗传转化[28]。
1.7 外源SA处理对苹果叶片接种轮纹病菌的影响
选取生长30 d,生长状态一致的离体‘嘎啦’叶片,将其浸泡在0.5 mmol·L-1的SA中6 h,然后使用在28℃暗培养7 d后的苹果轮纹病菌进行接种。将接菌后的叶片放在黑暗、28℃恒温培养箱内发病3 d,之后观察记录叶片发病情况,并分别提取发病叶片的RNA,进行病程相关蛋白基因的定量表达,重复3次。叶片的轮纹病菌接种方法参照文献[29]。
1.8 拟南芥根系生长测定
将转基因拟南芥经过喷施除草剂(5 mg·L-1)筛选以后,PCR检测得到阳性转基因植株,收集种子,将阳性转基因植株播种到MS+除草剂(8 mg·L-1)的抗性培养基上,经过连续3代筛选获得T3代纯合体,收取种子。
将野生型拟南芥和转基因株系的种子播种到MS培养基上,竖直培养7 d,10 d后测量幼苗的根长,野生型拟南芥和转基因株系各取30株计算其平均值,3次重复。整株取样,用液氮冻存,进行生长素合成和运输相关基因的定量表达。
1.9 拟南芥叶片的轮纹病菌接种
选取生长30 d,生长状态相同的转基因和非转基因拟南芥叶片,使用在28℃暗培养5 d后的苹果轮纹病菌进行接种。将接菌后的叶片放在黑暗、24℃恒温培养箱内发病3 d,之后观察记录叶片发病情况,并分别提取接种2 d后转基因和非转基因拟南芥发病叶片的RNA,进行病程相关蛋白基因的定量表达,重复3次。
2 结果
2.1 MdWRKY40的克隆与生物信息学分析
以‘富士’果皮的cDNA为模板,经PCR扩增获得了一条大小约为900 bp的条带(图1-A),测序分析表明该基因包含一个长为858 bp完整的开放阅读框,编码286个氨基酸。将回收的条带连接到pCB302二元表达载体,挑取阳性克隆应用HI、I进行酶切验证,切出一条长为858 bp的条带,与预期完全一致(图1-B),因此,开放阅读框序列已成功克隆到表达载体pCB302-35S-2HA中。
Expasy预测其分子量为32.088 kD,等电点为8.15,用DANMAN软件进行多序列比对分析发现,MdWRKY40蛋白与拟南芥AtWRKY40蛋白相似度为29.78%,都含有一个WRKYGQK保守结构域(图1-C)。
2.2 MdWRKY40系统进化树分析
从苹果基因组数据库中下载的基因序列,从拟南芥基因组数据库(http://www.arabidopsis. org/index.jsp)中下载的基因序列,在NCBI(https://www.ncbi.nlm.nih.gov/)上用MdWRKY40蛋白序列进行Blast分析,得到白梨、桃、枣等20个不同物种的WRKY40同源蛋白序列,利用MEGA5.0 软件将以上22个蛋白序列构建系统进化树,发现苹果MdWRKY40与白梨PbWRKY40在同一个分支上,亲缘关系最近(图2)。
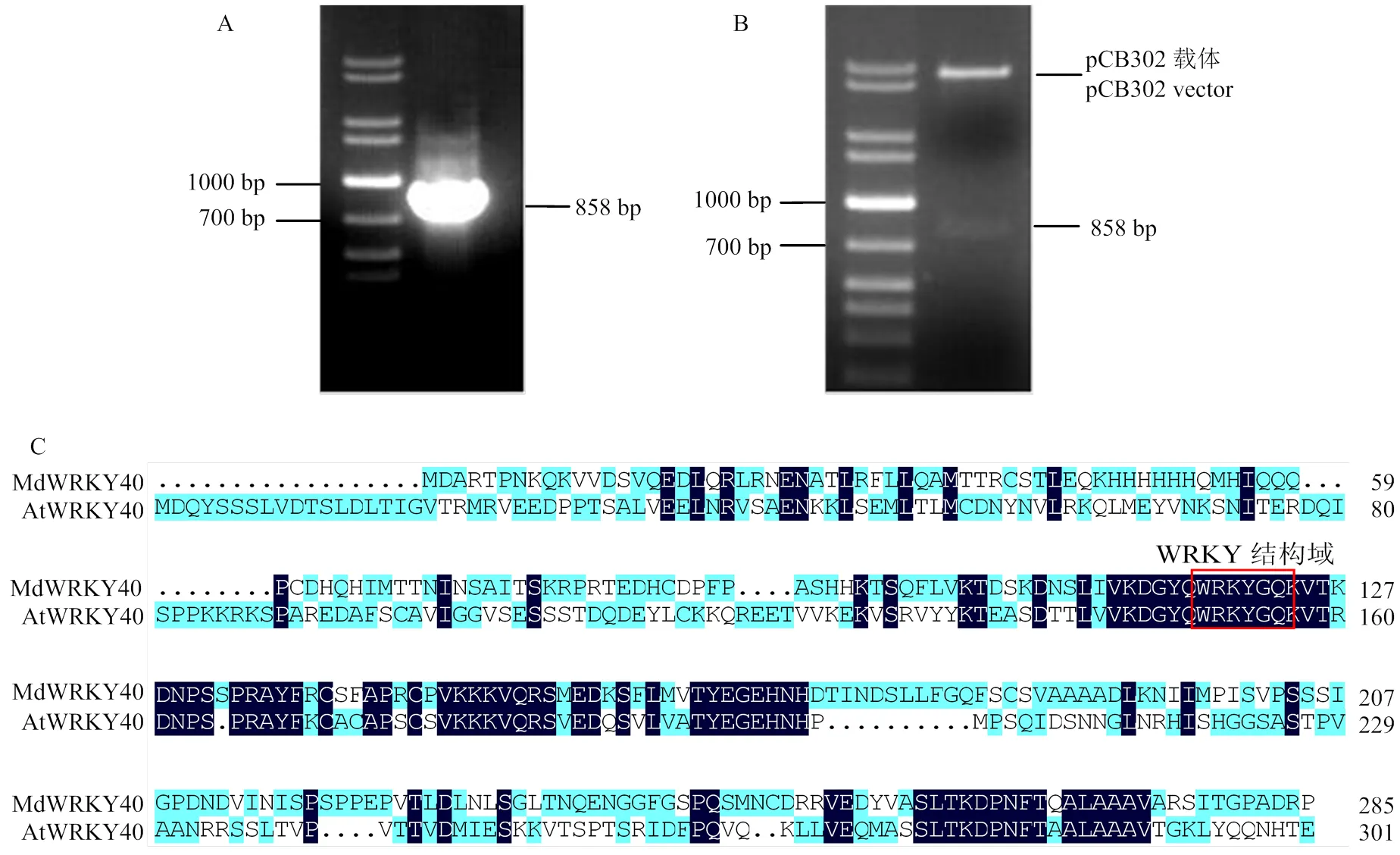
A:MdWRKY40编码区全长的PCR扩增PCR amplification of the full length of MdWRKY40;B:pCB302-35S-MdWRKY40-2HA表达载体酶切验证Digestion result of pCB302-35S-MdWRKY40-2HA expression vector;C:MdWRKY40与AtWRKY40蛋白序列比对MdWRKY40 and AtWRKY40 protein sequence alignment
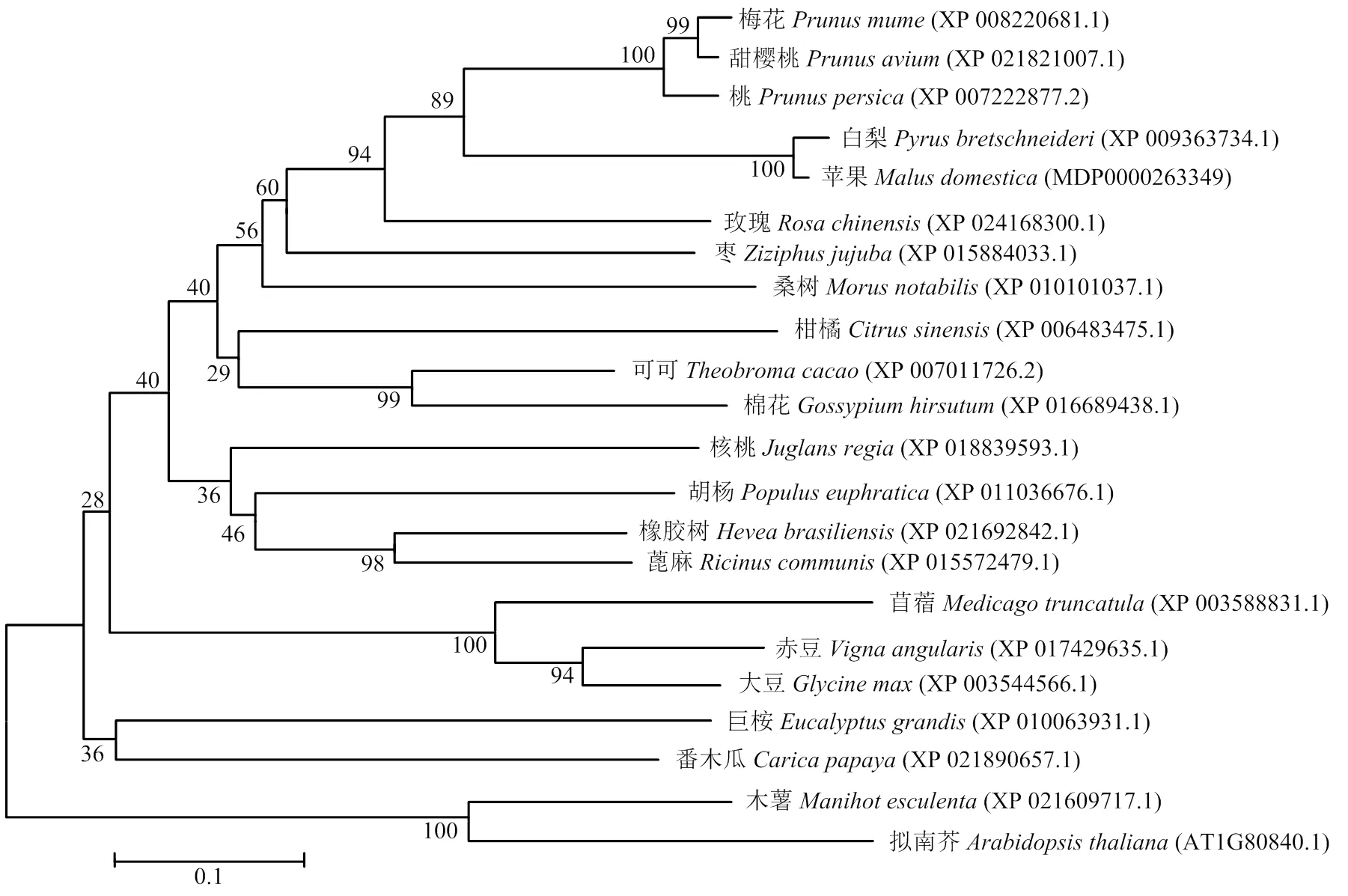
图2 MdWRKY40与其他物种WRKY40系统进化树分析
2.3 MdWRKY40的组织表达分析及对生物和非生物胁迫的响应
qRT-PCR分析表明,在根中的表达水平最高,在叶中的表达水平最低(图3-A)。‘嘎啦’苹果叶片接种苹果轮纹病菌3 d后,提取发病叶片的RNA做qRT-PCR后发现,与对照相比,的表达量显著升高,表明苹果轮纹病菌可诱导的表达(图3-B)。用0.5 mmol·L-1的SA喷施生根四周的‘嘎啦’组培苗,植株无明显变化,在0、3、6、12、24、36、48 h时取样,荧光定量结果显示,在根、茎、叶中,SA强烈诱导了的表达,且均呈现先升高后降低的趋势,在6 h时表达量最高(图3-C)。
2.4 SA处理对苹果叶片轮纹病抗性的影响
用0.5 mmol·L-1的SA处理生长30 d的‘嘎啦’叶片6 h后接种苹果轮纹病菌,3 d后发现,与对照相比,用SA处理的‘嘎啦’叶片发病程度轻,未处理的叶片有48.15%基本全部发黄腐烂,处理后的叶片只有22.96%基本全部发黄腐烂,大部分叶片只有轻微黄化腐烂现象,且处理后发病叶片少,未处理的叶片发病率达到了92.59%,用SA处理后发病率降至79.26%(图4-A、4-B)。荧光定量结果显示,用SA处理后,与病程相关蛋白基因、的表达量显著高于对照(图4-C),表明SA处理可以提高苹果叶片对轮纹病菌的抗性,并且可能参与了SA抗病信号途径。

柱上不同小写字母表示差异显著(<0.05);**表示差异极显著(<0.01)。下同Different lowercase letters on the column indicate significant differences (<0.05); ** indicates extremely significant difference (<0.01). the same as below
A:的组织表达分析Expression analysis of;B:轮纹病菌处理‘嘎啦’叶片对表达的影响Effect ofinfection on the expression of;C:SA处理‘嘎啦’组培苗对表达的影响Effect of SA on the expression of
图3的组织表达分析及对水杨酸、轮纹病菌侵染诱导后的表达
Fig. 3 Expression analysis ofdifferent tissues of apple and expression after induced by salicylic acid andinfection
2.5 异源表达MdWRKY40对拟南芥叶片轮纹病抗性的影响
2.5.1 转基因拟南芥的鉴定 将构建的过表达载体转化农杆菌GV3101,然后用浸花法侵染拟南芥,利用35S启动子引物35SProsequencing:5′-CCTCTCACCTTTTCGCTGTAC-3′和克隆引物MDP0000263349()-I-R:5′-GAAGGCCT ATTTGGCCTGTCTGCAGGTC-3′进行PCR鉴定获得阳性转基因植株(图5-A),然后利用半定量和定量PCR进一步验证阳性转基因植株,半定量结果表明在转基因株系7#、12#中的表达量显著高于野生型拟南芥(图5-B),qRT-PCR结果显示,转基因拟南芥中的表达量分别为野生型拟南芥的585倍和545倍,与半定量结果一致,证明已转入拟南芥中,并成功表达(图5-C)。
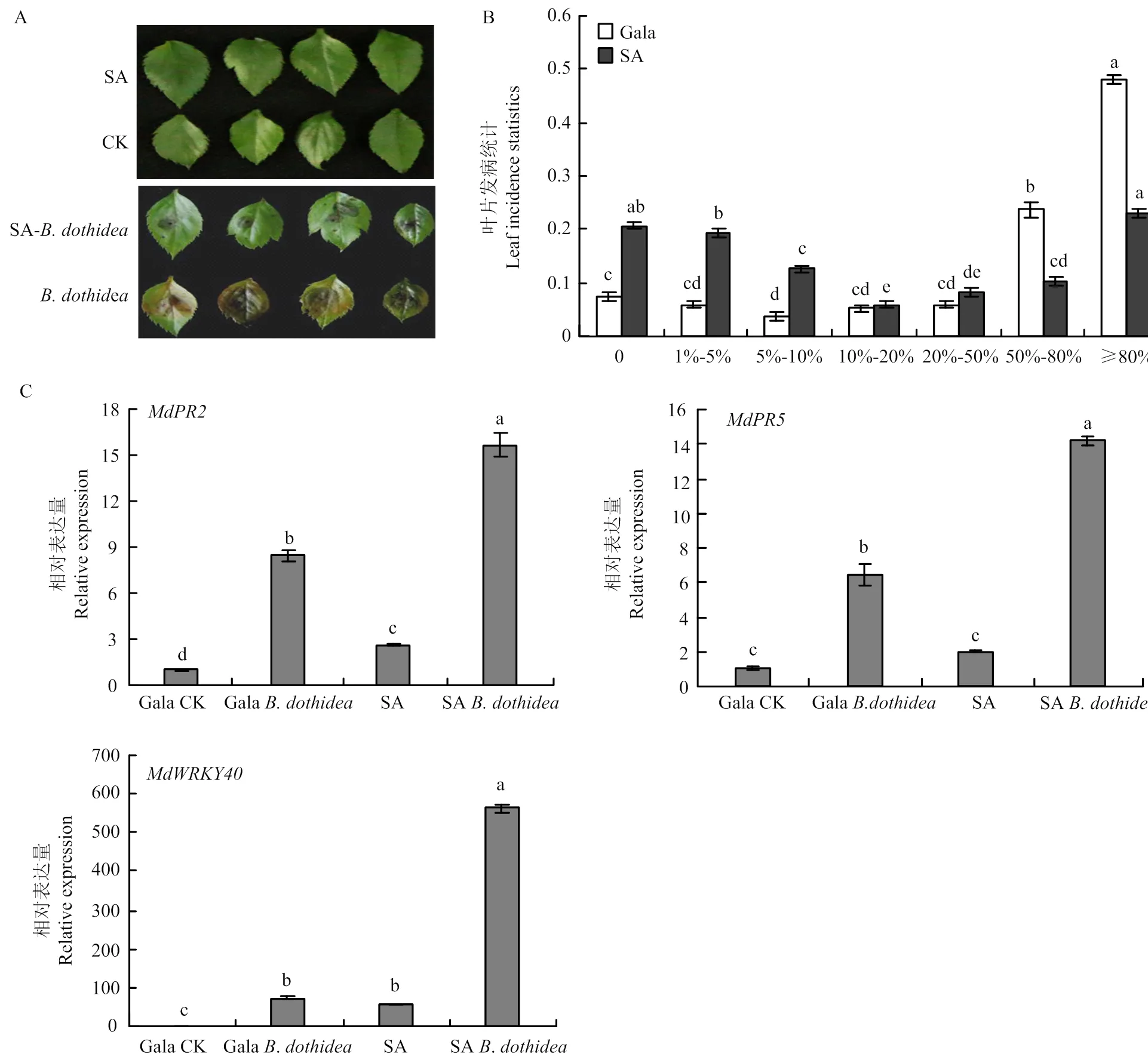
A:SA处理苹果叶片接种轮纹病菌表型,SA代表仅用SA处理后的叶片,CK代表未做任何处理的叶片,SA-B. dothidea代表用SA处理后接种轮纹病菌的叶片,B. dothidea代表仅接种轮纹病菌的叶片SA treatment of apple leaves inoculated with B. dothidea phenotype, SA represents the leaves treated only with SA, CK represents the leaves without any treatment, SA-B. dothidea represents the leaves of inoculated with B. dothidea after treatment with SA, and B. dothidea represents the leaves of inoculated only with B. dothidea;B:SA处理苹果叶片接种轮纹病菌发病叶片统计,纵轴表示发病叶片占总叶片的比例,横轴表示病斑面积占叶片总面积的百分比SA treatment of apple leaves inoculated with B. dothidea leaf incidence statistics, the vertical axis indicates the proportion of diseased leaves to total leaves, and the horizontal axis indicates the percentage of lesion area to the total area of the leaves;C:qRT-PCR分析MdWRKY40和病程相关基因的表达水平qRT-PCR analysis of MdWRKY40 and disease-associated gene expression levels
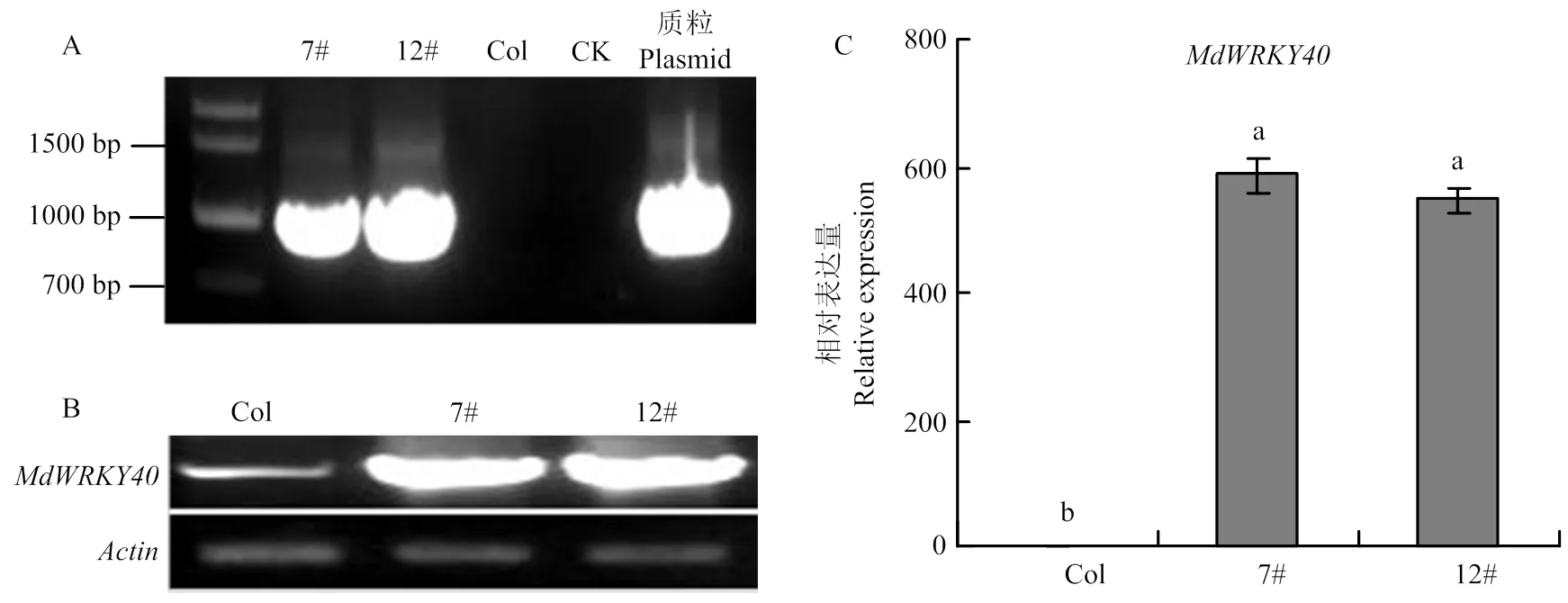
A:PCR鉴定转基因拟南芥,7#、12#是两个转基因株系,Col代表野生型拟南芥,CK代表未加模板,质粒代表pCB302-35S-MdWRKY40-2HA Identification of transgenic A. thaliana by PCR, 7# and 12# are two transgenic lines, Col represents wild type A. thaliana,CK represents no template, and plasmid represents pCB302-35S-MdWRKY40-2HA;B:RT-PCR分析野生型拟南芥和异源表达株系中MdWRKY40的表达量RT-PCR analysis of MdWRKY40 expression in wild type A. thaliana and heterologous expression lines;C:qRT-PCR分析野生型拟南芥和异源表达株系中MdWRKY40的表达量qRT-PCR analysis of MdWRKY40 expression in wild type A. thaliana and heterologous expression lines
2.5.2 超表达拟南芥叶片接种苹果轮纹病菌表型 选取生长状态相同的转基因和非转基因拟南芥叶片,进行苹果轮纹病菌接种,发病3 d后发现转基因拟南芥的发病程度明显比野生型拟南芥轻,野生型拟南芥发病叶片全部发黄腐烂,转基因拟南芥叶片只有轻微黄化现象,并未出现腐烂状况(图6-A),且转基因拟南芥比野生型拟南芥发病叶片少,野生型拟南芥发病率达到了77.5%,而转基因拟南芥发病率 只有21.5%和17.4%(图6-B)。
2.5.3 超表达对接菌后拟南芥叶片中PR基因表达水平的影响 为了进一步研究在苹果轮纹病抗病信号通路中的作用,通过qRT-PCR方法检测发病叶片中病程相关蛋白基因的表达水平,结果显示转基因拟南芥中病程相关蛋白基因、、的表达量显著高于野生型拟南芥(图7)。
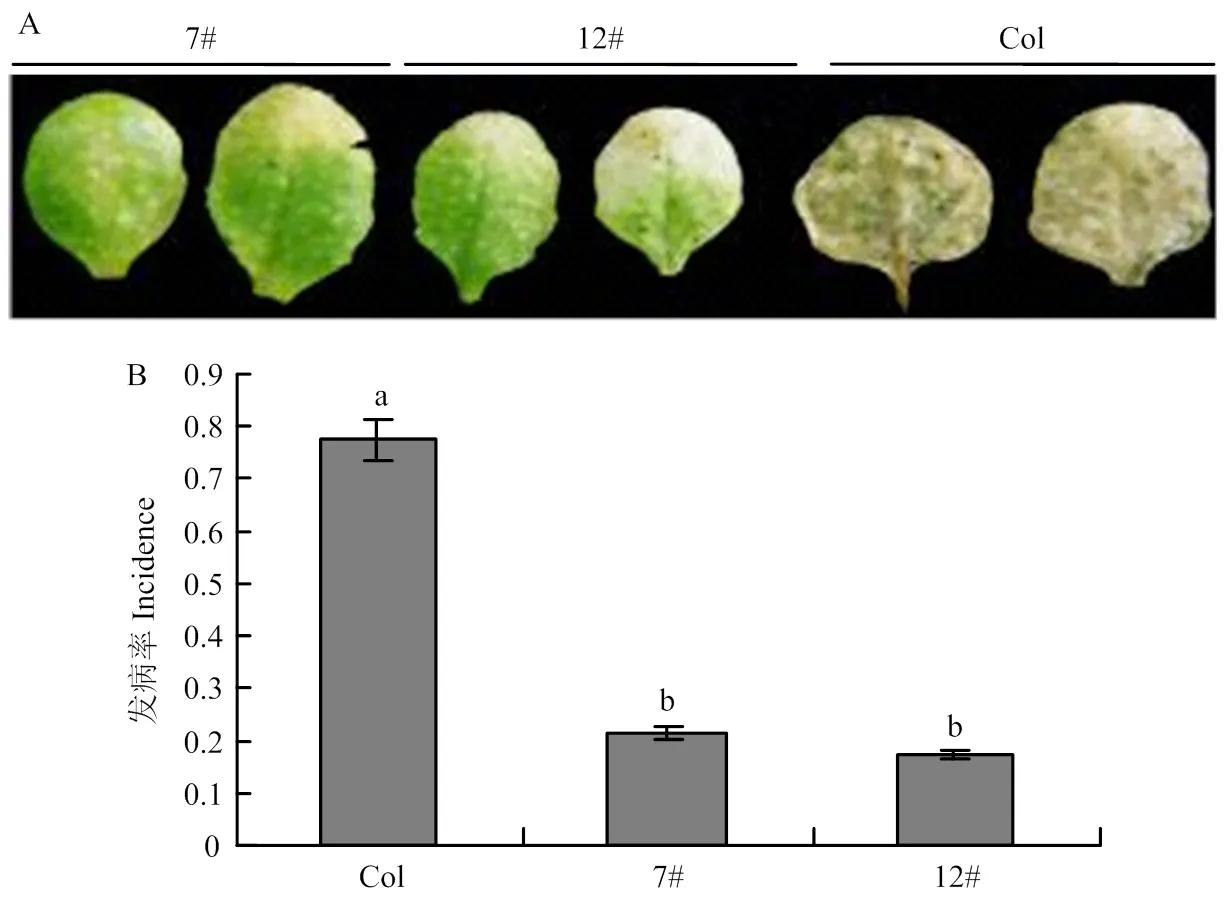
A:野生型拟南芥及转基因株系叶片接种轮纹病菌表型Phenotype of wild type and transgenic A. thaliana leaves after inoculation with B. dothidea;B:野生型和转基因拟南芥叶片接种轮纹病菌发病统计Incidence statistics of wild type and transgenic A. thaliana leaves after inoculation with B. dothidea

图7 转基因拟南芥叶片中病程相关基因的表达水平
Fig. 7 Expression of disease-associated genes in transgenic
2.6 超表达MdWRKY40对拟南芥根系的影响
2.6.1 对拟南芥主根的影响 将野生型拟南芥和两个转基因株系的种子播种到MS培养基上,培养7、10 d后测量幼苗的根长,发现与野生型拟南芥相比,转基因拟南芥的根系生长明显受到抑制(图8-A),培养7 d后主根长度分别是野生型拟南芥的39.9%和43.1%,培养10 d后主根长度分别是野生型拟南芥的58.5%和55.4%(图8-B)。
2.6.2 对拟南芥生长素相关基因表达的影响 为了进一步研究调控拟南芥根系生长发育的机理,通过qRT-PCR检测转基因株系中生长素相关基因的表达情况,结果显示生长素合成相关基因和生长素运输相关基因的表达量显著低于野生型拟南芥(图9)。
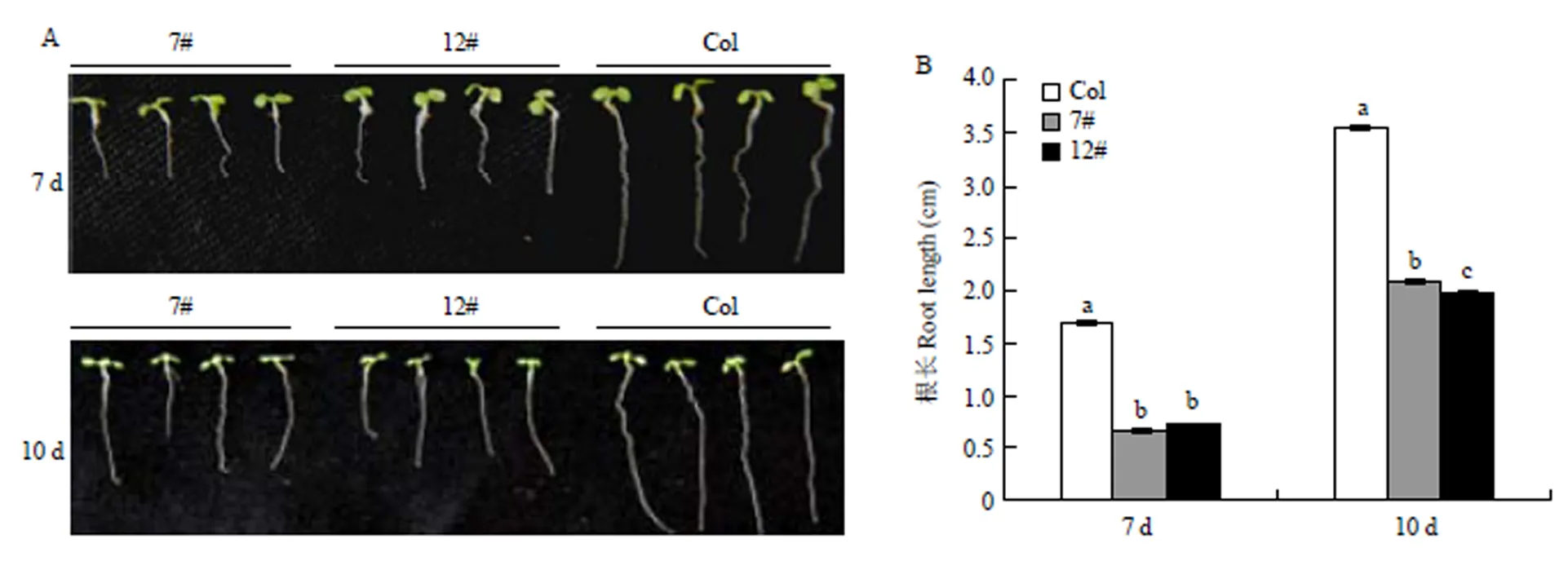
A:转基因拟南芥和野生型拟南芥根系生长状况,7 d中标尺为0.5 cm,10 d中标尺为1.2 cm The root growth status of transgenic and wild type A. thaliana, Scale bar is 0.5 cm in 7 d and 1.2 cm in 10 d;B:转基因拟南芥和野生型拟南芥根长统计Statistical analysis of root length of transgenic and wild type A. thaliana
3 讨论
3.1 超表达MdWRKY40提高拟南芥叶片对苹果轮纹病的抗性
为了适应外界环境,植物进化出多种防御机制 来抵抗病原菌侵染。研究表明,WRKY转录因子广泛参与植物的生物和非生物胁迫响应,在抗病信号通路中发挥至关重要的作用。不同植物中WRKY转录因子数量不同,而WRKY转录因子在各种抗病信号通路中所起的作用也不尽相同,在辣椒中,与促进了植物对青枯病菌的抗性[30],但抑制了植物对青枯病菌的抗性[31]。在拟南芥中,作为腐生性真菌黑斑病菌和灰霉病菌的正向调节因子起作用[32],而在富士苹果中,可能作为白粉病菌的负调节因子起作用[25]。由此可见,WRKY转录因子在响应生物胁迫过程中的作用复杂,而且值得注意的是,植物激素如脱落酸(ABA)、水杨酸(SA)、茉莉酸(JA)和乙烯(ETH),在调节植物生长发育和防御各种生物和非生物胁迫中发挥着关键作用[33-35],如外源SA处理可增强苹果果实对灰霉病的抗性[33]。已有研究证实WRKY转录因子的调控作用与多种植物激素介导的信号途径密切相关,如在拟南芥中,和SA信号传导途径,作为负调节因子调控JA信号传导途径[36]。其在拟南芥、烟草和水稻等模式植物中已有较深入研究,但在苹果等多年生木本植物中的研究较少。近年来,主栽苹果品种,尤其是‘富士’,轮纹病的发生呈逐年上升的趋势,本研究中SA和苹果轮纹病菌都强烈诱导了的表达,并且SA可快速诱导的表达,呈现先升高后降低的趋势,此结果与邱化荣等[37]的研究结果一致,这可能与WRKY转录因子的反馈调节机制有关,如在拟南芥中,可抑制其自身启动子的活性[38]。本研究还发现在拟南芥中异源表达后显著提高了拟南芥叶片对苹果轮纹病菌的抗性以及病程相关蛋白基因PR的表达量,外源SA处理苹果叶片后也提高了其对轮纹病菌的抗性及病程相关蛋白基因PR的表达量,这表明可能在SA介导的抗病信号通路中具有至关重要的作用,苹果基因编码区保守性较高,不同品种之间差别较小,而根据能够被抗性激素SA强烈诱导表达,并且该基因在拟南芥叶片中过表达能够显著提高对轮纹病菌侵染抗性的这一研究结果,该基因有望成为在苹果育种中进行抗病品系筛选的重要标志性基因,及进行苹果抗病品种培育的重要候选基因。而阐明在‘嘎啦’的抗病信号通路中的具体作用,有利于进一步揭示苹果的抗病机制。在SA介导的抗病信号通路中的具体作用机制有待进一步研究。

图9 转基因拟南芥和野生型拟南芥生长素相关基因的表达水平
Fig. 9 Expression of auxin-related genes in transgenic and wild type
3.2 超表达MdWRKY40抑制拟南芥根系生长
WRKY转录因子不仅在抗病过程中具有重要作用,许多研究已经明确WRKY转录因子在种子萌发[39]、侧根形成[40]、开花时间[41]、果实成熟[42]、叶片衰老[38]和代谢过程等各种生理过程中也具有重要作用。例如,沉默大豆中的和严重的发育不良和植株矮小[43],在水稻中,过表达可减少侧根的形成和延伸,并可能改变了生长素的应答和转运[40],在拟南芥中,沉默后,侧根的长度和数量以及根毛的数量都显著增加[44]。本研究中,在拟南芥中异源表达后明显抑制了拟南芥主根的伸长和生长素合成相关基因以及生长素运输相关基因的表达,说明很可能是通过调控生长素相关基因的表达来抑制拟南芥主根的伸长,与Zhang等[40]在水稻中的研究结果相似。
本研究中,MdWRKY40与白梨PbWRKY40亲缘关系最近,与拟南芥AtWRKY40蛋白相似度为29.78%。在拟南芥中,作为苹果轮纹病抗性的正向调节因子起作用,并抑制拟南芥的根系发育,但苹果与拟南芥还有较大差别,在苹果中的功能是否与拟南芥一致?其在苹果中的具体作用机制还有待进一步研究。
4 结论
表达受水杨酸(SA)和苹果轮纹病菌侵染所诱导;是苹果中重要的轮纹病抗病基因,该基因过表达显著提高对轮纹病菌的抗性;具有调控植物根系生长发育的功能,可能通过下调生长素运输相关基因的表达影响植物根系生长发育。
[1] 国立耘, 李金云, 李保华, 张新忠, 周增强, 李广旭, 王英姿, 李晓 军, 黄丽丽, 孙广宇, 文耀东. 中国苹果枝干轮纹病发生和防治情况. 植物保护, 2009, 35(4): 120-123.
Guo L Y, Li J Y, Li B H, Zhang X Z, Zhou Z Q, Li G X, Wang Y Z, Li X J, Huang L L, Sun G Y, Wen Y D. Investigations on the occurrence and chemical control ofcanker of apple in China., 2009, 35(4): 120-123. (in Chinese)
[2] 张芮. 苹果基因在轮纹病抗性形成中的作用机制研究[D]. 泰安: 山东农业大学, 2015.
Zhang R. The research on the mechanism ofmediated disease resistance against the apple ring rot pathogenic fungi[D]. Taian: Shandong Agricultural University, 2015. (in Chinese)
[3] Tang W, Ding Z, Zhou Z Q, Wang Y Z, Guo L Y. Phylogenetic and pathogenic analyses show that the causal agent of apple ring rot in China is., 2012, 96(4): 486-496.
[4] Li H Y, Cao R B, Mu Y T.inhibition ofand, and chemical control of gummosis disease of Japanese apricot and peach trees in Zhejiang Province, China., 1995, 14(3): 187-191.
[5] Li Y, Han L R, Zhang Y, Fu X, Chen X, Zhang L, Mei R, Wang Q. Biological control of apple ring rot on fruit by9001., 2013, 29(2): 168-173.
[6] Eulgem T, Somssich I E. Networks of WRKY transcription factors in defense signaling., 2007, 10(4): 366-371.
[7] 薛华, 张红岩, 李小艳, 赵云, 王茂林. 油菜矮秆突变WRKY转录因子cDNA克隆及表达分析. 西北植物学报, 2008, 28(3): 452-458.
Xue H, Zhang H Y, Li X Y, Zhao Y, Wang M L. cDNA cloning and expression analysis of a dwarfism related WRKY transcription factor inL., 2008, 28(3): 452-458. (in Chinese)
[8] Yu D, Chen C, Chen Z. Evidence for an important role of WRKY DNA binding proteins in the regulation ofgene expression., 2001, 13(7): 1527-1540.
[9] Shen Q H, Saijo Y, Mauch S, Biskup C, Bieri S, Keller B, Seki H, ÜlkerB, Somssich I E, Schulze-Lefert P. Nuclear activity of MLA immune receptors links isolate-specific and basal disease-resistance responses., 2007, 315(5815): 1098-1103.
[10] Han M, Kim C Y, Lee J, Lee S K, Jeon J S.repressesand induces reactive oxygen species and leaf senescence in rice., 2014, 37(7): 532-539.
[11] Dai X, Wang Y, Zhang W H., a WRKY transcription factor, modulates tolerance to phosphate starvation in rice., 2016, 67(3): 947-960.
[12] Kim C Y, Vo K T X, Nguyen C D, Jeong D H, Lee S K, Kumar M, Kim S R, Park S H, Kim J K, Jeon J S. Functional analysis of a cold-responsive rice WRKY gene,., 2016, 10(1): 13-23.
[13] Raineri J, Wang S, Peleg Z, Blumwald E, Chan R L. The rice transcription factor OsWRKY47 is a positive regulator of the response to water deficit stress., 2015, 88(4/5): 401-413.
[14] Mirabella R, Rauwerda H, Allmann S, Scala A, Spyropoulou E A, de Vries M, Boersma M R, Breit T M, Haring M A, Schuurink R C.andact downstream of the green leaf volatile E-2-hexenal in., 2015, 83(6): 1082-1096.
[15] Abbruscato P, Nepusz T, Mizzi L, Del Corvo M, Morandini P, Fumasoni I, Michel C, Paccanaro A, Guiderdoni E, Schaffrath U, Morel J, Piffannelli P, Faivre-Rampant O., a monocot WRKY gene, plays a role in the resistance response to blast., 2012, 13(8): 828-841.
[16] Choi C, Hwang S H, Fang I R, Kwon S I, Park S R, Ahn I, Kim J B, Hwang D J. Molecular characterization of, which binds to W-box-like element 1 of thepathogenesis-related (PR) 10a promoter and confers reduced susceptibility to pathogens., 2015, 208(3): 846-859.
[17] Han M, Ryu H S, Kim C Y, Park D S, Ahn Y K, Jeon J S.is a transcription activator that enhances rice resistance to thepathovar., 2013, 56(4): 258-265.
[18] Hwang S H, Kwon S I, Jang J Y, Fang I R, Lee H, Choi C, Park S R, Ahn I, Bae S, Hwang D J. OsWRKY51, a rice transcription factor, functions as a positive regulator in defense response againstpv.., 2016, 35(9): 1975-1985.
[19] Lan A, Huang J, Zhao W, Peng Y, Chen Z, Kang D. A salicylic acid-induced rice (L.) transcription factor OsWRKY77 is involved in disease resistance of., 2013, 15(3): 452-461.
[20] Ciolkowski I, Wanke D, Birkenbihl R P, Somssich I E. Studies on DNA-binding selectivity of WRKY transcription factors lend structural clues into WRKY-domain function., 2008, 68(1/2): 81-92.
[21] Rushton P J, Somssich I E, Ringler P, Shen Q J. WRKY transcription factors., 2010, 15(5): 247-258.
[22] 马丽娜, 张雄, 窦道龙, 柴春月. 本氏烟NbWRKY40亚家族转录因子抗病相关功能研究. 植物病理学报, 2016, 46(6): 791-802.
Ma L N, Zhang X, Dou D L, Chai C Y. Functional analysis ofNbWRKY40 transcription factors of., 2016, 46(6): 791-802. (in Chinese)
[23] Xu X, Chen C, Fan B, Chen Z. Physical and functional interactions between pathogen-inducedWRKY18, WRKY40, and WRKY60 transcription factors., 2006, 18(5): 1310-1326.
[24] Pandey S P, Roccaro M, Schön M, Logemann E, Somssich I E. Transcriptional reprogramming regulated byWRKY18 and WRKY40 facilitates powdery mildew infection of., 2010, 64(6): 912-923.
[25] 罗昌国, 袁启凤, 裴晓红, 吴亚维, 郑伟, 章镇. 富士苹果基因克隆及其对白粉病的抗性分析. 西北植物学报, 2013, 33(12): 2382-2387.
LUO C G, YUAN Q F, PEI X H, WU Y W, ZHENG W, ZHANG Z. Cloning ofgene in Fuji apple and its response to powdery mildew stress., 2013, 33(12): 2382-2387. (in Chinese)
[26] 刘威, 张骏, 顾冕, 徐国华. 水稻转录因子WRKY-P1对地上部株型和根系构型的影响. 中国科技论文在线, 2016.
Liu W, Zhang J, Gu M, Xu G H. The effect of a rice transcription factorWRKY-P1 on shoot and root architecture. Sciencepaper Online, 2016. (in Chinese)
[27] 张高雷, 李保华, 董向丽, 王彩霞, 李桂舫, 国立耘. 苹果轮纹病瘤组织形态研究. 植物病理学报, 2011, 41(1): 98-101.
Zhang G l, Li B h, Dong X l, Wang C x, Li G f, Guo L y. Microanatomy conformation of apple branch tumors caused by., 2011, 41(1): 98-101. (in Chinese)
[28] Zhang X, Henriques R, Lin S S, Niu Q W, Chua N H.-mediated transformation ofusing the floral dip method., 2006, 1(2): 641-646.
[29] Wu S, Lu D, Kabbage M, Wei H L, Swingle B, Records A R, Dickman M, He P, Shan L. Bacterial effector HopF2 suppressesinnate immunity at the plasma membrane., 2011, 24(5): 585-593.
[30] Cai H, Yang S, Yan Y, Xiao Z, Cheng J, Wu J, Qiu A, Lai Y, Mou S, Guan D, Huang R, He S.transcriptionally activates, regulatesresistance, and confers high-temperature and high-humidity tolerance in pepper., 2015, 66(11): 3163-3174.
[31] Wang Y, Dang F, Liu Z, Wang X, Eulgem T, Lai Y, Yu L, She J, Shi Y, Lin J, Chen C, Guan D, Qiu A, He S., encoding a group I WRKY transcription factor of, negatively regulates resistance toinfection., 2013, 14(2): 131-144.
[32] Zheng Z Y, Qamar S A, Chen Z X, Mengiste T.WRKY33 transcription factor is required for resistance to necrotrophic fungal pathogens., 2006, 48(4): 592-605.
[33] 石亚莉, 周会玲, 唐永萍, 贺军花, 马利菁. 水杨酸诱导苹果采后灰霉病抗性研究. 西北农林科技大学学报(自然科学版) , 2018, 46(2): 84-91, 103.
SHI Y l, ZHOU H l, TANG Y P, HE J h, MA L j. Induced resistance of postharvest apples toinduced by salicylic acid treatment., 2018, 46(2): 84-91, 103. (in Chinese)
[34] Kazan K. Diverse roles of jasmonates and ethylene in abiotic stress tolerance., 2015, 20(4): 219-229.
[35] Khan M I, Fatma M, Per T S, Anjum N A, Khan N A. Salicylic acid-induced abiotic stress tolerance and underlying mechanisms in plants., 2015, 6: 462.
[36] Ramamoorthy R, Jiang S Y, Kumar N, Venkatesh P N, Ramachandran S. A comprehensive transcriptional profiling of the WRKY gene family in rice under various abiotic and phytohormone treatments., 2008, 49(6): 865-879.
[37] 邱化荣, 周茜茜, 何晓文, 张宗营, 张世忠, 陈学森, 吴树敬. 基于转录组分析苹果水杨酸特异响应基因的启动子鉴定. 中国农业科学, 2017, 50(20): 3970-3990.
QIU H R, ZHOU Q Q, HE X W, ZHANG Z Y, ZHANG S Z, CHEN X S, WU S J. Identification ofpromoter specific response to salicylic acid by transcriptome sequencing., 2017, 50(20): 3970-3990. (in Chinese)
[38] ROBATZEK S, SOMSSICH I E. Targets ofregulation during plant senescence and pathogen defense., 2002, 16(9): 1139-1149.
[39] Gu Y, Li W, Jiang H, Wang Y, Gao H, Liu M, CHEN Q, LAI Y, HE C. Differential expression of a WRKY gene between wild and cultivated soybeans correlates to seed size., 2017, 68(11): 2717-2729.
[40] Zhang J, Peng Y, Guo Z. Constitutive expression of pathogen- inducibleenhances disease resistance and affects root growth and auxin response in transgenic rice plants., 2008, 18(4): 508-521.
[41] Wei L, Wang H, Yu D.WRKY transcription factorsWRKY12 and WRKY13 oppositely regulate flowering under short- day conditions., 2016, 9(11): 1492-1503.
[42] Cheng Y, Ahammed G J, Yu J, Yao Z, Ruan M, Ye Q,Li Z, Wang R, Feng K, Zhou G, Yang Y, Diao W, Wan H. Putative WRKYs associated with regulation of fruit ripening revealed by detailed expression analysis of the WRKY gene family in pepper., 2016, 6: 39000.
[43] Yang Y, Chi Y, Wang Z, Zhou Y, Fan B, Chen Z. Functional analysis of structurally related soybean GmWRKY58 and GmWRKY76 in plant growth and development., 2016, 67(15): 4727-4742.
[44] Devaiah B N, Karthikeyan A S, Raghothama K G. WRKY75 transcription factor is a modulator of phosphate acquisition and root development in., 2007, 143(4): 1789-1801.
Mediated improvement of the immune Resistance of Apple andto
ZHOU QianQian1, QIU HuaRong1, HE XiaoWen1, Wang XianPu1, LIU XiuXia1, LI BaoHua2, WU ShuJing1, CHEN XueSen1
(1College of Horticultural Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology, Taian 271018, Shandong;2College of Plant Health and Medicine, Qingdao Agricultural University, Qingdao 266109, Shandong)
【Objective】The objective of this study is to clonefrom ‘Fuji’ apple, research its expression pattern under salicylic acid (SA)-induced conditions and its role in the disease resistance pathway of, and to provide a theoretical basis for further revealing the disease resistance mechanism of apple.【Method】The full-length CDS sequence ofwas cloned from ‘Fuji’ apple, and its bioinformatics analysis was carried out. Fluorescence quantitative PCR (qRT-PCR) was used to analyze the expression level in different apple tissues and the response to abiotic stress SA, to study the effect of exogenous SA treatment on apple leaves inoculated with pathogenic fungi, and to detect the expression of pathogenesis-related protein gene by qRT-PCR.was expressed heterologous in, and the stably expressedseedlings were treated withto observe the degree of disease and the number of infected leaves. The expression of disease-associated genes was analyzed by qRT-PCR. The root length ofseedlings was measured and the expression of auxin-related genes was detected by qRT-PCR.【Result】contains a complete open reading frame of 858 bp in length and encodes 286 amino acids. The predicted molecular weight is 32.088 kD and the isoelectric point is 8.15. Phylogenetic tree analysis showed that MdWRKY40 has the highest similarity with the PbWRKY40 sequence, and its genetic relationship is closest. MdWRKY40 and AtWRKY40 locate in different branches, and its genetic relationship is far from that of AtWRKY40. The multiple sequence alignment analysis of MdWRKY40 and AtWRKY40 by using DANMAN software revealed that both MdWRKY40 protein and AtWRKY protein contain a WRKYGQK conserved domain, but similarity is only 29.78%. qRT-PCR analysis showed that the expression level ofwasthe highest in root and lowest in leaf. SA inducedexpression in root, stem and leaf, and the expression all increased first and then decreased, reached the highest level at 6 h. Exogenous SA enhanced the resistance of apple leaves to, the incidence of untreated leaves reached 92.59%, and the incidence after SA treatment decreased to 79.26%, and significantly increased the expression of disease-associated protein genesand. Compared with the wild type, the overexpression ofsignificantly increased the resistanceofleaves toThe incidence of wild typereached 77.5%, while the incidence of two transgeniclines was only 21.5% and 17.4%,and significantly increased the expression of,, andgenes associated with disease progression. The root growth ofplants with overexpression ofwas inhibited. after 7 days of culture, the length of main root of transgenicwas 39.9% and 43.1% respectively of that of wild type. after 10 days of culture, the length of main root of transgenicwas 58.5% and 55.4% respectively of that of wild type. The expression level of the auxin synthesis-related geneand auxin transport-related genesandwas significantly lower in theoverexpression lines than in the wild type.【Conclusion】The expression ofwas induced by the infection of SA and the pathogenic fungi.is an important disease resistance gene in apple. The overexpression ofsignificantly increased the resistance to.has the function of regulating the growth and development of plant roots, which may affect the growth and development of plant roots by down-regulating the expression of auxin transport-related genes.
apple;; salicylic acid (SA);; immune resistance; root growth
10.3864/j.issn.0578-1752.2018.21.005
2018-05-14;
2018-06-19
国家自然科学基金(31272132)、山东省泰山学者工程启动基金(tshw20120712)、作物生物学国家重点实验室导向性课题(dxkt201713)
周茜茜,E-mail:18763829703@163.com。通信作者吴树敬,Tel:0538-8246220;E-mail:wushujing666@163.com。通信作者陈学森, Tel:0538-8249338;E-mail:chenxs@sdau.edu.cn
(责任编辑 岳梅)

