腹腔镜精准肝切除对原发性肝癌患者MMP、VEGF、sPD-1的影响
付 宁,沙 莎
1.成都医学院第一附属医院 肝胆外科(成都 610500);2.成都医学院(成都 610500)
原发性肝癌(primary liver cancer,PLC)是源于肝内胆管上皮及肝细胞的恶性肿瘤,其发病隐匿,恶性程度高,极易导致患者死亡[1]。在我国因恶性肿瘤死亡病例中,PLC位居第2位[2]。手术治疗可彻底切除病灶,减轻患者癌症负担,促进患者转归,目前仍然是临床治疗PLC的主要手段[3]。研究[4]显示,常规术式治疗PLC尽管可彻底切除病灶,但因脏器切除体积大,易影响患者术后恢复。腹腔镜精准肝切除(laparoscope precise hepatectomy,LPH)可通过精细化操作,尽量保留患者残余脏器功能,目前已逐渐应用于PLC的临床治疗[5]。在PLC生长、转移过程中,基质金属蛋白酶(MMP)、血管内皮生长因子(VEGF)及可溶性PD-1(sPD-1)等指标具有重要作用,研究MMP、VEGF、sPD-1水平变化对于评价LPH治疗PLC的临床疗效及患者的转归具有积极意义。本研究对LPH治疗PLC的疗效及其对MMP、VEGF、sPD-1水平的影响进行分析,以期为PLC的治疗提供依据。
1 资料与方法
1.1 临床资料
选取2014年1月至2016年12月于成都医学院第一附属医院行手术治疗的PLC患者120例为研究对象。纳入标准:1)依据影像学及组织病理学诊断为PLC患者;2)符合手术指征的患者;3)病灶位于半肝内,Couinaud Ⅱ~Ⅵ段患者;4)Child-Pugh肝功能分级为A、B级患者;5)单发病灶最大径≤5 cm,病灶个数≤3个,且未侵犯一、二肝门患者;6)预期生存>90 d患者;7)KPS评分≥70分患者;8)知情同意患者。排除标准:1)病灶已转移患者;2)肝肾功能严重失常患者;3)免疫性疾病患者;4)其他恶性肿瘤患者;5)手术不耐受患者;6)感染性疾病患者;7)依从性差的患者。按照随机数字表法将患者分为试验组和对照组,每组60例,两组患者性别、年龄、病灶直径等一般资料比较,差异无统计学意义(P>0.05)(表1),具有可比性。
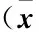
表1 两组患者一般资料比较±s,n=60)
1.2 方法
1.2.1 对照组 对照组行非规则性肝切除。患者取仰卧位,气管全麻,术前依据影像学检查结果规划切除区域,Pringle法阻断入肝血流,先阻断20 min,后复流5 min,以钳夹法将肝脏离断,肝断面对拢缝合,放置引流管后缝合。
1.2.2 试验组 试验组行LPH。患者取头高脚低仰卧位,气管全麻,术前以螺旋CT精准定位病灶,建立CO2气腹,气腹压力维持11~13 mm Hg,观察孔取脐下2 cm位,若肝左叶病灶主操作孔取左侧锁骨中线肋缘下大约2~3 cm位,若肝右叶病灶主操作孔取剑突下大约2~3 cm位。以超声刀将肝圆韧带及镰状韧带依次切断,肝左叶病灶需将肝左叶韧带及肝胃韧带切除,肝右叶病灶需将右冠状韧带切除。阻断切除肝段血流,按照无瘤原则切除病灶,创面清理止血后放置引流管缝合。
1.3 观察指标
观察两组患者手术及术后恢复指标;两组患者术前、术后7 d MMP-2、MMP-9及VEGF、sPD-1水平;术前、术后7 d T细胞(T)、辅助性T细胞(Th)、抑制性T细胞(Ts)、细胞因子诱导的杀伤细胞(CIK)、自然杀伤细胞(NK) 等免疫因子水平;术后并发症发生情况;术后1年患者复发情况等指标。MMP以明胶酶谱法检测;VEGF、sPD-1以双抗体夹心ELISA法检测;T、Th、Ts、CIK、NK以流式细胞仪检测。MMP-2/9活性检测试剂盒(明胶酶谱法)购自上海信帆生物科技有限公司;VEGF、sPD-1试剂盒均购自美国Y-J Biological公司;T、Th、Ts、CIK、NK检测试剂盒购自美国BD公司。
1.4 统计学方法

2 结果
2.1 两组患者术中及术后恢复指标比较
与对照组比较,试验组患者术中出血量、输血量、引流量、排气时间及住院时间均较少;肝门阻断时间、手术时间均较长,差异均有统计学意义(P<0.05)(表2)。
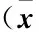
表2 两组患者术中及术后恢复指标比较±s,n=60)
2.2 两组患者MMP、VEGF及sPD-1比较
术前,两组患者MMP-2、MMP-9、VEGF及sPD-1水平比较,差异无统计学意义(P>0.05);术后7 d两组患者MMP-2、MMP-9、VEGF水平均下降,sPD-1水平升高,与术前比较,差异有统计学意义(P<0.05);术后7 d,两组患者MMP-2、MMP-9、VEGF水平比较,差异无统计学意义(P>0.05);术后7 d,试验组sPD-1水平高于对照组,差异有统计学意义(P<0.05)(表3)。
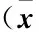
表3 两组患者MMP及VEGF、sPD-1水平比较±s,n=60)
注:与术后7 d比较,aP<0.05
2.3 两组患者免疫因子水平比较
术前,两组患者T、Th、Ts、CIK、NK 5个免疫因子指标比较,差异无统计学意义(P>0.05);与术前比较,术后7 d两组患者T、Th、CIK、NK水平均降低,Ts指标升高,差异有统计学意义(P<0.05);术后7 d,试验组患者T、Th、CIK、NK水平高于对照组,Ts水平低于对照组,差异有统计学意义(P<0.05)(表4)。

表4 两组患者免疫因子水平比较(×109/L,±s,n=60)
注:与术后7 d比较,aP<0.05
2.4 两组患者术后并发症、术后1年复发情况比较
试验组患者术后并发症发生率为5.00%(3/60),低于对照组的18.33%(11/60),差异有统计学意义(P<0.05)。试验组患者术后1年复发率为23.33%(14/60),与对照组的28.33%(17/60)比较,差异无统计学意义(P>0.05)(表5)。

表5 两组患者术后并发症、术后1年复发情况比较[n(%),n=60]
3 讨论
病灶完整切除,尽量减少机体创伤,残肝功能能够满足生理需要是PLC成功的前提[6]。LPH以微创为基础,将精准理念引入术前评估、手术设计、术中操作与术后管理,实现微创与精准治疗的完美融合,以达到治疗PLC的目的[7]。在LPH操作过程中,术前需恰当评估肝脏切除的体积及残肝功能,并按照术前评估设计手术方案,并恰当选择入肝血流阻断,实现精细离断肝断面及肝实质,减少术中创伤。术后精准管理,便于早期发现并快速处理术后并发症[8]。在本研究中,除肝门阻断及手术时间长于对照组外,试验组手术情况、术后恢复指标及术后并发症发病率均优于对照组,说明LPH治疗PLC可减少创伤,便于患者康复。
研究[9-10]表明,MMP、VEGF均为促进肿瘤侵袭、转移的重要物质,可用于肿瘤患者预后评价。MMP为Zn2+依赖性蛋白水解酶,可促进细胞外基质及基底膜中多种胶原的降解,便于肿瘤细胞突破基底膜,并在基质内侵袭性生长,有利于肿瘤的发生及浸润[11]。MMP-2、MMP-9可释放并激活生长因子,促进上皮间质转换,下调上皮细胞间的连接成分,消除细胞间相互作用力,提高肿瘤细胞增殖、转移能力[12]。MMP-2、MMP-9可促进肿瘤新生血管形成[13],影响T细胞活性,提高肿瘤细胞的耐受性[14]。VEGF为新生血管的调控因子,可特异性作用于血管内皮细胞,促进其增殖及迁移,促进PLC血管的形成[15]。VEGF可经多种蛋白激酶途径及促进表达转录因子ETS-1以提高MMP-2、MMP-9活性,增加肿瘤侵袭能力[16]。张雄杰等[17]证明,TACE可显著降低肝癌及癌旁组织MMP-2、MMP-9水平,可用于肝癌治疗疗效及预后评价。张景洲等[18]发现,下调肝癌细胞HepG2中MMP-2、MMP-9的表达,可有效抑制肝癌细胞HepG2。万健等[19]证明,肝癌患者癌旁组织VEGF水平与患者TNM分期、包膜、门脉癌栓及肿瘤侵袭性关系密切,可用于肝癌患者疗效及预后评价。本研究中,术后两组患者MMP-2、MMP-9及VEGF水平均明显降低,且组间差异有统计学意义,提示两种术式均可有效切除PLC病灶,降低MMP及VEGF水平。
机体免疫失衡是肿瘤细胞增殖、转移的关键因素,纠正机体免疫失衡可有效提高机体免疫能力[20]。研究[21]证明,肿瘤细胞可通过表达PD-L干预T细胞,促进免疫机制负调控,致使免疫失衡。sPD-L可抑制肿瘤细胞表达PD-L,纠正免疫失衡,促进肿瘤免疫[22]。研究[23]证明,PLC患者sPD-L水平显著降低,其对肿瘤细胞表达的PD-L的抑制作用明显降低,机体免疫作用减弱,致使发生肿瘤免疫逃逸。在本研究中,术后两组患者sPD-L及免疫因子水平均高于对照组,且试验组高于对照组,提示LPH可提高sPD-L水平,有利于免疫机制快速恢复。
综上所述,LPH治疗PLC可完整切除病灶,维护残肝功能,并有效降低MMP-2、MMP-9及VEGF水平,且对机体扰动小,有利于患者免疫机制的恢复及康复。