湿法磷酸副产物氟硅酸制备氟化钾工艺研究
李泽坤,丁一刚,龙秉文,邓伏礼,柯文昌
(武汉工程大学化工与制药学院,绿色化工过程教育部重点实验室,湖北省新型反应器与绿色化学工艺重点实验室,湖北武汉430073)
含氟化合物具有许多特殊性能,可广泛用作医药、农药、染料中间体、精细化学品的合成氟化剂。氟化钾作为重要产品,还被广泛用于玻璃雕刻、水汽和氟化氢气体的吸收剂、络合剂、掩蔽剂、金属分析、食品包装材料防腐等[1]。
传统合成氟化钾的工艺主要有中和法、氟硅酸钾裂解法[2]、氯化钾与氢氟酸反应法和氟硅酸钾氨解法[3]等。笔者以湿法磷酸副产物氟硅酸直接生产氟化钾,与传统工艺相比具有以下优点:1)工艺简单,产品质量合格;2)无副产物稀盐酸废水生成,设备腐蚀性降低;3)避免中间产物的产生,降低SO42-、PO43-、SiF62-的含量;4)采用湿法磷酸副产物氟硅酸为原料成本低,且能充分利用氟资源[4]。
1 实验
1.1 原料与仪器
湿法磷酸副产物氟硅酸(H2SiF6,质量分数为10%~15%)、氢氧化钾(KOH,质量分数为 48%)、氢氧化钡[Ba(OH)2,AR,质量分数为 99%,国药集团化学试剂有限公司]、氟硅酸(AR,质量分数为30%,天津西陇化工有限公司)。
仪器:SH2601型精密酸度剂、UV-1600型紫外分光光度计、Xsp-35型显微镜、DL-120E型超声仪、DZF-6050型真空干燥箱。
1.2 实验步骤
将过滤后的氟硅酸缓慢滴加至氢氧化钾中搅拌、碱解、过滤,多次洗涤滤饼制得粗氟化钾母液A;向母液A中加入一定量的氢氧化钡除硫酸根,过滤后得到母液B;用稀释至10%(质量分数)的氟硅酸反调母液B的pH,过滤得到母液C;将母液C通过结晶干燥制得氟化钾晶体。主要流程见图1。主要反应:
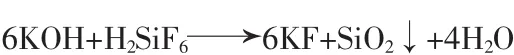
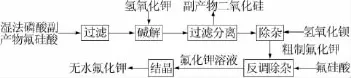
图1 湿法磷酸副产物氟硅酸直接生产氟化钾的工艺流程示意图
2 结果与分析
2.1 反应温度对产品收率的影响
在原料物质的量比[n(KOH)∶n(H2SiF6)]为 6∶1、氟硅酸滴加速度为0.6 g/min的条件下,考察了不同反应温度(60、70、80、90、100 ℃)对产品收率的影响,结果见图2。由图2可知,随着反应温度的升高,氟化钾的收率先增大后减小。反应温度为80℃时,氟化钾收率最大达到92%。氟硅酸水溶液中SiF62-易水解,随着温度的升高SiF62-的水解程度增大,有利于反应的进行。但温度过高时,氟硅酸易分解为四氟化硅和氟化氢,此时温度越高氟硅酸的损失量越大,致使产品的收率降低。综合考虑,实验选择适宜的反应温度为80℃。
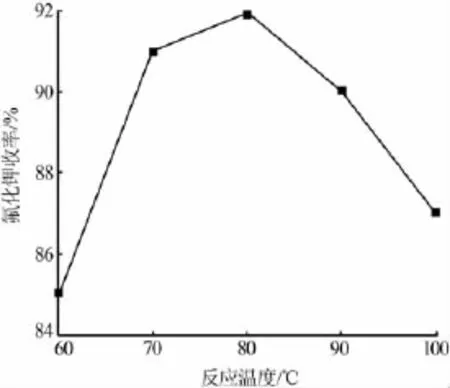
图2 反应温度对氟化钾收率的影响
2.2 氟硅酸滴加速度对产品收率的影响
由于氟硅酸与氢氧化钾碱解反应有副产物二氧化硅产生,直接一次添加氟硅酸会使反应不充分而导致原料浪费、产品分离难度增加等问题,在氢氧化钾溶液为 100 g、n(KOH)∶n(H2SiF6)=6∶1、反应温度为80℃的条件下,实验考察了不同滴加速度(0.3、0.5、0.8、1.0、1.5、2.0、2.5 g/min) 对产品收率的影响,结果见图3。从图3可以看出,随着滴加速度的加快,氟化钾的收率明显下降,说明滴加速度越快,原料接触越不充分,原料损耗也越大。当氟硅酸滴加速度小于0.8 g/min时,其与反应物充分接触,同时避免了中间产物氟硅酸钾混在二氧化硅中被分离出去,因此此时收率较高。但如果滴加速度过慢,不仅耗时耗能,而且对收率的提高没有积极作用。此外,滴加速度过快时,易产生中间产物氟硅酸钾,氟硅酸钾来不及碱解生成氟化钾就与副产物二氧化硅在烧杯内壁聚集成块,造成原料的浪费和反应器的堵塞。当滴加速度为0.5~0.8 g/min时,氟化钾的收率为92.6%~93.4%。为保证反应的充分进行及提高原料利用率,实验确定每100 g原料氢氧化钾溶液中氟硅酸适宜的滴加速度应为0.5~0.8 g/min。
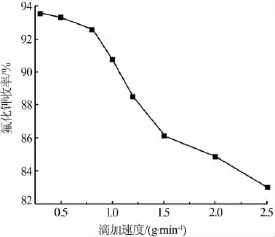
图3 氟硅酸滴加速度对氟化钾收率的影响
2.3 氢氧化钾加入量对产品收率的影响
在氟硅酸滴加速度为0.6g/min、反应温度为80℃的条件下,考察了原料氢氧化钾实际加入量与理论加入量物质的量比[n(KOH实)∶n(KOH理),0.98∶1、1∶1、1.02∶1、1.04∶1、1.06∶1、1.08∶1] 对产品收率的影响,结果见图 4。由图 4 可以看出,当 n(KOH实)∶n(KOH理)为0.98~1.08时,氟化钾收率从86.6%增至91.9%;当 n(KOH实)∶n(KOH理)=1.04 时,氟化钾收率最大,之后继续增加氢氧化钾的用量对氟化钾的收率几乎没有影响。氢氧化钾过量一方面使氟硅酸反应完全,提高氟的利用率。另一方面可以除去原料氟硅酸中含有的少量镁、铝等金属杂质,提高产品品质。因此,实验确定氢氧化钾最佳用量为理论量的1.04倍。
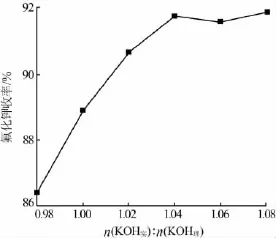
图4 氢氧化钾用量对氟化钾收率的影响
2.4 氢氧化钡加入量对除硫及氟化钾品质的影响
对粗氟化钾进行硫酸盐检测,发现氟化钾中SO42-的质量分数为0.6%~0.7%,达不到合格品的要求。因此,必须对粗氟化钾溶液进行除硫。
氢氧化钡和碳酸钡是常见的除硫试剂,但是碳酸钡难溶于水,且CO32-在碱性条件下易形成HCO3-。因此,实验选择氢氧化钡作为除硫试剂,并考察了不同氢氧化钡与原料氢氧化钾物质的量比(0.002∶1、0.003∶1、0.004∶1、0.005∶1、0.006∶1)对除硫和氟化钾纯度的影响,结果见图 5。由图5可以看出,当n[Ba(OH)2]∶n(KOH)=0.004∶1 时,SO42-的含量最低,之后继续增加氢氧化钡用量已无意义,但当n[Ba(OH)2]∶n(KOH)=0.005∶1 时,氟化钾的纯度最高,这是由于除硫过程中,Ba2+能与氟化钾中少量的PO43-、SiF62-反应形成沉淀,进一步提高了氟化钾的纯度。因此,实验确定 n[Ba(OH)2]∶n(KOH)=0.005∶1。
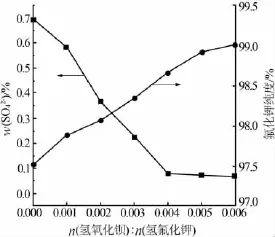
图5 氢氧化钡加入量对SO42-含量和氟化钾纯度的影响
2.5 反调终点对二氧化硅含量和氟化钾纯度的影响
粗氟化钾溶液若直接进行结晶干燥,二氧化硅的质量分数为0.6%左右,产品纯度为96.0%~97.6%,无法满足HG/T 2829—2008《工业无水氟化钾》中合格品的要求[w(SiO2)≤0.3%,产品纯度≥98%][5]。
为了降低氟化钾中二氧化硅的含量,需要找到一种净化剂,既能中和过量的OH-(粗氟化钾pH=11),又不能引入新的杂质,实验选择用稀释至质量分数为10%的氟硅酸净化除杂[6-7]。实验条件:用质量分数为10%的氟硅酸反调粗氟化钾溶液pH,考察了粗氟化钾溶液不同反调终点pH(7.2、7.4、7.6、7.8、8.0、8.2)对二氧化硅含量和氟化钾纯度的影响,结果见图6。由图6可以看出,当调节粗氟化钾溶液pH终点为7.6~7.8时,二氧化硅质量分数为0.1%左右,氟化钾纯度达到98.8%以上。结果表明,体系中二氧化硅含量受pH的影响明显,通过调节pH可有效地控制二氧化硅含量。因此,实验选择氟硅酸反调粗氟化钾适宜的反调终点pH为7.6~7.8。
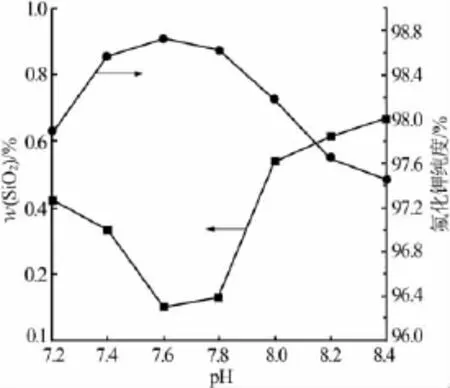
图6 反调终点pH对二氧化硅和氟化钾纯度的影响
2.6 净化除杂前后能谱分析和产品分析
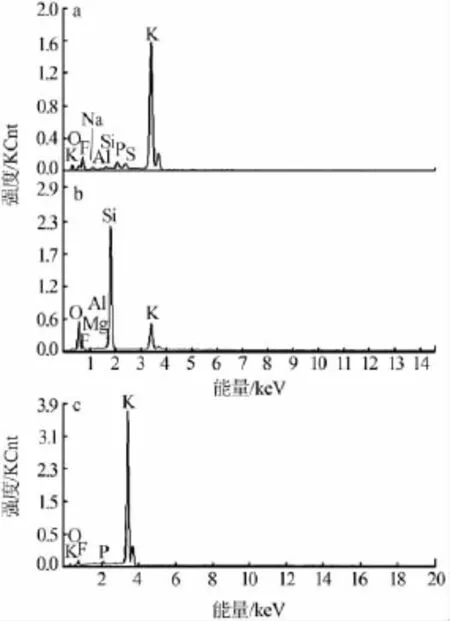
图7 粗氟化钾(a)及副产物二氧化硅(b)和净化后氟化钾(c)的能谱分析
实验对粗制氟化钾、副产物二氧硅及精制氟化钾做了能谱检测,结果见图7。未除杂的粗氟化钾纯度只有96%~97%,达不到工业品要求。由图7a可以看出,未除杂时制得的粗氟化钾中主要含有P、Si、S、Al、O等杂质元素。由图7b可知,在副产物二氧化硅中,除 Si、O 元素外,还含有 F、K、Mg 及 Al等元素。这是由于二氧化硅易吸附,分离出来易夹杂少量的KF和 K2SiF6,另外 Mg2+和 Al3+与过量的 OH-形成的 Al(OH)3和 Mg(OH)2沉淀也随二氧化硅分离出来。由图7c可以看出,大部分杂质被去除。P和O元素是氟化钾中仍含有少量的PO43-和H2O。根据GB/T 1871.1—1995《磷矿石和磷精矿中五氧化二磷含量的测定磷钼酸喹啉重量法和容量法》[8]测试净化后氟化钾中五氧化二磷质量分数为0.1%左右,根据HG/T 2829—2008《工业无水氟化钾》测得水质量分数为0.2%左右,满足优等品的要求。经测定净化除杂后氟化钾纯度达到了99%左右,各项指标均达到工业要求。对比未除杂前,氟化钾纯度提高了2%~3%。
将净化除杂后的氟化钾溶液在80℃下搅拌,真空结晶1.5 h得到白色晶体。显微镜放大400倍后观察,结果见图8。由图8可知,晶体主要为单斜的针状,对比标尺用ImageJ软件处理图片测得晶体粒径为80~100 μm,水质量分数为0.4%左右。而采用传统工艺浓缩结晶在140℃下需要浓缩12 h,冷却后得到的晶体呈颗粒状,粒径为120~140 μm,水质量分数为0.5%左右,如图9所示。氟化钾溶解度大,易吸潮,易粘连,但在真空结晶下,水蒸发速度快,溶液过饱和度增加也就越快,容易超越介稳区到达不稳区而析出大量晶核,另外,搅拌能促进晶体二次成核,使晶体分散。由此可见,真空结晶较浓缩结晶得到的氟化钾晶体含水量低、粒径小、能耗低,具有较大的经济效益。

图8 真空结晶电镜照片

图9 浓缩结晶电镜照片
3 结论
1)实验得到湿法磷酸副产物氟硅酸一步法制备氟化钾的最优反应工艺条件:反应温度为80℃,每100 g氢氧化钾溶液中氟硅酸滴加速度为0.5~0.8 g/min、氢氧化钾的加入量是理论量的1.04倍,在此条件下得到的氟化钾收率达92%以上。2)实验制得的氟化钾除杂工艺条件:氢氧化钡加入量与原料氢氧化钾加入量物质的量比为0.005∶1;氟硅酸反调pH终点为7.6~7.8。净化除杂后得到氟化钾纯度达到99%左右。对比未除杂前,氟化钾纯度提高了2%~3%,且各项指标均达到工业要求。3)真空晶体制得氟化钾主要呈单斜针状,较传统工艺浓缩结晶具有含水量低、粒径小、节能等优势,具有较大的经济效益和工业价值。

