不同寄主大丽轮枝菌培养性状的比较及致病力分化的分析
陈志荣,赵小强,孙琦,王元杰,黄家风
(新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室/石河子大学农学院,新疆 石河子 832003)
大丽轮枝菌(Verticillium dahliae)是世界性的土传植物病原真菌,寄主范围广泛,可侵染660多种双子叶植物,引起棉花、茄子、向日葵、马铃薯、苜蓿、番茄、莴苣和大豆等多种经济作物的黄萎病,对农业生产造成极大危害[1-2]。
王克荣等[3]研究表明大丽轮枝菌在人工培养条件下菌落培养性状具有明显差异,并将大丽轮枝菌在PDA平板上形成的菌落培养性状分为A型(野生型)、B型(绒毛型)、C型(菌膜型)和D型(矮化型)4种类型;朱荷琴等[4]将全国主要棉区的棉花黄萎病菌在 PDA培养基上培养性状分为5个类型,并发现长江流域棉区菌株培养性状变异最大,其次是黄河流域,新疆棉区的变异最小。更多的研究将大丽轮枝菌在PDA平板上形成的菌落分为菌核型、菌丝型和中间型3种类型[5]。培养性状的差异反映了不同菌株之间生长发育或营养需求的不同。大丽轮枝菌在寄生阶段,其生长发育所需的营养来源主要由寄主提供,不同寄主来源的大丽轮枝菌在与其寄主长期适应、协同进化的过程中形成了特定的营养需求,但是有关不同寄主来源大丽轮枝菌有何营养差异却缺乏相关研究。
大丽轮枝菌变异性强,在与寄主协同进化的过程中,由于病菌异核现象的产生和生态环境差异的影响,常发生生理分化,产生新的生理型或致病型[6]。但是有关大丽轮枝菌致病类型的划分一直以来却没有统一的标准。研究最多的是引起棉花黄萎病的棉花大丽轮枝菌(即棉花黄萎病菌),其致病类型划分早在1977-1978年,我国棉花黄萎病菌生理型联合试验组对8省(区)的 10个黄萎病菌系用9个鉴别寄主接种鉴定后,将黄萎病菌分为 3个生理型,分别为致病力强的生理型Ⅰ、致病力弱的生理型Ⅱ、致病力中等的生理型Ⅲ[7];美国学者根据棉花黄萎病菌的不同菌系对棉花致病的严重程度和症状类型,将棉花黄萎病菌划分为落叶型和非落叶型2种致病型,并且普遍认为落叶型致病力比非落叶型致病力强[8]。而对于番茄大丽轮枝菌,根据是否介导含Ve1基因的番茄产生抗性分为1号生理小种和2号生理小种[9];并且通过基因组测序发现,Ave1基因只存在于1号生理小种,由其编码的Ave1效应子蛋白才能激发含Ve1基因的番茄产生抗性,2号生理小种因不含Ave1基因,不能激发含Ve1基因的番茄产生抗性而导致发病[10]。对于其它寄主来源的大丽轮枝菌,其致病型是否也可以按照棉花大丽轮枝菌和番茄大丽轮枝菌的归类依据进行划分,以及不同的划分标准之间是否存在相关性目前并不明确。
为此,本研究针对不同寄主来源的大丽轮枝菌,通过培养性状的观察和对不同碳源和氮源的利用情况分析了营养条件对大丽轮枝菌生物学性状的影响,通过生理小种、落叶型或非落叶型的分子鉴定及对棉花的致病力,对不同寄主来源的大丽轮枝菌的致病型进行鉴定,从而为大丽轮枝菌致病型的科学划分提供依据和有效防治奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株
供试大丽轮枝菌菌株,V592和S4分别分离自新疆棉花,由本实验室分离保存;S1分离自内蒙古向日葵,由内蒙古农业大学景岚教授馈赠;S2分离自新疆马铃薯,由新疆农业大学李克梅副教授馈赠;S3分离自新疆茄子、V30和V31分离自宁波茄子、Vnu分离自宁波红花、Vtr分离自宁波番茄,均由宁波动植物出入境检验检疫局段维军馈赠。所有菌株均经过单孢分离得到其纯化的单孢菌系。
1.1.2 植物材料
本实验室所用的植物材料为高感黄萎病菌棉花品种军棉1号。
1.2 方法
1.2.1 ITS序列扩增及测序
将-80℃保存的甘油菌在冰上解冻,吸取50-100 μL菌液均匀涂抹在PDA(马铃薯琼脂糖培养基)培养基上,22℃暗培养7 d左右。利用真菌DNA提取试剂盒分别提取8个菌株的DNA,用引物ITS1 (5'-TCCUTAUUTUAACCT-CUCUU-3') 和 ITS4(5'-TCCTCCUCTTATTUATAT-GC-3')[11]对菌株的ITS区进行扩增,然后将PCR产物送交生工生物工程(上海)股份有限公司进行序列测定。将测得的序列在 NCBI数据库进行 BLAST(http://blast.ncbi.nlm.nih.gov/)比对。
1.2.2 PDA培养基上的培养性状的观察
用接种针蘸取PDA培养基上培养 5 d的菌株分生孢子,接种于PDA培养基平板中央,22℃暗培养20 d,根据各菌株在 PDA培养基上的微菌核产量以及菌落特性观察菌落性状:菌核型菌株培养 2周后产生大量黑色微菌核,菌落呈黑色;菌丝型菌落表面呈白色或浅黄色,气生菌丝发达,培养 2周后仍未出现黑色微菌核;中间型菌株培养 2周时,仅菌落中部有大量的微菌核产生,微菌核产量明显少于菌核型。在菌落生长的第10 d和第20 d,采用十字交叉法测量菌落直径,计算菌落生长速度。
菌落生长速度=(第20 d菌落直径-第10 d菌落直径)÷10。
每个菌株设3个重复,每次菌落直径的测量为3次重复的平均值。
1.2.3 产孢量及分生孢子萌发率的测定
将PDA平板上培养7 d的菌株用10 mm的打孔器取10块菌饼,放入察氏液体培养基中摇培 3 d[12],用高温灭菌过的4层纱布过滤收集分生孢子,再用高温灭菌过的蒸馏水调整孢子浓度至106cfu/mL。取100 μL的孢子悬浮液加入100 mL的察氏培养基中,22℃、200 r/min摇培,分别在2 d、3 d、4 d、5 d、6 d和7 d取样进行孢子浓度的测定;每个菌株重复3次,测量结果为3次重复的平均值。吸取1 mL上述的孢子悬浮液装入2 mL的离心管中,分别在 0 h、6 h、24 h、48 h、72 h 及 1 周观察孢子萌发情况;每个菌株重复3次,测定结果为3次重复的平均值。
1.2.4 碳源和氮源对大丽轮枝菌培养性状的影响
1.2.4.1 碳源对大丽轮枝菌培养性状的影响
根据察氏固体培养基中碳源蔗糖的分子质量,算出30 g蔗糖含碳量为12.62 g,然后分别用含碳量为12.62 g的葡萄糖、麦芽糖和甘油3种碳源替代蔗糖,无碳源处理作为对照。
在无菌条件下将分生孢子接种到上述的培养基平板上,置于22℃的恒温条件下培养,每个处理重复3次,每隔5 d观察菌落形态并测量菌落直径,每次菌落直径的测量为3次重复的平均值,利用SPSS软件分析实验结果。
1.2.4.2 氮源对大丽轮枝菌培养性状的影响
根据察氏固体培养基中硝酸钠的分子质量,算出2.0 g硝酸钠的含氮量为0.33 g,然后分别用含氮量为0.33 g的氯化铵、硫酸铵和蛋白胨替代硝酸钠,无氮处理作为对照。
在无菌条件下将分生孢子接种到不同氮源的培养基平板上,置于22℃的恒温条件下培养,每个处理重复3次,每隔5 d观察菌落形态并测量菌落直径,每次菌落直径的测量为3次重复的平均值,利用SPSS软件分析实验结果。
1.2.5 致病类型的分子检测
利用BiospinFungusGenomicDNAExtraction Kit(BioFlux)试剂盒分别提取9个菌株的基因组。分别以大丽轮枝菌落叶型(D-1/D-2)和非落叶型(ND-1/ND-2)特异引物[13]及1号生理小种(VdAve1F/VdAve1R[10]和 Trl/Tr2[14])和 2 号生理小种(VdR2F/VdR2R)[15](引物见表1)对9个大丽轮枝菌菌株进行致病类型的分子检测。
PCR 反应体系为 25 μL,Taq 聚合酶 0.5 μL,Taq酶缓冲液 2.5 μL,dNTP 2.0 μL、引物 1.0 μL、模板1.0 μL。PCR反应程序:95℃ 3 min;95℃ 45 s,56 ℃ 30 s,72 ℃ 10 min,30个循环;72 ℃ 10 min。

表1 致病类型分子检测所用的PCR引物Tab.1 Primers used for molecular detection of pathotype
1.2.6 对棉花致病力的测定
将PDA平板上培养7 d的菌株用10 mm的打孔器取10块菌饼,放入察氏液体培养基中22℃,200 r/min摇培 3 d,4层纱布过滤收集各菌株的分生孢子,用清水调整孢子浓度至107cfu/mL,浸根接种法接种两叶一心期棉花幼苗[16]。
开始发病后,采用 5级分级法进行病情调查,病级分级标准分别为0级:健株;1级:子叶出现病状;2级:1-2片真叶严重发病;3级:3片以上真叶表现病状;4级:植株生长点死亡或全株枯死[17];每隔3 d记录病情指数,
病情指数=[(1×1级发病株数)+(2×2级发病株数)+(3×3级发病株数)+(4×4级发病株数)]×100÷[总株数×4(即最高病级)]。
每个菌株重复3次,测量结果取3次的平均值,利用SPSS软件分析实验结果。
2 结果与分析
2.1 rDNA-ITS测序结果及序列分析
测序结果表明:8个菌株的rDNA-ITS区序列大小均为482 bp,相互之间的序列相似性为96.00%-99.45%。再将它们在NCBI数据库中进行比对,结果显示:8个菌株的序列均与大丽轮枝菌具有高的序列相似性,其中与登录号为EU835817.1的大丽轮枝菌的同源性达95.87%-98.69%。分子鉴定的结果表明:供试的8株菌株均为大丽轮枝菌(Verticillium dahlia)菌株。
2.2 不同寄主来源大丽轮枝菌在PDA上的培养性状
按照培养14d时微菌核的相对数量及菌落特性可将8个菌株在PDA平板上的培养性状分为2种类型(图 1 A):V592、V31、S1、S2和 S3菌株为菌核型,V30、Vnu和Vtr菌株为中间型。5个菌核型菌株中,V592和V31菌株菌落形态相似,黑色菌落边缘具明显的白色圆环,中央分布极少的气生菌丝;其它3个菌株虽然都产生大量微菌核,但菌丝分布却不相同,S1菌株产生少量辐射状菌丝,在菌落中间形成明显的灰白色凸起;S2菌株产生少量絮状菌丝,均匀分布;S3菌株也产生少量絮状菌丝,但集中于菌落中间。3个中间型菌株中,V30菌株产生放射状分布的微菌核,菌落中间有少量灰白色菌丝。Vnu和Vtr菌株只能从平板背面才能观察到黑色微菌核,Vnu菌株的菌丝发达,白色绒毛状,蓬松凸起;Vtr菌株的菌丝也很发达,白色匍匐状,无明显凸起。另外,8个菌株的菌落生长速度也存在明显差异(图1 A,图1 B),S3菌株的平均生长速度最慢,其次是Vnu菌株,Vtr菌株的平均生长速度最快,因此培养20 d时S3菌株形成的菌落最小,Vtr菌株形成的菌落最大。由此表明,不同寄主来源的大丽轮枝菌在PDA培养基上的培养性状具有明显差异,并且来自同一种寄主(茄子)的不同菌株(V31、S3和V30)培养性状也具有明显差异。
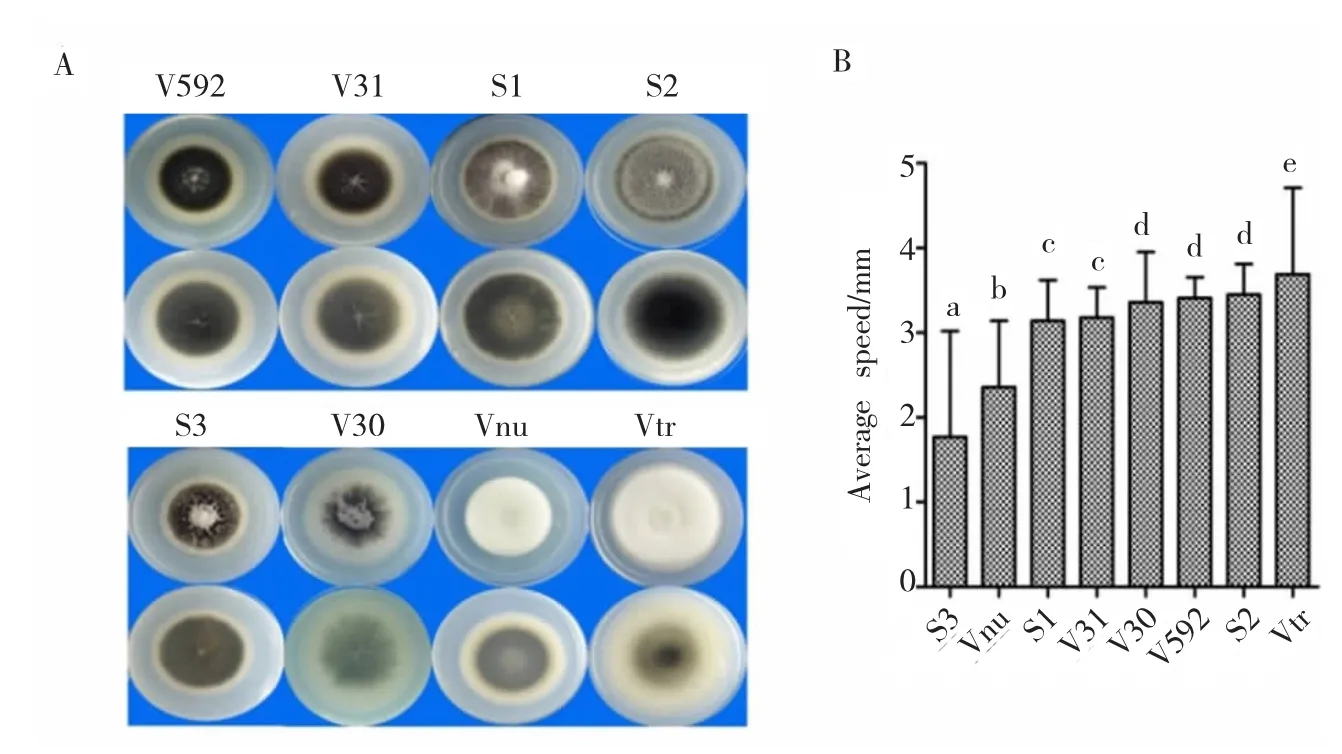
图1 不同寄主来源的大丽轮枝菌在PDA培养基上的培养性状Fig.1 Cultural characteristics of V.dahliae strains from different plants on PDA media
2.3 不同寄主来源大丽轮枝菌产孢量和孢子萌发率的测定结果
由图2可知:所有供试菌株的产孢量随着培养时间的延长而逐渐增加,从第4 d起各菌株产孢量开始表现差异,其中Vnu菌株的产孢量显著高于其它菌株的产孢量。第7 d时,Vnu菌株的产孢量最大,孢子浓度高达105.45×106cfu/mL,其次是V592菌株,孢子浓度为78.95×106cfu/mL,Vtr菌株的产孢量最低,孢子浓度是61.23×106cfu/mL。
分生孢子萌发率的测定结果显示:不同菌株的孢子萌发率达到最大值的时间存在差异(图3 A),S3、V31和Vnu菌株在第3 d时孢子萌发率最大,而V592、S1、V30和Vtr菌株则在第5 d时孢子萌发率最大;S2菌株由于孢子萌发率低,第7 d时孢子萌发率仍处于持续增长阶段,表现为第7 d时萌发率最大。比较各菌株分生孢子的平均萌发率(图3 B)可知:各菌株之间也存在差异,Vnu菌株的孢子萌发率最高,其次是V31、S3和V592,S2菌株的孢子萌发率最低。不同菌株在产孢量和孢子萌发率方面存在差异,表明不同寄主来源大丽轮枝菌具有不同的繁殖力。
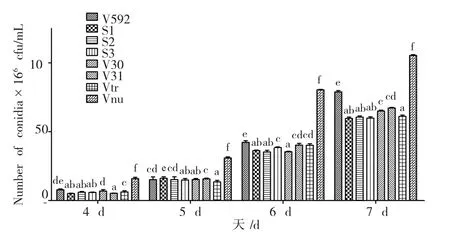
图2 不同寄主来源的大丽轮枝菌菌株的产孢量Fig.2 Sporulation quantity of V.dahliae strains from different palnts
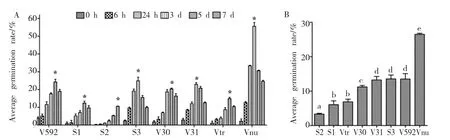
图3 不同寄主来源大丽轮枝菌菌株的分生孢子的萌发率Fig.3 Germination rate of conidia of V.dahliae strains from different plants
2.4 碳源和氮源对大丽轮枝菌培养性状的影响
2.4.1 碳源对不同寄主来源大丽轮枝菌培养性状的影响
以察氏培养基为基础,分别用葡萄糖、麦芽糖和甘油取代察氏培养基中的蔗糖充当碳源,比较不同菌株对无机碳及有机碳的利用情况。从菌落的生长情况看,8个菌株在4种碳源培养基上都能生长,表明对4种碳源都能利用。比较菌落形态,S2、S3和V30在蔗糖、葡萄糖和麦芽糖培养基上产生的微菌核量明显多于在甘油培养基上的量(图4);S1在葡萄糖和麦芽糖培养基上形成的菌落形态不同于在蔗糖和甘油培养基上的菌落形态(图4),说明不同的碳源种类对大丽轮枝菌生长发育具有不同的影响作用。比较菌落直径,在4种碳源培养基上,Vtr菌株形成的菌落直径最大,其次是Vnu和V592菌株,S1形成的菌落直径最小(图4,图5),说明Vtr对4种碳源的利用明显优于其它菌株,S1对4种碳源的利用能力最差。
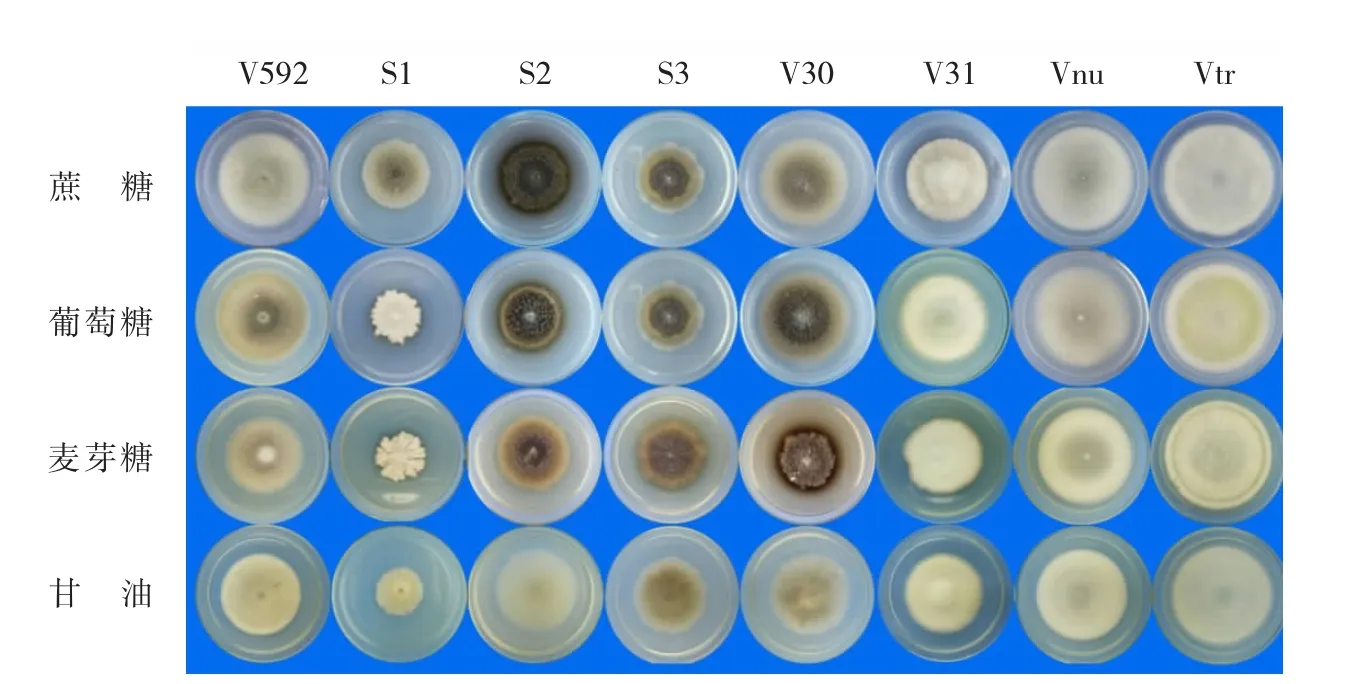
图4 不同寄主来源的大丽轮枝菌在4种碳源培养基上的培养性状Fig.4 Cultural characteristics of V.dahliae strains from different plants on four kinds of carbon media
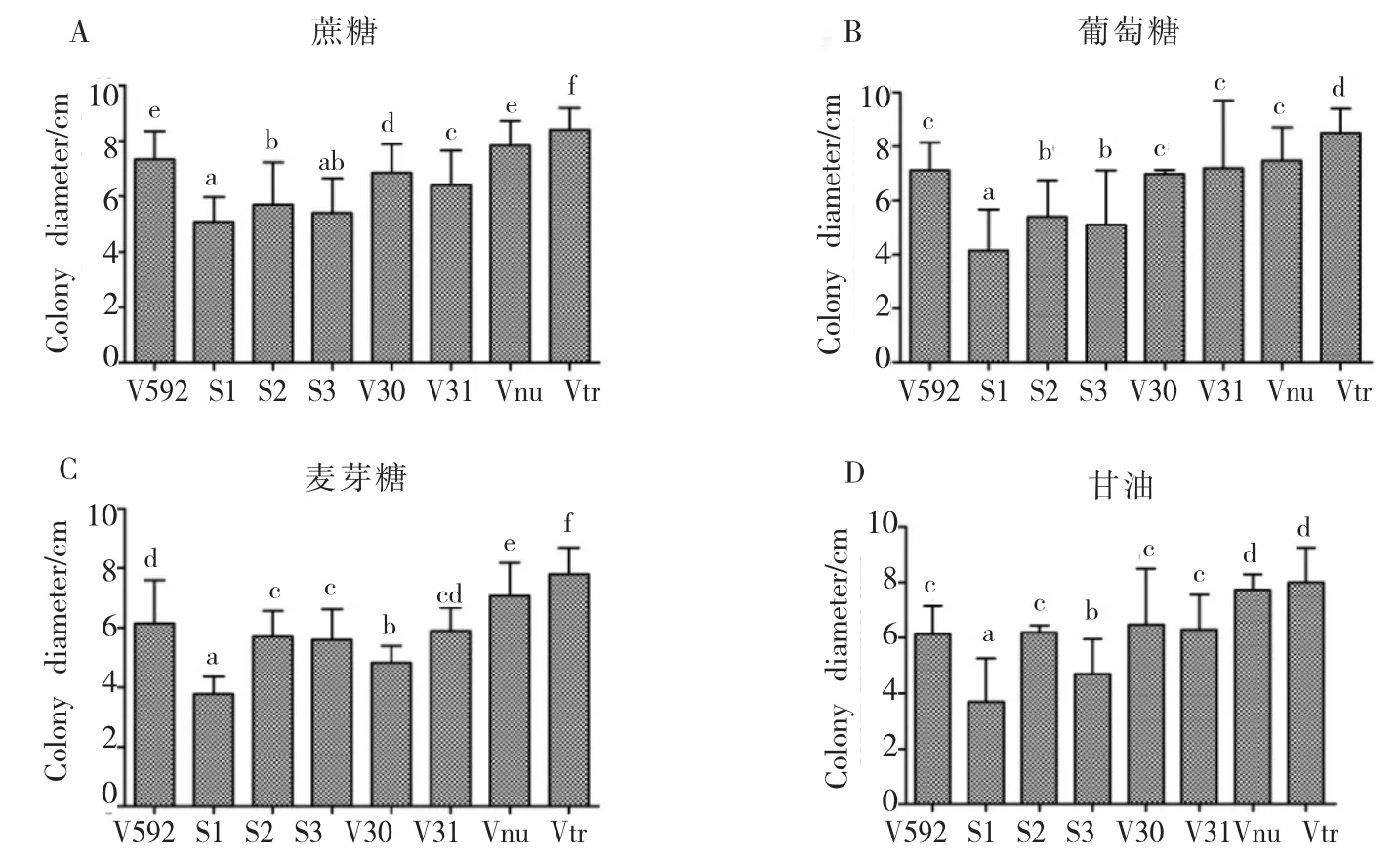
图5 不同寄主来源的大丽轮枝菌在4种碳源培养基上的菌落直径Fig.5 Colony diameters of V.dahliae strains from different plants on four kinds of Carbon media
上述结果表明:不同寄主来源的大丽轮枝菌对不同碳源的利用存在明显差异。
2.4.2 氮源对不同寄主来源大丽轮枝菌培养性状的影响
以察氏培养基为基础,用蛋白胨、氯化铵和硫酸铵代替察氏培养基中的硝酸钠充当氮源,比较不同菌株对无机氮及有机氮的利用情况。从菌落的生长情况看,8个菌株在4种培养基上都能生长,表明对4种氮源都能利用(图6)。Vtr菌株在4种氮源培养基上形成的菌落直径均明显大于其它菌株的菌落直径(图 6,图 7),表明Vtr对 4种氮源的利用明显优于其它菌株。S2菌株以硝酸钠和蛋白胨为氮源时产生大量均匀分布的黑色微菌核,而以氯化铵和硫化铵为氮源时只在菌落中心产生极少的微菌核(图6);Vnu菌株以硝酸钠和蛋白胨为氮源时产生的菌落直径明显大于以氯化铵和硫化铵为氮源时的直径(图6),表明S2和Vnu菌株对不同氮源的利用存在明显差异。另外,在同一种氮源培养基上菌株之间也存在明显差异,如在蛋白胨培养基上,V592、S2、V30和V31都能产生微菌核,但产生的菌核量及菌落形态明显不同;S1、S3、Vnu和 Vtr菌株不能产生微菌核,但菌落表面的气生菌丝却呈现完全不同的分布(图 6)。
综合上述结果表明:不同寄主来源的大丽轮枝菌对不同氮源的利用存在显著差异。
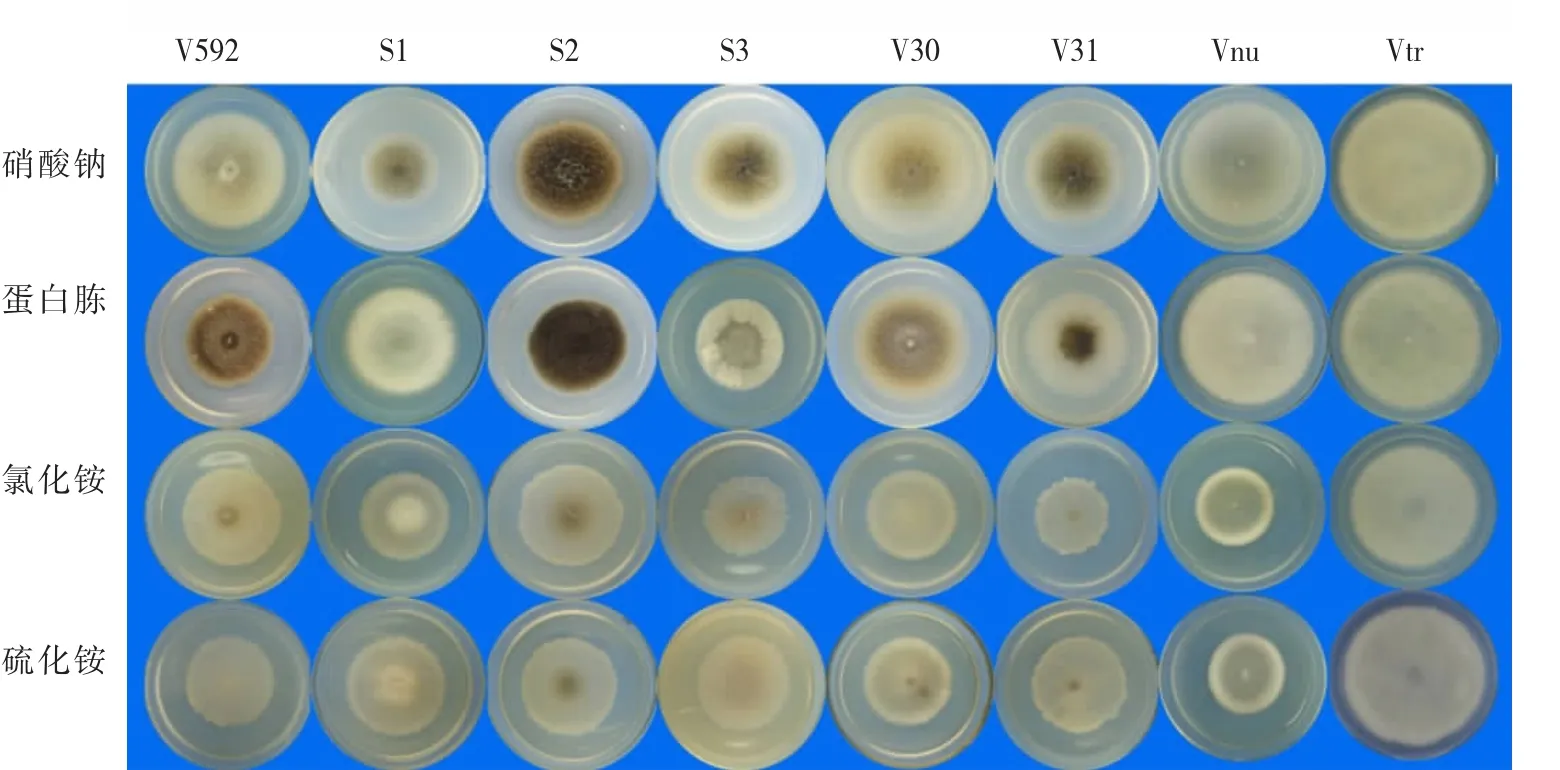
图6 不同寄主来源的大丽轮枝菌在4种氮源培养基上的培养性状Fig.6 Cultural characteristics of V.dahliae strains from different plants on four kinds of nitrogen media
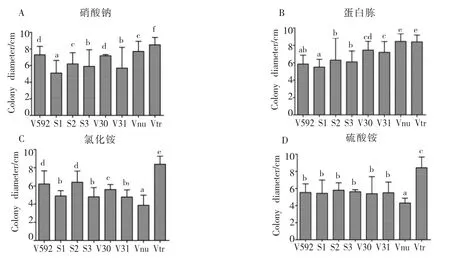
图7 不同寄主来源的大丽轮枝菌在4种氮源培养基上的菌落直径Fig.7 Colony diameters of V.dahliae strains from different plants on four kinds of nitrogen media
2.5 致病类型的分子生物学检测
2.5.1 落叶型和非落叶型致病类型的PCR鉴定
以棉花黄萎病菌落叶型菌株V592和非落叶型菌株S4做对照,分别利用落叶型和非落叶型特异引物对不同寄主来源的大丽轮枝菌进行了致病类型的PCR鉴定,结果(图8)显示:利用落叶型特异引物可从向日葵上的S1菌株、马铃薯上的S2菌株、茄子上的S3菌株上扩增到约500 bp的目标条带(图8 A),表明S1、S2、S3与V592一样是落叶型菌株;用非落叶型特异引物可从茄子上的V30和V31菌株上扩增到了约1500 bp的目标条带(图8 B),表明V30、V31与S4一样是非落叶型菌株。Vnu和Vtr菌株用2对引物都不能扩增到相应的目标条带。因此可以得出:除棉花黄萎病菌外,向日葵、马铃薯和茄子上的大丽轮枝菌也可以用落叶型和非落叶型进行致病类型的划分。

图8 不同寄主来源大丽轮枝菌致病类型的PCR鉴定Fig.8 Identification of pathotype of V.dahliae strains from different plants by PCR
2.5.2 生理小种的PCR鉴定
生理小种的鉴定结果如图9所示。
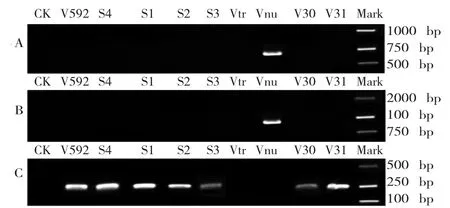
图9 不同寄主来源大丽轮枝菌生理小种的PCR鉴定Fig.9 Identification of physiological race of V.dahliae strains from different plants by PCR
由图9可知:
实验所用的厚萼凌霄种子取自江苏省连云港境内。选取的种子均发育良好、籽粒饱满。实验所用的海水取自连云港周边海域,海水盐度为27.3%。
用2对1号小种的特异引物只能从红花上的Vnu菌株中分别扩增到680 bp和 900 bp的目标条带(图9 A和9 B);用2号小种的特异引物可以从 V592、S4、S1、S2、S3、V30 和 V31 菌株中扩增到约250 bp的目标条带(图9 C);而 Vtr菌株分别用3对引物均扩增不到相应的目标条带。
PCR鉴定结果表明Vnu菌株为1号生理小种,V592、S4、S1、S2、S3、V30 和 V31 为 2 号生理小种,Vtr菌株不能用该方法鉴定致病型。
2.6 不同寄主来源的大丽轮枝菌对棉花的致病力测定
以棉花黄萎病菌落叶型菌株V592为对照,将不同寄主来源的大丽轮枝菌分别接种棉花并测定其致病力,结果(图 10,11)显示:
(1)与对照V592一样,S2和S3菌株接种后15 d开始表现萎蔫症状,但是发病后的病情指数显著高于 V592(图 10)。接种 25 d时(图 10),V592菌株表现萎蔫的叶片增多,病情指数为34.4;S3菌株导致病株萎蔫、叶片脱落,病情指数达86.5;S2菌株导致叶片脱落、整株死亡,病情指数达100。这说明S2和S3菌株对棉花的致病力比棉花黄萎病菌V592强。
(2)与对照V592相比,其它5个菌株接种棉花后发病明显延迟,V30菌株在接种23 d后病株才表现萎蔫症状,V31、Vtr、Vnu和 S1菌株直到接种 25d时植株才开始表现萎蔫症状(图11);接种35 d时调查病情指数,V592的病指已达93.2,而其它5个菌株导致发病的病指范围是21.0-37.3(图11)。这说明其它 5 个大丽轮枝菌 (V30、V31、Vtr、Vnu 和S1)对棉花的致病力明显比棉花黄萎病菌V592弱。
(3)上述致病力测定结果表明:不同寄主来源大丽轮枝菌对棉花的致病力具有显著差异。
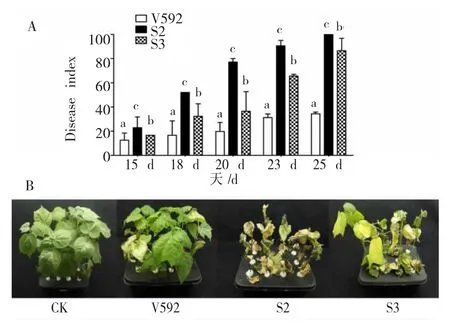
图10 不同寄主来源大丽轮枝菌对棉花致病力的测定Fig.10 Pathogenicity of V.dahliae strains from different plants on cotton seedlings
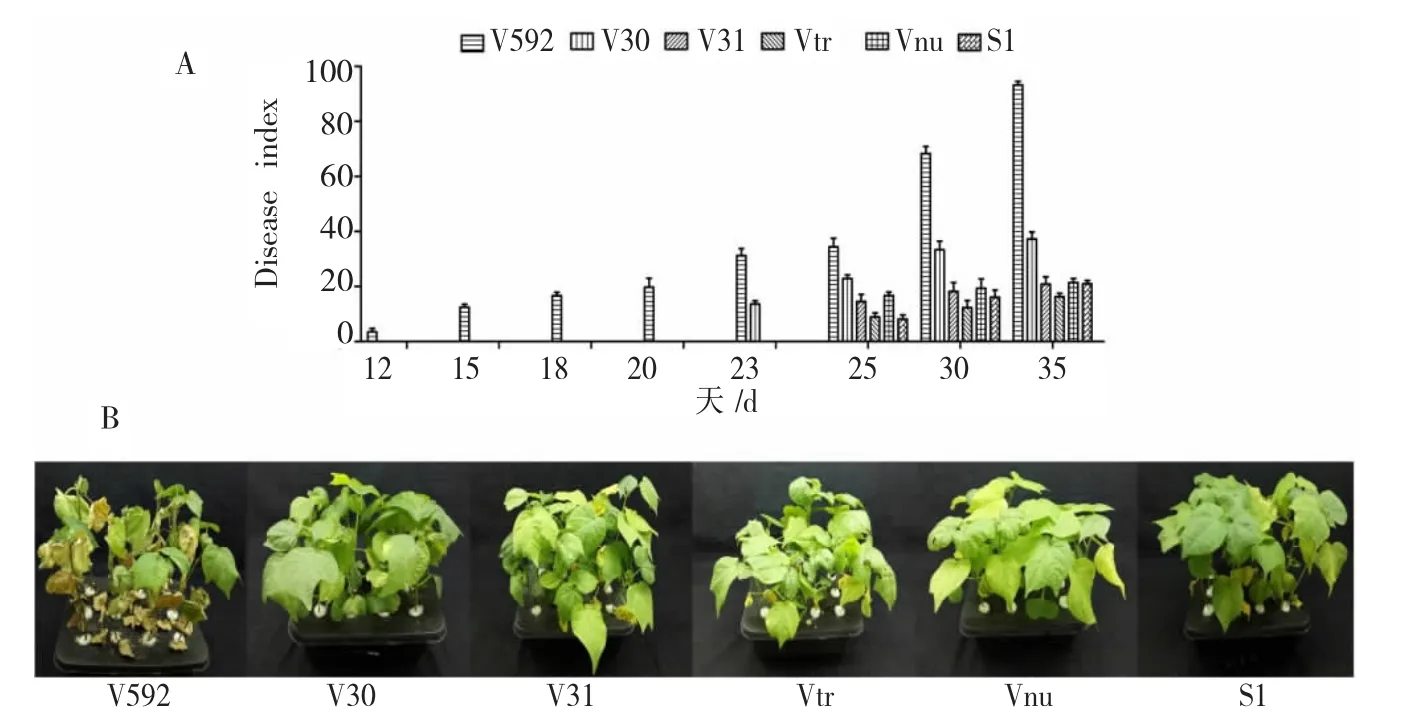
图11 不同寄主来源大丽轮枝菌对棉花的致病力的测定Fig.11 Pathogenicity of V.dahliae strains from different plants on cotton seedlings
3 结论与讨论
(1)本文研究结果表明,8个不同寄主来源的大丽轮枝菌在PDA上的培养性状存在明显差异,这种差异不仅表现在不同寄主的菌株之间,也表现在同一种寄主的菌株之间,来自茄子的S3和V31产生菌核型菌落,而V30产生中间型菌落;喻秀秀等[18]将茄子上的10株大丽轮枝菌在PDA上的培养性状分为菌核型、菌丝型和中间型3种,研究结果表明同一种寄主来源的大丽轮枝菌培养性状存在变异,与本研究结果一致,朱荷琴[4]也得出同一寄主来源的棉花大丽轮枝菌在 PDA上的培养性状存在5个类型。因此,不同寄主或同一种寄主来源的大丽轮枝菌,其培养性状存在多样性可能与大丽轮枝菌与各自的寄主种类或品种长期适应所形成的营养要求有关。
(2)产孢量和孢子萌发率测定结果显示来自红花的Vnu菌株产孢量和孢子萌发率都明显高于其它菌株,具有最强的繁殖力,其它菌株的产孢量和孢子萌发率之间虽然没有相关性,但菌株之间在产孢量和孢子萌发率方面具有显著差异,表明菌株之间具有不同的繁殖力。
(3)本文研究结果表明,不同寄主来源的大丽轮枝菌具有不同的营养需求,这种营养需求的差异是否与寄主选择有关还有待深入研究。黄薇等[19]研究表明不同钾钠比的察氏培养基明显影响大丽轮枝菌的菌核产量和致病力,而本研究用氯化铵和硫酸铵代替察氏培养基中的硝酸钠充当氮源时,所有菌株在氯化铵和硫化铵培养基上都不形成黑色微菌核,该现象产生是否与培养基中缺乏钠离子有关还需要进一步明确。
(4)除红花上的Vnu和番茄上的Vtr菌株外,来自棉花、向日葵、马铃薯和茄子上的7个菌株都可以用落叶型和非落叶型进行致病类型的划分。茄子上的S3为落叶型菌株,V30和V31为非落叶型菌株,这与江苏茄子上的鉴定结果不一致,喻秀秀等的检测结果显示江苏茄子上的所有大丽轮枝菌均为非落叶型菌株[18],没有落叶型菌株,因此对茄子大丽轮枝菌致病型的鉴定还需要在全国范围内采集更多的茄子黄萎病菌进行确定。
(5)红花上的Vnu菌株为1号生理小种,表明该菌株基因组含有无毒基因Ave1,因此对于该类病原最有效的防治方法就是利用和培育含Ve1抗病基因的品种[9];棉花、向日葵、马铃薯和茄子上的7个菌株均为2号生理小种,表明这些菌株的基因组中都没有无毒基因Ave1,这与刘琳琳和喻秀秀等对于棉花大丽轮枝菌和茄子大丽轮枝菌的研究结果一致[18,20]。
本研究发现,只有鉴定为2号生理小种的菌株才可以进一步划分为落叶型和非落叶型,该结论是否具有普遍性还需要更多菌株的验证。对于番茄大丽轮枝菌,根据是否介导含Ve1基因的番茄产生抗性分为1号生理小种和2号生理小种,只有1号小种含有Ave1基因[9],而本研究发现番茄上的Vtr菌株用2种分子检测方法都不能进行鉴定,既不属于落叶型和非落叶型,也不能确定生理小种,其致病类型如何划分还需进一步研究。
(6)本文研究结果显示,马铃薯上的S2菌株和茄子上的S3菌株对棉花的致病力明显比棉花黄萎病菌V592强,而其它菌株对棉花的致病力明显比V592弱,且延迟发病;喻秀秀等[18]也发现茄子上分离的大丽轮枝菌对棉花的致病力强于棉花黄萎病菌。
大丽轮枝菌寄主范围广泛,在进行作物布局和轮作时应考虑此类致病力加重的问题。
(7)有研究表明,棉花黄萎病菌的培养类型、致病类型与其致病力没有相关性[18]。本研究结果也表明,不同寄主来源的大丽轮枝菌的培养类型、致病类型与其致病力没有相关性。

