内质网应激在大鼠低氧高二氧化碳性肺动脉高压中的作用*
张晶晶, CHEN Jun-hao, 赵美平, 武垣伶, 张聪聪, 应 磊, 陈锡文, 王万铁△
(1. 温州医科大学病理生理学教研室, 浙江 温州 325035; 2. School of Biomedical Sciences, University of Western Australia, Perth 6000, Australia; 3. 温州医科大学实验动物中心, 浙江 温州 325035)
肺动脉高压(pulmonary artery hypertension,PAH)是一种肺血管选择性重塑疾病,预后极差。肺血管壁内的细胞,包括肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs),具有增殖和凋亡的特点,可引起肺动脉重塑,堵塞血管腔,导致右心衰竭和过早死亡。触发或促进PAH过程的一个共同特征是内质网应激(endoplasmic reticulum stress,ERS)[1]。CHOP、JNK和caspase-12是与ERS通路相关的三个主要凋亡基因,而GRP78的急速上调被认为是内质网应激最敏感的标志[2]。有研究表明[3],内质网功能受缺氧的影响引起ERS,导致肺动脉高压,但其是否参与低氧高二氧化碳性肺动脉高压的发生、发展,目前尚未见研究报道。本研究将4-苯基丁酸(4-phenylbutyric acid,4-PBA)和衣霉素(tunicamycin,TM)分别作为内质网应激反应的抑制剂和激动剂,用来干预低氧高二氧化碳性肺动脉高压模型,探讨ERS通路在低氧高二氧化碳性肺动脉高压中的作用及其机制,以期为肺动脉高压的治疗提供理论依据。
1 材料与方法
1.1 实验动物
健康Sprague-Dawley(SD)雄性大鼠40只,清洁级,体重(200±20)g,由温州医科大学动物实验中心提供,动物使用许可证号:SCXK(浙)2015-0009。
1.2 试剂和仪器
4-PBA,TM(Sigma,美国),逆转录试剂盒(Thermo,美国),兔抗大鼠GRP78抗体,兔抗大鼠JNK抗体,兔抗大鼠p-JNK抗体,兔抗大鼠caspase-12抗体(Abcam,英国),小鼠抗大鼠CHOP抗体(CST,美国),RT-PCR引物(上海捷瑞生物工程有限公司)。Power Lab生物信息采集系统(AD Instruments,澳大利亚),PE导管(0.90 mm×0.50 mm,澳大利亚),真空冷冻干燥机,高速冷冻离心机,多功能酶标仪(Thermo,美国),显微镜(Nikon,日本),紫外分光光度计(Ultrospec 2100pro Amersham BioSciences,美国),PCR热循环仪(LifePro,杭州博日科技有限公司),电热恒温水温箱(上海贺德试验设备厂),雪花制冰机(北京长流科学仪器公司),UV-800全自动凝胶成像分析系统(温州奥利生物医学仪器厂),蛋白电泳/转膜仪(Bio-Rad,美国)。
1.3 实验分组及模型的制备
将40只清洁级SD大鼠随机分为四组,即常氧对照组(N)、低氧高二氧化碳组(HH)、ERS抑制剂组(4-PBA)、ERS激动剂组(TM),n=10。N组置于常氧环境下饲养。HH组、4-PBA组、TM组按参考文献[3]方法制备低O2高CO2模型,三组大鼠均置于常压低氧高二氧化碳氧舱中,舱内氧浓度维持在9%~11%,二氧化碳浓度维持在5%~6%(舱内水蒸气用无水CaCl2吸收,二氧化碳用氢氧化钙吸收),每天暴露8 h,每周6 d,饲养4周。4-PBA组大鼠在进舱前半小时腹腔注射用生理盐水溶解的4-PBA,用量为80 mg/kg,每周6次,共4周。TM组进舱前半小时腹腔注射用生理盐水稀释的TM,用量为0.08 mg/kg,每周2次,共4周。HH组进舱前半小时腹腔注射等量的生理盐水。其他饲养条件各组均相同。
1.4 大鼠肺动脉平均压、颈动脉平均压和右心室肥大指数的测定
4周后,用10%水合氯醛(0.35 ml/100 g)麻醉大鼠,利用Power Lab生物信息采集系统采用右心导管法检测大鼠肺动脉平均压(mean pulmonary artery pressure,mPAP)和颈动脉平均压(mean carotid artery pressure,mCAP)。然后用生理盐水灌洗大鼠,剪下大鼠心脏及肺,分离大鼠右心室游离壁;称取右心室游离壁重量(RV)及左心室加心室间隔重量(LV+S),按下式计算右心室肥大指数(right ventricular hypertrophy index,RVHI):RVHI=RV/(LV+S),用于判断右心室肥厚程度。
1.5 免疫荧光α-SMA标记法鉴定大鼠肺中小动脉平滑肌细胞
取各组大鼠右肺中叶,用4%多聚甲醛固定,石蜡包埋切片(厚度约4 μm),采用免疫荧光法观察肺中小动脉平滑肌细胞α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)的表达。加兔抗大鼠α-SMA单克隆抗体(稀释1∶100)在4℃孵育过夜,用TRITC标记的二抗(稀释1∶100)在37℃避光孵育30 min,荧光显微镜下观察外径(30~150) μm的中小动脉并拍片。
1.6 电镜观察肺组织及肺中小动脉形态学变化
大鼠灌注后迅速取出肺组织,置于蜡板上,滴加2.5%戊二醛固定液,各大鼠随机留取右上肺靠近肺门处1 mm×1 mm×1 mm大小的肺组织4~6片,再浸入2.5%戊二醛固定液中置4℃冰箱内固定2 h以上,依次经1%锇酸后固定,1%醋酸铀块染,丙酮梯度脱水,Epon812环氧树脂包埋剂包埋聚合,半薄切片光镜定位于肺中小动脉并超薄切片,经醋酸铀-柠檬酸铅双重染色,H-7500透射电镜下观察并拍照。
1.7 原位末端标记法(TUNEL)检测肺动脉平滑肌细胞的凋亡指数
采用原位末端标记法(TUNEL)检测肺动脉平滑肌细胞的凋亡情况,实验按试剂盒说明书进行。光学显微镜下正常肺动脉平滑肌细胞的胞核呈蓝色,凋亡肺动脉平滑肌细胞的胞核呈棕褐色。每组随机取5张切片,每张切片随机取5个视野,计数阳性细胞和阴性细胞数。凋亡指数(apoptotic index,AI)=肺动脉中的阳性细胞数/总细胞数×100%。
1.8 RT-PCR检测大鼠ERS相关mRNA表达
将大鼠肺组织充分匀浆,采用Trizol法提取总RNA,测吸光度(A)值,计算RNA浓度,按照逆转录试剂盒说明书合成cDNA,PCR扩增反应:(1)GRP78:上游引物5’-GGCGTGAGGTAGAAAAGG-3’,下游引物5’-ATGGTAGAGCGGAACAGG-3’(产物为151 bp);(2)JNK:上游引物5’-GATTCTTGATTTTGGACTGG-3’,下游引物5’-TGACCTCTGGTGCTCTGT-3’ (产物为92 bp);(3)caspase-12:上游引物5’-CCACAAGCAAAGGGATAG-3’,下游引物5’-GGAAATGAAGAGAGAGCCA -3’ (产物为173 bp);(4)CHOP:上游引物5’-AGCAGAGGTCACAAGCACCT-3’,下游引物5’-CTCCTTCATGCGCTGTTTCC-3’(产物为157 bp);(5)β-actin:上游引物5’-CGTTGACATCCGTAAAGAC-3’,下游引物5’-TGGAAGGTGGACAGTGAG -3’(产物为201 bp)。扩增后电泳,用UV-800全自动凝胶成像分析系统曝光成像,Quantity One软件分析电泳条带灰度值,用目的基因与β-actin基因灰度值之比表示目的基因的表达水平。
1.9 Western blot检测大鼠ERS相关蛋白质表达
将大鼠肺组织充分匀浆,裂解30 min后,12 000 r/min、4℃离心10 min,吸取上清,BCA法测定蛋白质浓度。以10%胶浓度作SDS-PAGE分离,湿式电转移法转移至PVDF膜,5%脱脂奶粉封闭。用一抗稀释液稀释抗GRP78抗体(1∶1 000)、抗caspase-12抗体(1∶1 000)、抗p-JNK抗体(1∶1 000)、抗JNK抗体(1∶2 000)、抗CHOP抗体(1∶1 000),抗GAPDH抗体(1∶5 000),4℃孵育过夜。GRP78、caspase-12、p-JNK、JNK和GAPDH用山羊抗兔IgG,CHOP用山羊抗小鼠IgG室温孵育1 h,所用二抗稀释比例均为1∶10 000。ECL化学发光法显色后,于曝光仪曝光并保存。用Quantity One软件分析条带灰度值,GRP78、caspase-12、CHOP用目的蛋白与GAPDH蛋白质灰度值之比表示目的蛋白的表达水平,JNK用目的蛋白与p-JNK蛋白质灰度值之比表示目的蛋白的表达水平。
1.10 统计学处理
2 结果
2.1 各组大鼠肺动脉平均压、颈动脉平均压及右心室肥大指数的比较
与N组相比,HH组、4-PBA组、TM组肺动脉平均压和右心室肥大指数均明显上升(P<0.01)。与HH组相比,4-PBA组肺动脉平均压与右心室肥大指数降低(P<0.01);TM组肺动脉平均压和右心室肥大指数升高(P<0.05,P<0.01)。各组颈动脉平均压力值无统计学差异(P>0.05,表1)。


GroupmPAP(mmHg)mCAP(mmHg)RV/(LV+S)(%)N15.37±1.65112.58±3.9424.09±1.89HH28.74±2.89**110.37±3.8532.89±2.28**4-PBA23.63±2.34**##111.31±3.2728.57±2.13**##TM31.88±4.63**#110.85±4.5135.66±1.97**##
mPAP: Mean pulmonary artery pressure; mCAP: Mean carotid artery pressure; RV: Weight of right ventricle; LV+S: Weight of left ventricle and septal; N: Normoxic control group; HH: Hypoxia hypercapnia group; 4-PBA: ERS pathway inhibitor 4-phenylbutyric acid group; TM: ERS pathway agonist tunicamycin group
**P<0.01vsN group;#P<0.05,##P<0.01vsHH group
2.2 各组大鼠肺中小动脉免疫荧光图
图中红色荧光标记的是肺动脉平滑肌细胞。与N组相比,HH组、4-PBA组、TM组肺动脉平滑肌细胞均有增殖,管壁厚度增大(WA/TA,P<0.01),管腔面积缩小(LA/TA,P<0.01);与HH组相比,ERS抑制剂4-PBA组肺动脉平滑肌细胞增殖被抑制,WA/TA值减小、LA/TA值增大(P<0.01);与HH组相比,ERS激动剂TM组肺动脉平滑肌层增厚,WA/TA值增大、LA/TA值减小(P<0.01,表2,图1,图1见彩图页Ⅲ)。


GroupWA/TA(%)LA/TA(%)N31.48±6.8368.52±6.83HH62.71±5.42**37.29±5.42**4-PBA47.96±5.31**##52.04±5.31**##TM78.16±4.64**##21.84±4.60**##
WA: Pulmonary artery wall area; TA: Total area of pulmonary artery; LA: Luminal area of pulmonary artery; N: Normoxic control group; HH: Hypoxia hypercapnia group; 4-PBA: ERS pathway inhibitor 4-phenylbutyric acid group; TM: ERS pathway agonist tunicamycin group
**P<0.01vsN group;##P<0.01vsHH group
2.3 各组大鼠肺组织透射电镜观察结果
电镜下,N组大鼠肺动脉基底膜上内皮细胞扁平紧紧粘附,微绒毛突起出现于细胞的游离面;平滑肌细胞胞体小,胞浆均匀,细胞器无异常。HH组大鼠肺动脉血管内皮细胞损伤明显,出现坏死脱落;平滑肌细胞肥厚,胞浆内可见大量空泡、线粒体和内质网肿胀。4-PBA组大鼠肺动脉内皮细胞肿胀,微绒毛消失,细胞向血管腔内突起,空泡减少,线粒体及内质网有少许肿胀,平滑肌细胞处于收缩表型;TM组大鼠肺动脉血管内皮细胞脱落明显,肺泡间隔的血管壁内可见成肌纤维细胞增殖(图2)。
2.4 TUNEL鉴定肺动脉平滑肌细胞凋亡情况
HH组大鼠肺动脉平滑肌凋亡指数(50.25%±6.18%)较N组降低(61.75%±6.17%,P<0.01);ERS抑制剂4-PBA组凋亡指数(55.49%±6.46%)较N组降低(P<0.05),较HH组升高(P<0.05);ERS激动剂TM组凋亡指数(38.77%±5.87%)较N组和HH组均显著降低(P<0.01,图3,见彩图页Ⅲ)。
2.5 各组大鼠肺组织GRP78、JNK、caspase-12、CHOP mRNA表达的比较
与N组相比,HH组、4-PBA组和TM组各ERS相关因子GRP78、JNK、caspase-12、CHOP mRNA的表达量均升高(P<0.05或P<0.01)。与HH组相比,4-PBA组JNK、caspase-12、CHOP mRNA的表达量轻微下调(P<0.05),GRP78 mRNA的表达量明显下调(P<0.01)。与HH组相比,TM组JNK、caspase-12、CHOP mRNA的表达量轻微上调(P<0.05),GRP78 mRNA表达量明显上调(P<0.01,表3,图4)。
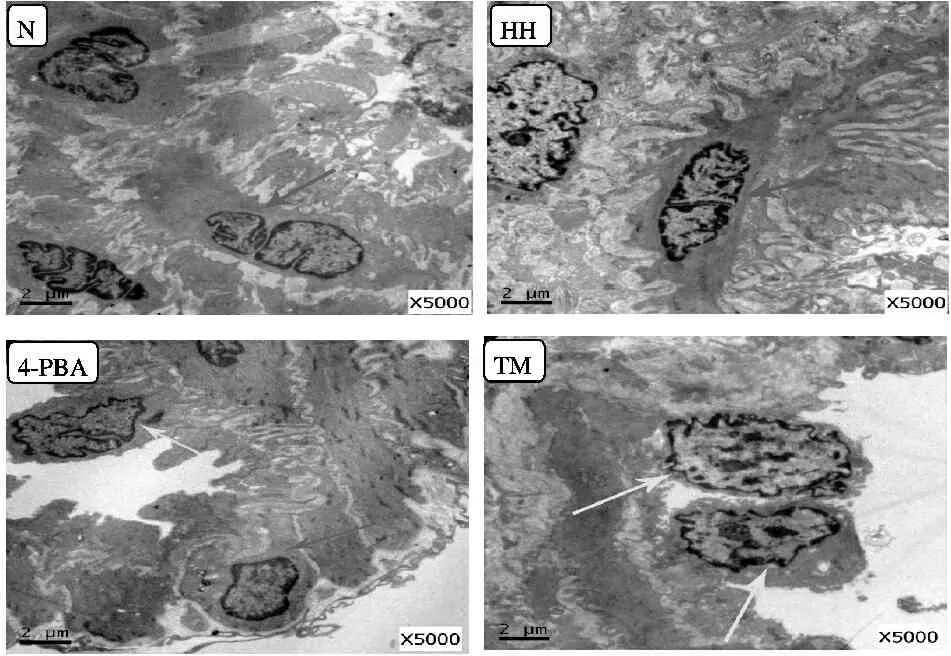
Fig.2Observation of lung tissue in each group by transmission electron microscopy(×5 000)
N: Normoxic control group; HH: Hypoxia hypercapnia group; 4-PBA: ERS pathway inhibitor 4-phenylbutyric acid group; TM: ERS pathway agonist tunicamycin group
The black arrows point to smooth muscle cells and the white arrows point to the endothelial cells

Fig.4The expression level of GRP78, JNK, caspase-12 and CHOP mRNA among the 4 groups
N: Normoxic control group; HH: Hypoxia hypercapnia group; 4-PBA: ERS pathway inhibitor 4-phenylbutyric acid group; TM: ERS pathway agonist tunicamycin group
2.6 各组大鼠肺组织GRP78、JNK、caspase-12、CHOP 蛋白质表达水平的比较
与N组相比,HH组、4-PBA组和TM组各ERS相关蛋白GRP78、JNK、caspase-12、CHOP蛋白质表达量均升高,各差值均有统计学意义。与HH组相比,4-PBA组GRP78、JNK、caspase-12、CHOP蛋白质表达量均降低(P<0.05);与HH组相比,TM组JNK、caspase-12蛋白质表达量增加(P<0.05),CHOP蛋白质的表达量明显增加(P<0.01),GRP78蛋白质的表达量无明显变化(P>0.05,表4,图5)。
3 讨论
研究证实,ERS在PAH发病中起着重要作用。炎症、病毒感染、缺氧、BMPRII的功能丧失、突变和由此导致的蛋白质运输功能障碍等均可引起内质网应激,导致PAH[4-5]。Wu等[6]报道,野百合碱诱发的肺动脉高压伴随着蛋白激酶R样内质网激酶(protein kinase RNA-like endoplasmic reticulum kinase,PERK)、转录激活因子6(activating transcription factor 6,ATF6)、GRP78等ERS相关基因活化,表明在PAH发生过程中ERS被激活,提示肺动脉重塑细胞增殖与凋亡失衡可能与ERS紊乱有关。建立慢性低氧诱导肺动脉高压动物模型的方法已十分成熟,但临床上PAH患者和/或PAH并发症患者通常伴随肺泡和血液中二氧化碳分压升高,因此,吸入低氧伴高二氧化碳混合气体制备肺动脉高压动物模型更符合临床患者的发病情况。本实验采用5%~6% CO2和9%~11% O2的混合气体造模,结果显示大鼠在静息状态下肺动脉平均压、右心室肥大指数均不同程度升高,肺动脉平滑肌细胞增殖,肺动脉管壁增厚、管腔狭窄,表明低氧高二氧化碳诱导的肺动脉高压模型已复制成功。

Tab. 3 The comparison of the expression of GRP78, JNK, caspase-12 and CHOP mRNA among the 4 groups ±s, n=10)
N: Normoxic control group; HH: Hypoxia hypercapnia group; 4-PBA: ERS pathway inhibitor 4-phenylbutyric acid group; TM: ERS pathway agonist tunicamycin group
*P<0.05,**P<0.01vsN group;#P<0.05,##P<0.01vsHH group

Tab. 4 The comparison of the expression of GRP78, JNK, caspase-12 and CHOP protein among the 4 groups ±s, n=10)
N: Normoxic control group; HH: Hypoxia hypercapnia group; 4-PBA: ERS pathway inhibitor 4-phenylbutyric acid group; TM: ERS pathway agonist tunicamycin group
*P<0.05,**P<0.01vsN group;#P<0.05,##P<0.01vsHH group

Fig.5The expression level of GRP78, JNK, caspase-12 and CHOP protein among the 4 groups
N: Normoxic control group; HH: Hypoxia hypercapnia group; 4-PBA: ERS pathway inhibitor 4-phenylbutyric acid group; TM: ERS pathway agonist tunicamycin group
我们使用4-PBA作为抑制ERS的化学分子伴侣,目前尚不清楚4-PBA如何协调其保护作用及对参与细胞应激反应的关键信号通路的影响,但是4-PBA减弱各组织中ERS的功效已被广泛证实[7]。N-糖基化是跨膜糖蛋白成熟过程中的一个高度调控和关键步骤。TM是一种核苷类抗生素,抑制细胞中N-寡聚糖生物合成的第一步,导致糖蛋白不折叠,并引起错误或未折叠的糖蛋白在内质网上聚集,导致ER应激诱导和细胞凋亡[8]。先前有报告显示,破坏N-糖基化可以降低酪氨酸激酶受体和下游信号通路的蛋白质水平[9],提示用TM抑制N-糖基化是一种替代的机械方法以减少致癌信号和治疗性抵抗。本实验采用TM作为ERS激动剂,4-PBA作为ERS抑制剂,在模型大鼠上的用量以参考参考文献[10-11]为主,预实验用量探索为辅,取得较好实验效果。
本研究应用免疫荧光、电镜和TUNEL等观察低氧高二氧化碳诱导的肺动脉高压肺血管重塑情况,结合各组WA/TA值与LA/TA值、电镜观察结果及凋亡指数分析,提示低氧高二氧化碳诱导的肺动脉高压肺血管重塑可能与肺动脉平滑肌细胞增殖过度及凋亡过少有关,且ERS通路参与了肺血管重塑。本实验研究了ERS通路在低氧高二氧化碳性肺动脉高压大鼠的调控作用,结果显示在低氧高二氧化碳环境中ERS相关蛋白质及mRNA(GRP78、JNK、caspase-12和CHOP)的表达都明显升高(P<0.01),应用ERS抑制剂4-PBA后,这些蛋白质及mRNA的表达量都相应降低,差异具有统计学意义。应用ERS激动剂TM后,JNK、CHOP、caspase-12蛋白质及mRNA表达水平较HH组升高(P<0.05),GRP78蛋白质表达水平与HH组无明显差异。在多细胞真核生物中,内质网应激是由PERK、ATF6和肌醇依赖酶1α(inositol-requiring enzyme 1α,IRE1α)这三个上游信号蛋白感受,然后开始一连串的纠正行动。这三条通路活动共同构成了未折叠蛋白质应答(unfolded protein response,UPR)。在正常情况下,IRE1α与PERK及免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein, Bip)/GRP78复合体结合,处于无活性状态;应激状态发生时,未折叠蛋白和/或错误折叠蛋白在内质网腔内积聚,3种跨膜蛋白与Bip/GRP78分离而被激活。GRP78的急速上调标志着ERS的开始,GRP78作为内质网分子伴侣之一调节着内质网蛋白折叠、促进细胞存活[12]。GRP78的上调可保护宿主细胞免受细胞外毒性因子所致的内质网应激。然而,研究表明内质网应激或细胞毒性损伤引起的细胞GRP78表达上调是有限的[13]。这一点与本实验结果ERS激动剂TM组GRP78蛋白质表达水平与HH组无明显差异是一致的。长期低氧可以诱发内质网应激,引起GRP78表达上调,TM作为ERS激动剂也可引起GRP78上调,因此低氧与TM双重刺激可能加剧了ERS,其结果超出GRP78上调的上限,使得两者差异不再有统计学意义。实验结果还显示,TM组大鼠CHOP的表达较HH组明显增加(P<0.01)。CHOP是内质网应激中最高可诱导基因之一,原因主要有:发生内质网应激时,解离的IRE1α产生bZIP转录因子,提高CHOP或GADD 153(growth arrest and DNA damage-inducible gene 153)等内质网应激分子表达;内质网跨膜蛋白PERK表达水平增加相应地引起下游转录因子ATF4和CHOP表达上调;ATF6的过表达直接导致下游CHOP的表达上调[14-16]。最终,过度UPR将导致CHOP的大量表达,而CHOP作为转录因子可抑制Bcl-2 (B-cell lymphoma-2)表达,削弱其抗凋亡能力,促进细胞凋亡[17]。CHOP作为细胞核内转录因子,一般情况下蛋白质表达难以检测,本实验利用延长牛奶封闭时间、增加一抗稀释浓度及延长曝光时间等方法达到检测目的。
综上所述,低氧高二氧化碳诱导的肺动脉高压大鼠肺血管重塑可能与肺动脉平滑肌细胞增殖过度及凋亡过少有关;ERS相关因子(JNK、caspase-12和CHOP)参与低氧高二氧化碳性肺动脉高压的调控。因此,我们设想抑制肺动脉高压中ERS相关因子的表达或许可作为治疗肺动脉高压的一个新的有效靶点。

