EPO对高脂喂养小鼠棕色脂肪组织PRDM16、FGF21表达及STAT3磷酸化水平的影响*
张 睿, 陈 璐, 葛俊美, 马根山, 蔡君艳
(东南大学附属中大医院, 江苏 南京 210009)
由肥胖引起的糖尿病等并发症,已成为世界性高发疾病,其数量也在快速增长。哺乳动物的棕色脂肪组织(brown adipose tissue,BAT)能通过增加能量消耗而增强代谢状态,因此可作为治疗糖尿病等代谢综合征的靶点。
促红细胞生成素(erythropoietin,EPO)是一种肾源多肽激素,其作用在于促进骨髓生产红细胞。近年来发现,EPO有调控葡萄糖耐受以及能量代谢的作用[1-4],其机制尚不清楚。BAT释放的成纤维细胞生长因子21(fibroblast growth factor 21,FGF21),能增加肝的胰岛素敏感性并降低血糖水平[5-7]。
已有研究发现,EPO能通过肌肉、肝脏起到拮抗糖尿病的作用[8-10]。本研究以高脂饮食(high fat diet,HFD)喂养的小鼠为模型,腹腔注射EPO后观察动物模型的血糖含量、血浆胰岛素含量和葡萄糖耐量水平的变化,以及BAT中含PR结构域蛋白16(PR domain-containing 16,PRDM16)、磷酸化信号转导与转录激活因子3(phosphorylated signal transducer and activator of transcription 3,p-STAT3)、成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)的mRNA和蛋白质水平的变化,以期为肥胖及其并发症的治疗提供理论依据。
1 材料与方法
1.1 实验动物
20只4周龄的C57BL/6J雄性小鼠(购自北京维通利华实验动物技术有限公司),饲养在12 h光照/12 h黑暗环境中,温度23℃,自由摄食饮水。所有小鼠都给予高脂饲料(HFD,购自北京维通利华实验动物技术有限公司)喂养4周,其56.7%的能量来自于脂肪、23.1%的能量来自于碳水化合物、20%的能量来自于蛋白质。所有HFD饲养小鼠随机分为两组(n=10):HFD-EPO组和HFD-对照组(HFD-Con)。HFD-EPO组腹腔注射200 IU/kg的重组人EPO(Epoetin Alfa购自日本JCR制药公司),HFD-Con组腹腔注射等体积生理盐水。两组动物每周各注射3次,连续注射4周。4周后动物禁食过夜,腹腔注射10%水合氯醛(0.4 ml/kg)麻醉后心脏穿刺取血,4 ℃分离血浆,-80℃保存。迅速分离两组动物的棕色脂肪组织,液氮速冻后置-80℃保存。
1.2 酶法检测血浆葡萄糖水平
采用葡萄糖氧化酶法试剂盒(购自北京普利莱基因技术有限公司),遵循说明书操作,检测血浆葡萄糖水平。
1.3 ELISA检测血浆和肝脏FGF21水平
使用ELISA试剂盒(mouse ELISA kit,Sigma)检测血浆及肝脏FGF21水平。所有操作均遵循说明书执行。
1.4 葡萄糖耐量检测
HFD喂养小鼠腹腔注射EPO4周后,禁食过夜。次日腹腔注射葡萄糖(1.0 g/kg),分别在注射前及注射后30、60、120 min取尾静脉血,检测血糖水平及胰岛素水平。
1.5 实时定量PCR检测小鼠BAT中PRDM16和FGF21 mRNA的表达
使用RNA提取试剂分别提取BAT的总RNA(RNA trip,Trizol,均购自北京普利莱基因技术有限公司)。实时定量PCR采用Go Taq qPCR Master Mix(Promega),20 μl体系按照如下扩增条件操作:95℃ 30 s、95℃ 3 s,30个循环;60℃ 30 s。PRDM16前导链5’-CAGCACGGTGAAGCCATTC,PRDM16滞后链3’-GGCGTGCATCCGCTTGT。FGF21前导链5’-AGATCAGGGAGGATGGAACA,FGF21滞后链3’-TCAAAGTGAGGCGATCCATA。以β-actin为内参。使用MxProMx3000软件进行数据分析。
1.6 Western blot法检测BAT中PRDM16、p-STAT3/STAT3和FGF21蛋白质水平
使用1 mmol/L RIPA组织裂解液提取BAT的总蛋白。SDS-PAGE(10%胶浓度)分离100 μg蛋白质。转膜后,用兔抗小鼠PRDM16多克隆抗体(Abcam,1∶1 000稀释)、兔抗小鼠p-STAT3单克隆抗体(CST,1∶1 000稀释)、兔抗小鼠STAT3单克隆抗体(CST,1∶1 000稀释)、兔抗小鼠FGF21单克隆抗体(Abcam,1∶1 000稀释)以及兔抗GAPDH多克隆抗体(Santa Cruz,1∶5 000稀释)孵育NC膜,4℃过夜。使用相应来源的二抗室温孵育NC膜1h,TBST洗涤5 min×3,显色、曝光。使用Image J软件分别分析PRDM16、p-STAT3/STAT3和FGF21蛋白质条带的灰度值,并与GAPDH的灰度值比较后进行统计。
1.7 统计学处理

2 结果
2.1 两组小鼠体重、血糖和胰岛素水平的比较
腹腔注射EPO 4周后,HFD-EPO组小鼠的体重为(26.76±0.96)g,明显低于HFD-Con组小鼠体重(31.47±1.67)g(P<0.01,图1A)。HFD-EPO组小鼠的空腹血糖为(62.79±8.09)mg/dl,明显低于HFD-Con组小鼠的空腹血糖(91.06±9.86)mg/dl(P<0.01,图1B)。HFD-EPO组小鼠血浆胰岛素水平为(11.8±0.33)μU/ml,与HFD-Con组小鼠血浆胰岛素水平(12.64±0.25) μU/ml无明显差异(P>0.05,图1C)。HFD-EPO组小鼠胰岛素抵抗指数(index of insulin resistance,HOMA-IR)为1.56±0.16,明显低于HFD-Con组小鼠胰岛素抵抗指数2.80±0.13(P<0.01,图1D)。与HFD-Con组比较,HFD-EPO组小鼠体重在实验第一周即呈现明显减少(图1A)。

Fig.1Comparison of body weight, HOMA-IR and the level of blood glucose, plasma insulin after EPO injection for 4 weeks between HFD-Con group and HFD-EPO group
A: Comparison of body weight between HFD-Con group and HFD-EPO group; B: Comparison of blood glucose levels between HFD-Con group and HFD-EPO group; C: Comparison of plasma insulin levels between HFD-Con group and HFD-EPO group; D: Comparison of HOMA-IR between HFD-Con group and HFD-EPO group; EPO: Erythropoietin; HOMA-IR: Homeostasis model assessment of insulin resistance
**P<0.01vsEPO-Con group
2.2 两组小鼠糖耐量水平的比较
腹腔注射EPO 4周后,HFD-EPO组小鼠的血糖水平较HFD-Con组明显降低(P<0.01,图2A)。HFD-Con组与HFD-EPO组小鼠血浆胰岛素水平无明显差异(图2B)。
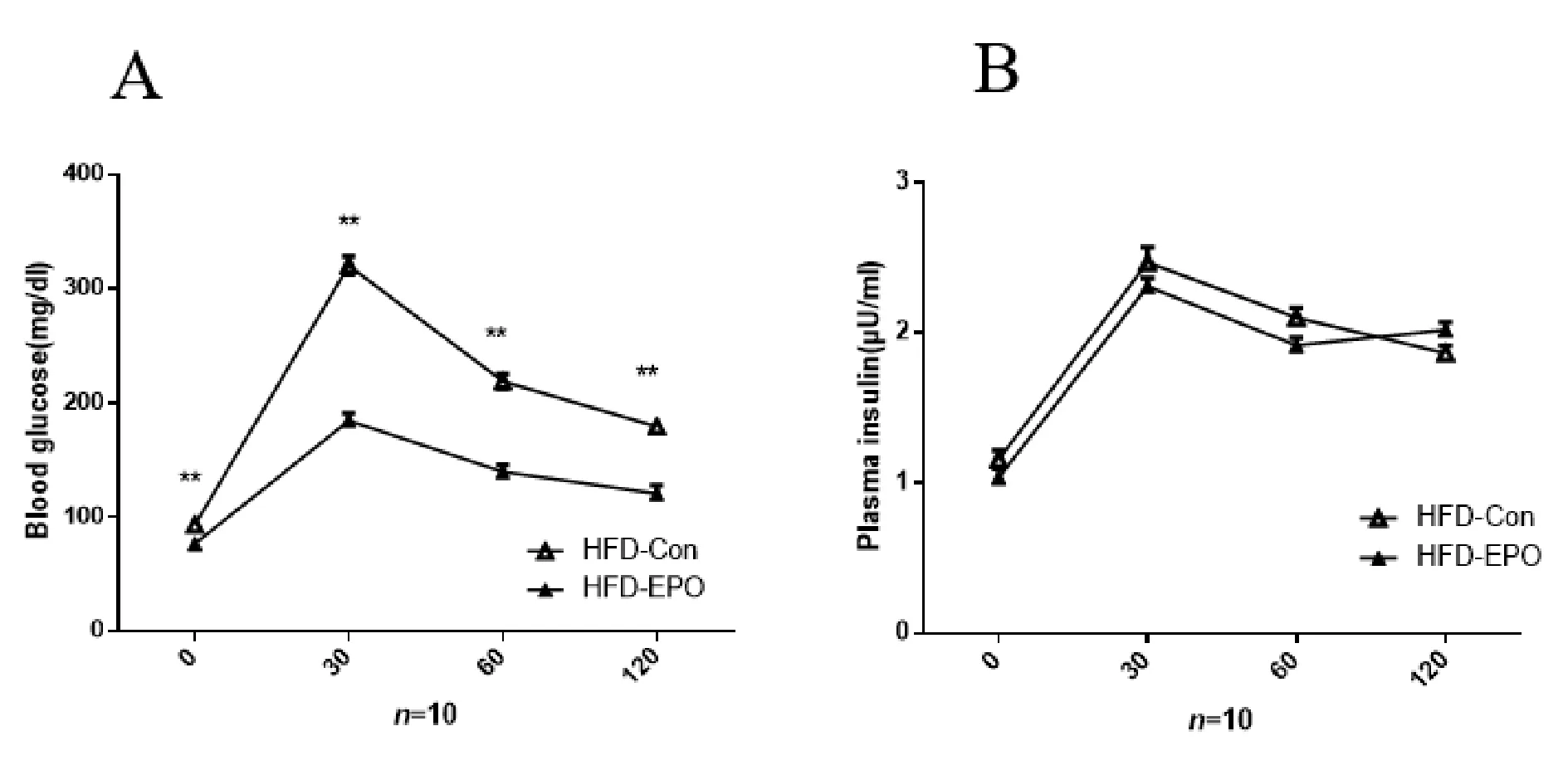

A: Comparison of glucose tolerancebetween HFD-Con group and HFD-EPO group; B: Comparison of plasma insulinlevel between HFD-Con group and HFD-EPO group; EPO: Erythropoietin
**P<0.01vsHFD-Con group
2.3 两组动物棕色脂肪组织PRDM16 mRNA和蛋白质表达的比较
腹腔注射EPO 4周后,HFD-EPO组小鼠BAT质量为(0.150±0.010)g,明显高于HFD-Con组小鼠(0.078±0.031) g(P<0.01,图3A)。HFD-EPO组PRDM16 mRNA相对表达量为2.288±0.063,明显高于HFD-Con组小鼠PRDM16 mRNA的相对表达量(1.903±0.049,P<0.01,图3B)。HFD-EPO组小鼠PRDM16的蛋白质相对表达量为0.2034±0.009,明显高于HFD-Con组小鼠PRDM16蛋白质相对表达量(0.1510±0.008,P<0.01,图3C)。
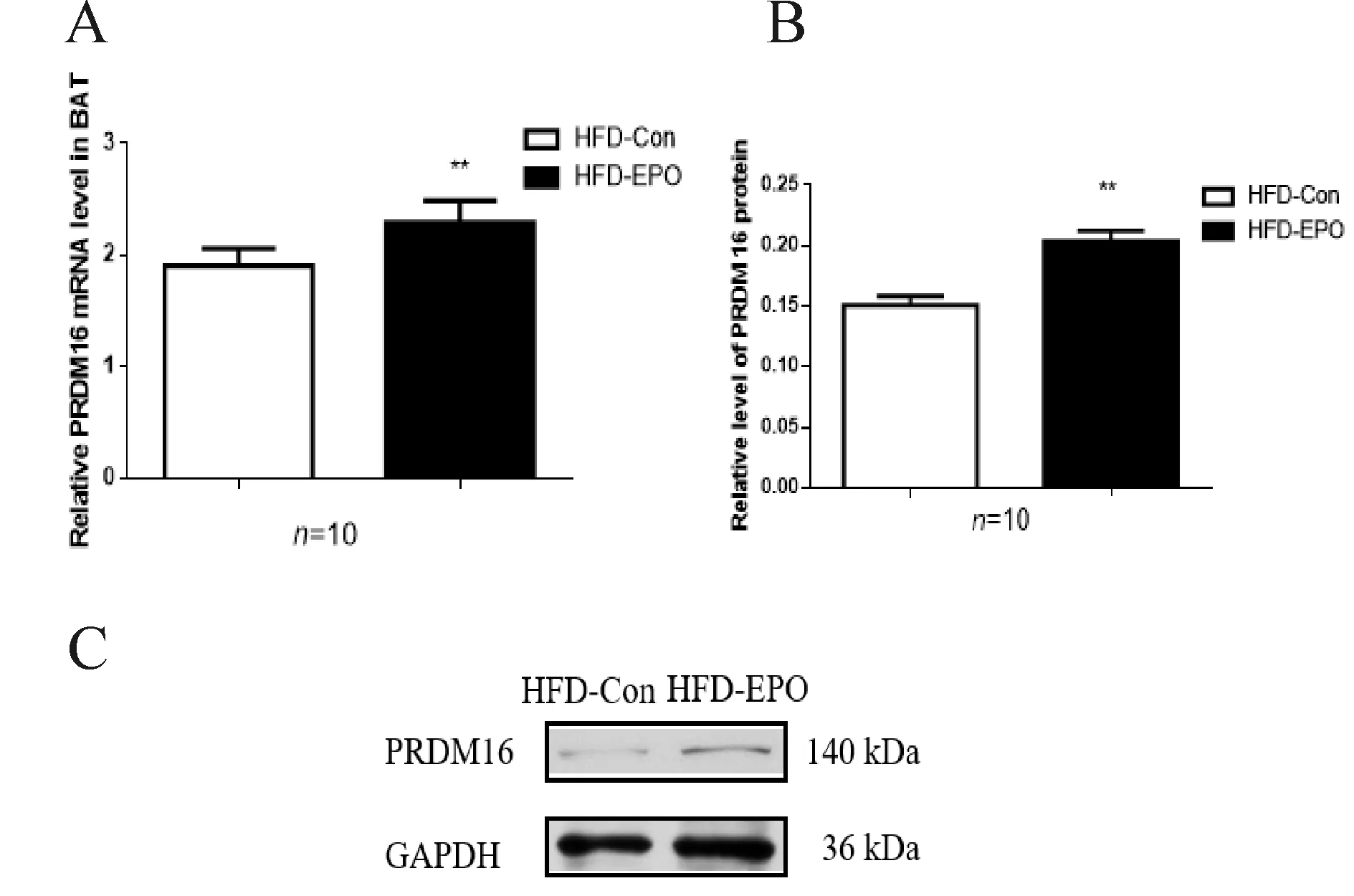
Fig.3Comparison of PRDM16 mRNA and PRDM16 protein expression between HFD-Con group and HFD-EPO group in brown adipose tissue (BAT)
A: Comparison of PRDM16 mRNA expression in BAT between HFD-Con group and HFD-EPO group; B and C: Comparison of PRDM16 protein expression in BAT between HFD-Con group and HFD-EPO group; PRDM16: PR domain-containing 16
**P<0.01vsHFD-Con group
2.4 两组动物棕色脂肪组织p-STAT3蛋白质水平的比较
HFD-EPO组小鼠p-STAT3/STAT3的蛋白质水平为1.300±0.042,明显高于HFD-Con组小鼠p-STAT3/STAT3蛋白质水平(90.920±0.032,P<0.01,图4A,4B)。

Fig.4Comparison of p-STAT3/STAT3 level between HFD-Con group and HFD-EPO group
p-STAT3: phosphorylated signal transducer and activator of transcription 3
**P<0.01vsHFD-Con group
2.5 两组动物棕色脂肪组织FGF21 mRNA和蛋白质表达的比较
腹腔注射EPO4周后,HFD-EPO组小鼠FGF21mRNA水平为0.919±0.029,明显高于HFD-Con组小鼠FGF21 mRNA水平(0.593±0.025,P<0.01,图5A)。HFD-EPO组小鼠FGF21蛋白质表达量为0.560±0.012,明显高于HFD-Con组小鼠FGF21蛋白质表达量(0.314±0.025,P<0.01,图5B,5C)。
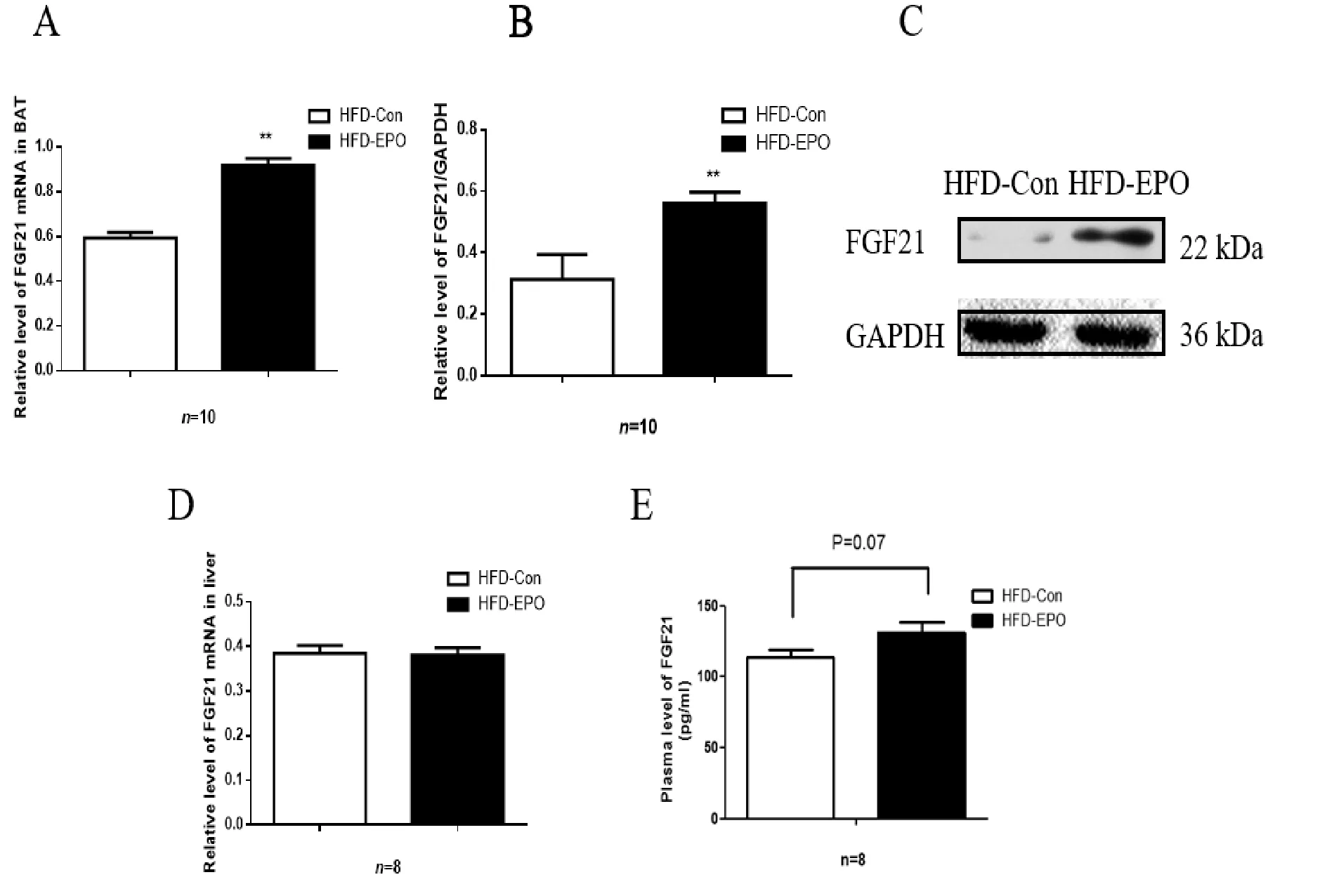
Fig.5Comparison of FGF21 mRNA and protein levelin BAT, liver and plasma between HFD-Con group and HFD-EPO group
A: Comparison of FGF21 mRNA expression in BAT between HFD-Con group and HFD-EPO group; B and C: Comparison of FGF21 protein expression in BAT between HFD-Con group and HFD-EPO group; D: Comparison of FGF21 mRNA expression in liver between HFD-Con group and HFD-EPO group; E: Comparison of FGF21 level in plasma between HFD-Con group and HFD-EPO group; FGF21: Fibroblast growth factor 21
**P<0.01vsHFD-Con group
3 讨论
长期的能量过量摄入会导致肥胖及相关代谢性疾病的产生,如何治疗肥胖并多角度阐述肥胖发生的机制,一直是近年来研究的热点[11-14]。BAT通过甘油、脂肪酸以及葡萄糖为机体供能[15],近年来BAT作为对抗肥胖以及2型糖尿病的靶点受到越来越多的关注。本研究以高脂饲料喂养的小鼠为模型,与对照组比较,小鼠腹腔注射EPO 4周后体重显著减少、血糖含量显著下降、糖耐量水平显著改善,但血浆胰岛素水平却无明显变化;BAT中PRDM16、STAT3磷酸化水平、FGF21 mRNA以及蛋白质的表达均显著升高,说明BAT有可能作为EPO的靶点,其细胞内的PRDM16、p-STAT3、FGF21的表达变化参与了模型小鼠糖代谢状态的改善。
既往研究发现,腹腔注射EPO能改善高脂喂养动物模型的代谢状态。本研究中EPO注射剂量低于以往研究用的注射剂量[3,16,17],但EPO对高脂饮食诱导的高脂喂养动物模型依旧有抵抗肥胖及改善糖尿病状况的效应。同时本研究发现,与HFD-Con组比较,HFD-EPO组小鼠的腹腔注射糖耐量实验(IPGTT)有明显改善,这一改善并未影响血浆胰岛素水平。据此推测,在高脂饮食诱导的小鼠模型中,EPO的作用可能并未通过改变血浆胰岛素水平而影响血糖水平,BAT可能在EPO改善血糖平衡中起着重要作用。
PRDM16是BAT中驱动棕色脂肪细胞分化的关键转录因子,其作用在于驱动肌源性脂肪细胞前体转化为棕色脂肪细胞。研究发现,在棕色脂肪细胞脂质生成的过程中,PRDM16不仅调控棕色脂肪细胞脂质的生成,并且保证着棕色脂肪细胞的同质性;缺失PRDM16的棕色脂肪前体细胞导致啮齿类动物棕色脂肪组织的含量减少,同时缺失PRDM16的棕色脂肪细胞表现出产热相关调控基因表达的减少[18]。以上结果均证实,PRDM16对脂肪细胞脂质的合成及功能起着至关重要的作用。本研究发现,相对于HFD-Con组,HFD-EPO组小鼠BAT中PRDM16在mRNA水平与蛋白质水平的表达均显著增加,推测腹腔注射EPO与BAT含量增加有关。
真核细胞中丰富的STAT信号通路与细胞的生长、存活、分化、发展有着密切关系[19-20]。研究证实,绑定于PRDM16的STAT3能够通过改变自身的磷酸化状态而稳定BAT中的PRDM16[20]。本研究中,与HFD-Con组相比,HFD-EPO组小鼠BAT中p-STAT3/STAT3的比率显著增加。
FGF21是一种肝脏分泌的代谢调控子的激素,是内分泌FGF1家族中的一员,其作用与改善胰岛素抵抗及葡萄糖代谢有关。本研究发现,BAT也能合成FGF21。本研究中,与对照组相比,腹腔注射EPO小鼠BAT中FGF21 mRNA水平和蛋白质水平均升高,血浆FGF21水平升高,而肝脏中FGF21水平并无明显改变。以上结果说明,EPO对血糖的调控作用有可能来自于BAT活化后FGF21的合成并分泌。
综上所述,本实验用高脂饮食诱导的小鼠为模型,腹腔注射EPO 4周后发现:HFD-EPO组小鼠的体重显著降低,血糖水平、糖耐量水平均有显著改善,但血浆胰岛素含量无显著变化;BAT中PRDM16、p-STAT、FGF21的mRNA、蛋白质表达水平显著增加,三者的变化可能与HFD-EPO小鼠血糖降低有关,为揭示肥胖患者的糖尿病发病机制提供了依据。

