四逆散对PTSD及睡眠障碍大鼠海马CA1/CA3区神经元动作电位的影响*
牛江涛, 张泽国, 曹 瑞, 司昕蕾, 边甜甜, 李越峰△
(1. 甘肃中医药大学药学院, 2. 甘肃省中药质量与标准研究重点实验室, 兰州 730000)
机体经受异乎寻常的心理及精神创伤后,常伴有延迟性、继发性的精神障碍,这类创伤多危及生命,给人类带来惊恐。医学上将此类病症定义为创伤后应激障碍,即PTSD(post-traumatic stress disorder)[1]。流行病学统计表明,PTSD的发病率在逐渐上升[2-3]。睡眠障碍(somnipathy)指机体在睡眠-觉醒的过程中出现的一系列功能性障碍,PTSD的严重程度与自身睡眠障碍密切联系[4]。短期及长期的PTSD均可引发抑郁、焦虑等情志类疾病,在给人们带来痛苦的同时极大地影响生活质量[5]。研究发现,PTSD的发病机制可能与海马区功能和结构的异常改变相关[6]。“肝疏泄、调情志”可能在机体急慢性应激障碍中起关键性作用[7]。四逆散是调肝方药基础方[8]。高等动物神经系统各种功能的发挥主要以神经电信号的发放和活动形式为主,而大脑的这种特异神经电信号活动是形成不同精神、心理状态的主要原因[9]。在体多通道技术,是一种采用电生理技术进行的细胞外记录的先进方法,应用这一技术可以同步记录相应脑区大量的神经元生物电活动,通过特征量提取,可分析神经元动作电位发放情况及其在时间和空间上的联系[10-11]。由于神经元网络活动的基本表现形式为动作电位[12],所以本实验从神经电生理角度研究四逆散对创伤后应激障碍大鼠海马CA1/CA3区神经元动作电位的影响,为四逆散干预PTSD的药效及机理研究提供实验依据。
1 材料与方法
1.1 动物
本实验选用甘肃中医药大学科研实验中心提供的健康SD大鼠,雄性,体重(180±20) g,合格证号:SCXK(甘)2015-0002。
1.2 药品
四逆散(柴胡6 g,白芍9 g,枳实6 g,甘草6 g),生药购于惠仁堂兰州二十一分店,由甘肃中医药大学中药鉴定教研室王明伟副教授鉴定。盐酸帕罗西汀片,浙江尖峰药业有限公司,批号150104,规格(每片20 mg),国药准字H20040533。
1.3 仪器
Cerebus多通道数据采集系统,美国Blackrock Microsystem Inc; SN-1脑立体定位仪,深圳市瑞沃德生命科技有限公司;自制的幽闭电击箱。
1.4 分组与给药
50只实验大鼠随机分为5组(n=10):即空白组、生理盐水组、模型组、四逆散组及帕罗西汀组。空白组和生理盐水组正常饲养,其他3组用幽闭电击法复制PTSD模型,生理盐水组每天灌胃给与生理盐水10 ml/kg,模型组于造模前1 h灌胃生理盐水10 ml/kg,帕罗西汀组和四逆散组分别于造模前1 h灌胃盐酸帕罗西汀4.2 mg/kg和四逆散2.41 g/kg进行处理,每天1次,连续7 d,造模和干预同时进行。
1.5 模型复制
电击模型是PTSD实验研究中最常用的动物模型,属公认的模型之一[13]。而用“电击+幽闭”刺激,可使大鼠活动受限、焦虑不安,电击时因惊悚而撕咬、惨叫,模拟PTSD的效果较好[14],且有研究表明[15]短时间(3 d)内可制备出行为学改变比较显著、记忆力受损严重的PTSD实验大鼠模型。结合文献[16-17]及预实验结果,确定利用幽闭电击法复制PTSD模型。先将造模箱清洗干净,并用75%酒精擦拭祛除箱内异味,将箱体置于垫板上方,将造模箱电栅栏连接DC电源,但不通电。利用随机数字表抓取大鼠进行电击。将大鼠放入造模箱内,每只造模箱内每次仅放入1只大鼠,盖上盖板并用重物压紧,营造黑暗幽闭的禁锢环境,并防止动物逃逸。接通电源,调整至电压60 V、电流8 mA,对大鼠足底施以不可逃避的电刺激,每次电刺激10 s后关闭电源,刺激时间间隔随机,总计30次。从造模箱中取出大鼠,依据组别放回笼中饲养,记录造模时间。每天早、晚各电击一次,每日的两次电击间隔4~8 h。
1.6 微电极阵列检测及方法
使用10%水合氯醛麻醉大鼠后,将其固定在脑立体定位仪上,充分暴露颅骨。参考《大鼠脑立体定位图谱》,在SD大鼠头颅人字缝两侧标记海马CA1区(Bregma P:3.3,L:2.0,H:2.5 mm),CA3区(Bregma P:3.3,L:2.5,H:4.0 mm);用小型电钻钻开颅骨充分暴露硬脑膜,用镊子剥开硬脑膜,以16通道镍铬合金微丝电极迅速刺破软脑膜,缓慢进入海马CA1和CA3区,深度3.0 mm~4.0 mm。打开记录系统,待较多通道出现神经元放电、动作电位丰富且稳定后,记录180 s动作电位实时数据[18]。用NeuroExplorer分析采集的数据。
1.7 ISI时间序列采集方法
峰电位区间(interspike interval,ISI)是相邻两次动作电位波峰出现的周期时间。用Neuro Explorer分析软件导出大鼠海马区动作电位发放脉冲间隔数据,获得大鼠海马180 s内动作电位的峰—峰间期散点图。该图以时间离散点为横坐标,以神经元发放动作电位的脉冲间隔(即峰—峰间期)为纵坐标,图中每个点代表相应时间点发放动作电位的脉冲间隔[19]。
1.8 统计学方法

2 结果
2.1 各组大鼠海马CA1区峰峰间期随时间的变化
由图1、2可知,空白组动作电位间隔序列在0.0~0.3 s为主要区间,动作电位发放多为发散状,且脉冲较密集。

Fig.1Blank group

Fig.2Saline group
由图3可知,模型组动作电位间隔序列在0.0~3.0 s为主要区间,动作电位发放脉冲较稀少,呈簇状。
由图4、5可知,帕罗西汀组、四逆散组动作电位间隔序列在0.0~1.0 s为主要区间,动作电位发放脉冲稀少,呈发散状。
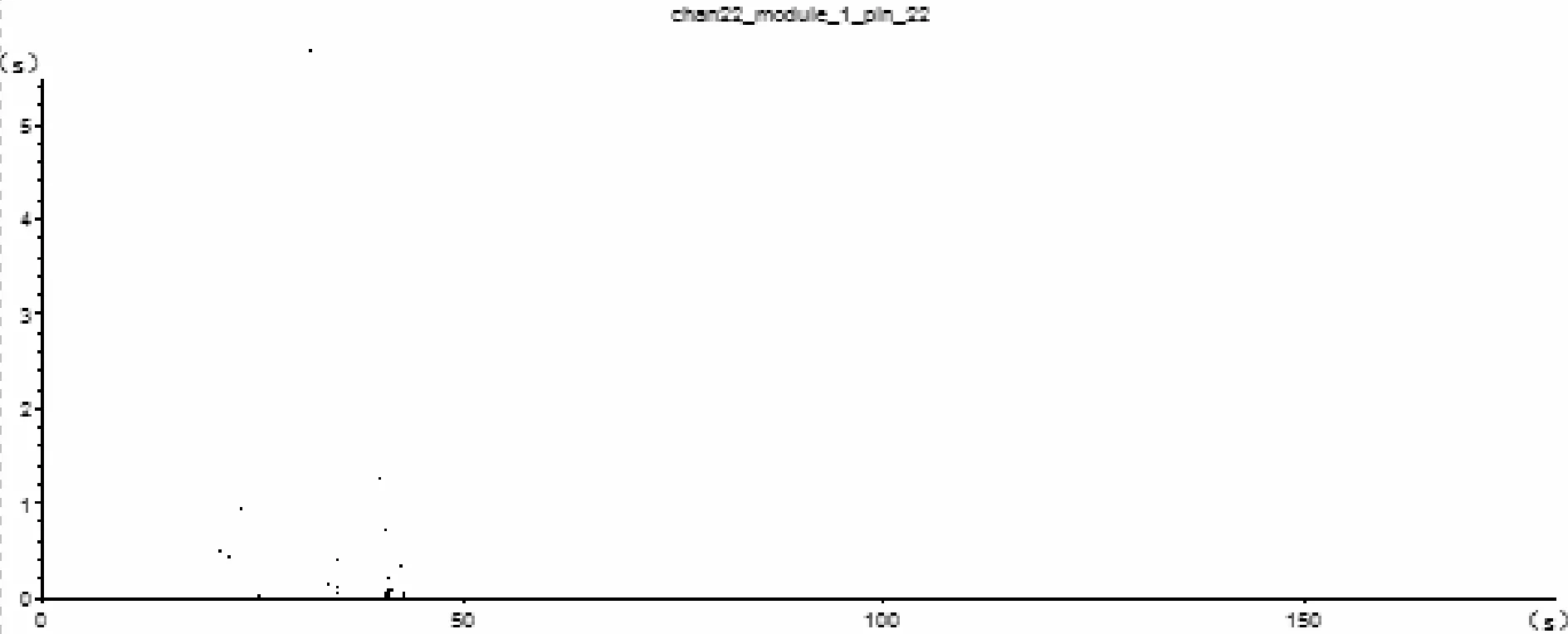
Fig.3Model group

Fig.4Paroxetine group

Fig.5Sinisan group
2.2 各组大鼠海马CA3区峰峰间期随时间的变化
由图6、7可知,空白组动作电位间隔序列以0.0~0.3 s为主要区间,动作电位发放脉冲密集,呈发散状。
由图8可知,模型组动作电位间隔序列以0.0~3.0 s为主要区间,动作电位发放脉冲稀少,呈发散状。

Fig.6Blank group

Fig.7Saline group

Fig.8Model group
由图9、10可知,帕罗西汀组、四逆散组动作电位间隔序列以0.0~1.0s为主要区间,动作电位发放脉冲稀少,呈发散状。
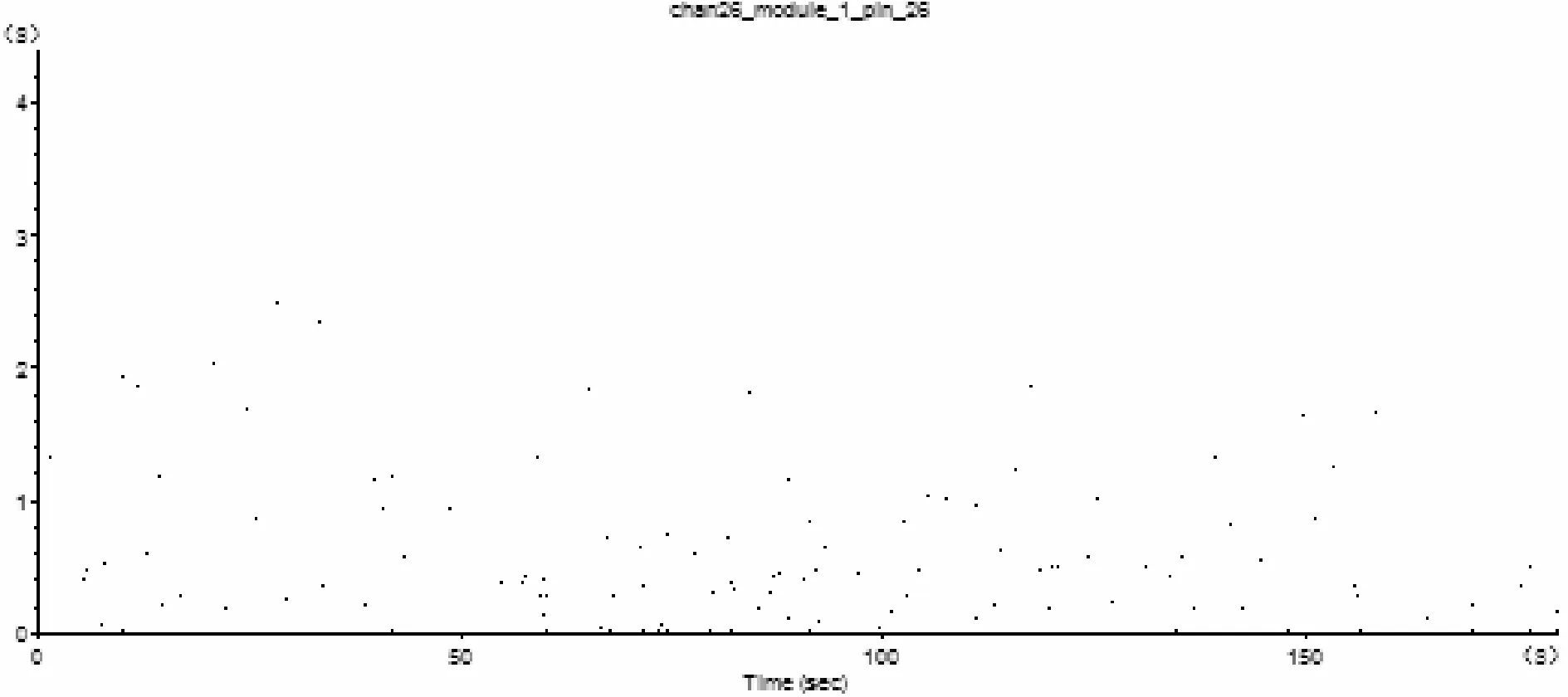
Fig.9Paroxetine group

Fig.10Sinisan group
2.3 各组大鼠海马CA1/CA3区平均峰电位发放速率
通过图1~11和表1对大鼠海马CA1、CA3区神经元峰电位发放情况的研究可知:与空白组相比,生理盐水组大鼠海马区单位时间峰电位发放速率无显著变化,差异无统计学意义(P>0.05),提示灌胃刺激不会对大鼠海马脑区神经元峰电位发放产生影响。与生理盐水组比较,模型组大鼠海马区单位时间峰电位发放速率明显降低(P<0.01),提示PTSD模型复制条件的施加可明显抑制大鼠海马区单位时间峰电位发放。与模型组比较,帕罗西汀、四逆散两组大鼠海马区单位时间峰电位发放速率明显升高,差异具有统计学意义(P<0.01),提示四逆散以及帕罗西汀可明显促进PTSD大鼠海马区单位时间峰电位发放。与帕罗西汀组比较,四逆散组大鼠海马区单位时间峰电位发放率无显著性变化(P>0.05)。
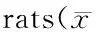

GroupHippocampal CA1 area(times/s)Hippocampal CA3 area(times/s)Blank6.54±2.787.00±2.90Saline5.58±2.245.89±2.44Model1.24±0.57**1.36±0.52**Paroxetine4.23±1.42##5.17±2.38##Sinisan5.61±2.52##4.88±2.67##
**P<0.01vssaline group;##P<0.01vsmodel group

**P<0.01vssaline group;##P<0.01vsmodel group
3 讨论
动作电位发放的脉冲间隔(峰—峰间期)是神经元信号编码的重要表达形式之一[20]。峰—峰间期散点图可直观反映动作电位间隔序列随时间变化的分布特征,从而分析神经元动作电位发放模式随时间的变化规律。由上述结果可见,与空白组比较,生理盐水组大鼠海马CA1/CA3区单位时间峰电位发放率无明显变化,提示灌胃刺激对大鼠模型影响不明显。与生理盐水组比较,模型组大鼠海马CA1/CA3区平均峰电位发放速率明显降低,提示幽闭电击对大鼠海马区单位时间平均峰电位发放速率的抑制作用明显。与模型组相比,四逆散组、帕罗西汀组大鼠海马CA1/CA3区单位时间平均峰电位发放速率显著升高,提示帕罗西汀、四逆散均对PTSD及睡眠障碍有明显的正向调节作用。以上结果提示,幽闭电击刺激对大鼠海马CA1/CA3区峰电位发放速率有明显的抑制作用,严重影响海马区神经元放电活动,而帕罗西汀、四逆散可明显改善PTSD大鼠海马CA1/CA3区神经元放电活动。
神经信息的传递主要由神经元通过动作电位的传导而实现,动作电位内含有丰富的神经信号。因此,基于神经信号的动态分析可作为探究脑功能稳态的基础。机体在应对强烈的应激损害后,中枢神经的可塑性变化明显,特别是海马、杏仁核、中缝核等处出现神经可塑性的异常改变[21]。实验组透射电镜实验观察的结果也表明,PTSD及睡眠障碍大鼠海马CA1/CA3区神经元的超微结构发生了异常改变。ISI时间序列说明神经元脉冲的时间间隔。研究发现,电刺激后大鼠海马CA1/CA3区神经元发放脉冲间隔明显延长,且峰电位发放率也显著降低,提示电击刺激抑制了大鼠海马CA1/CA3区神经元脉冲的发放,且延长了时间间隔,模型组大鼠海马CA1/CA3区神经元动作电位发放频率的显著性降低,可作为病变的一种在体的特征性改变。而四逆散及帕罗西汀能缩短脉冲发放时间,对PTSD大鼠海马CA1/CA3区神经元动作电位的发放有明显的改善作用。
——从一道浙江选考生物学试题谈起

