神经生长因子及其低亲和力受体诱导肝星状细胞凋亡的初步研究
朱海燕 吴雄健 曾 斌 谢志军
赣南医学院第一附属医院消化内科,江西赣州 341000
肝星状细胞(hepatic stellate cell,HSC)的活化是慢性肝病进展的中心环节[1-2],人及大鼠的HSC都可表达低亲和力受体(p75 neurotrophin receptor,p75NTR),当神经生长因子(nerve growth factor,NGF)与p75NTR结合时可诱导细胞凋亡[3]。本研究主要探讨NGF及p75NTR影响HSC增殖及凋亡的可能作用机制,寻找防治肝纤维化的新途径。
1 材料与方法
1.1 材料
NGF及p75NTR购自美国RD公司;AnnexinⅤ-FITC购自美国罗氏公司;P53 and Caspase-3抗体购自武汉博士德公司;S-P超敏试剂盒(鼠/兔)及DAB显色试剂盒购自福州迈新生物技术开发有限公司;DMEM培养液及胎牛血清购至美国Gibco公司。HSC系HSC-T6由上海中医药大学徐列明教授提供,系SV40转染后的大鼠HSC,具有活化HSC表型。
1.2 方法
1.2.1 HSC-T6的培养与传代 使用DMEM培养液(含100 U/ml青霉素,100 U/ml链霉素,10%胎牛血清)进行培养。设定培养温度37℃,CO2浓度5%,湿度饱和。于隔天进行一次换液。待细胞密度达80%~90%,以0.02%EDTA和0.25%胰蛋白酶分散细胞,按1∶4传代。将其分为对照组、NGF组和NGF+p75NTR组,对照组采用0 ng/ml NGF+0 ng/ml p75NTR,NGF组采用100 ng/ml NGF,NGF+p75NTR 组 采 用 100 ng/ml NGF+100 ng/ml p75NTR。
1.2.2 NGF及p75NTR对HSC-T6增殖的作用 取对数生长期细胞,细胞悬浮液浓度调至7×104/ml,接种于96孔板中,每孔200 μl,24 h后弃上清,加入各浓度NGF,三组各设4个复孔,培养24 h,而后将预配的XTT比色液50 μl分别加入各孔,置于培养箱中再孵育4 h。使用酶标仪测定吸光值(OD值),设定主波长570 nm,参考波长690 nm。
1.2.3 NGF及P75NTR对HSC-T6凋亡的影响 取对数生长期细胞,细胞悬液浓度调至5×105/ml,接种于T-25培养瓶中,24 h后按照分组各培养24 h,收取所有细胞,取1×106洗涤细胞,加入100 μl的结合缓冲液,再加AnnexinⅤ-FITC染液和碘化丙啶(PI)染液各2 μl,在室温下避光染色30 min,然后再添加结合缓冲液300 μl,以流式细胞仪检测HSC凋亡。
1.2.4 P53及Caspase-3表达的测定 取对数生长期细胞,细胞悬液浓度调配至7×104/ml,滴于预先处理好的置于六孔板内的盖玻片上,每孔0.4 ml,孵育24 h,分组后继续培养24 h,然后以4%多聚甲醛固定细胞,分别使用P53及Caspase-3一抗,应用SP法进行免疫细胞化学染色,DAB显色,苏木精复染,二甲苯透明,中性树脂封片,在光学显微镜下胞膜或胞浆或胞核呈棕黄色的为阳性细胞。每张切片在400×光镜视野下共取10个视野,计数各自阳性细胞所占比例。以各阳性细胞的百分数来表示相应蛋白的阳性表达率。
1.3 统计学方法
采用SPSS 16.0统计学软件对数据进行分析,计量资料以均数±标准差(±s)表示,多组数据间的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖情况比较
各组与HSC-T6作用24h后,对照组OD值为0.73±0.01,高于NGF组的0.65±0.03及NGF+p75NTR组的0.40±0.04,差异有统计学意义(P<0.05);NGF 组与NGF+p75NTR组对HSC的增殖抑制作用比较,差异有统计学意义(P<0.05)。
2.2 各组细胞凋亡情况比较
各组与HSC-T6作用24 h后,流式细胞术检测结果显示,对照组凋亡率[(6.88±1.35)%]低于 NGF 组和 NGF+p75NTR 组,差异有统计学意义(P<0.05);NGF+p75NTR 组的凋亡率为(37.69±2.30)%,较 NGF 组凋亡率[(26.36±8.51)%]明显升高,差异有统计学意义(P<0.05)(图 1)。
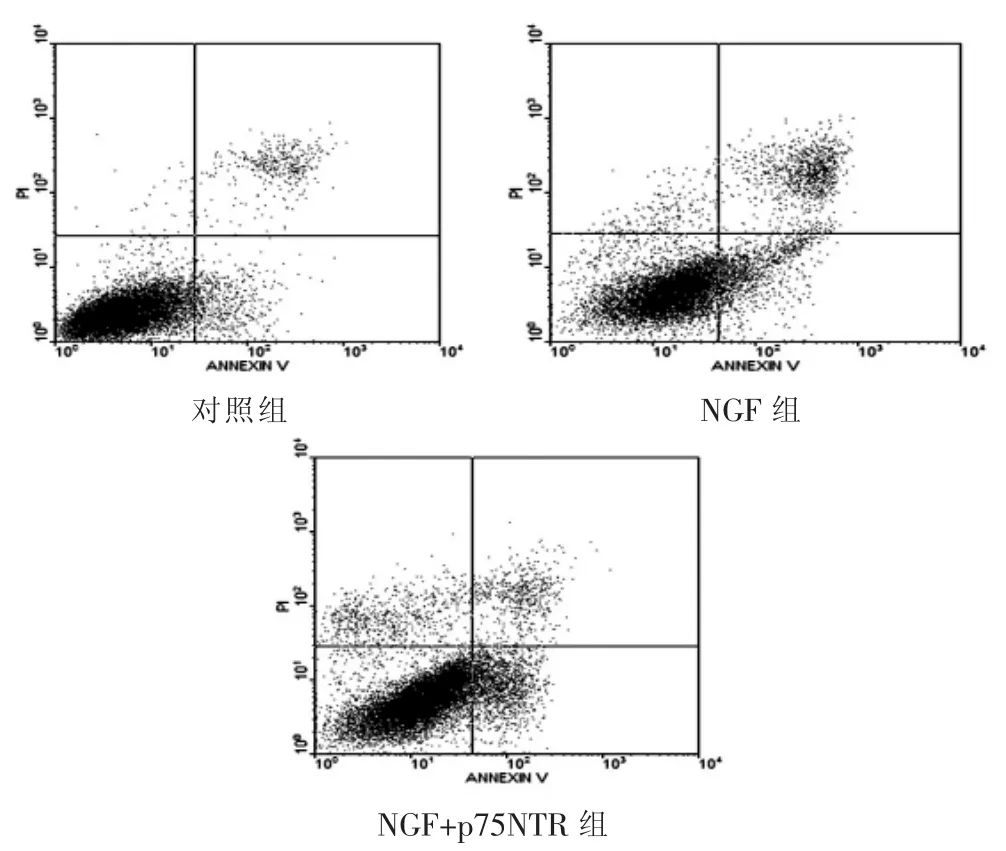
图1 NGF及p75NTR诱导肝星状细胞凋亡的流式细胞术观察
2.3 P53及Caspase-3蛋白的表达的变化
各组与HSC-T6作用24 h后,NGF组和NGF+p75NTR组的P53、Caspase-3表达与对照组比较有明显升高,差异有统计学意义(P<0.05),其中NGF+p75NTR组升高较NGF组明显,差异 有统计学意义(P<0.05)(表1,图 2~图 4)。

表1 NGF及p75NTR处理HSC后Caspase-3、P53表达阳性细胞率的比较(%)
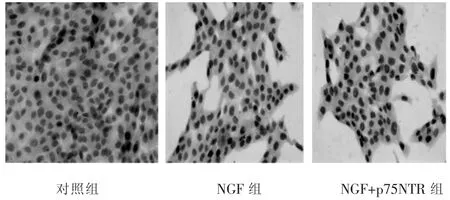
图2 P53细胞免疫化学染色结果(S-P法,400×)
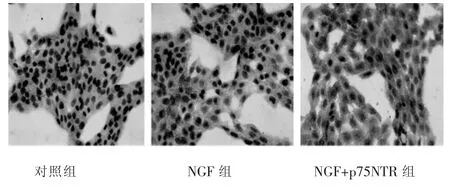
图3 Caspase-3细胞免疫化学染色结果(S-P法,400×)
图4 空白对照组(S-P法,400×)
3 讨论
肝纤维化是肝硬化的早期病理改变和必经阶段,是由各种致病因素导致肝脏慢性损伤。目前的研究结果认为,各种致病因素损伤肝细胞后,Kupffer细胞被激活,分泌出多种细胞因子,共同作用于HSC,最终导致肝纤维化[4-6]。HSC的活化和增殖是肝纤维化发生、发展进程中的一个关键环节。活化HSC已成为防治肝纤维化的主要靶细胞之一,诱导活化HSC凋亡是防治肝纤维化的一个重要策略[7-9]。
NGF不仅可诱导骨髓间充质干细胞向肝细胞分化,还可阻断四氯化碳诱导的小鼠肝纤维化,减轻肝组织炎症[10-11],NGF需通过p75NTR介导才可诱导细胞凋亡[12]。p75NTR介导的凋亡机制与多种细胞因子、激酶有关,其中丝裂原相关的蛋白激酶(MAPK)、半胱天冬酶(Caspase)等作用重要。研究发现肝脏受损的情况下肝细胞可表达NGF,用重组体NGF培养HSC,细胞凋亡明显增多,且具有剂量依赖性,该作用可能通过调节NF-κB活性及PI3K/AKT信号通路而实现[13-15]。Caspase-3是多种凋亡途径的共同下游效应分子,常被作为研究细胞凋亡的关键分子[16]。在P53缺乏时,肝损伤产生更少的衰老细胞,并相应增加了HSCs的激活、细胞外基质沉积和间质纤维化[17]。作者前期研究结果也显示,经NGF作用的大鼠HSC,可抑制细胞增殖、诱导细胞凋亡及抑制HSC合成Ⅰ、Ⅲ型胶原[18-19]。NGF诱导细胞凋亡可能与使凋亡相关基因Caspase-3、P53表达上调,Bcl-2表达下调有关[20]。NGF联合p75NTR的作用特点为针对不同靶细胞可能分别或共同发挥两种相反的作用,诱导凋亡或促进存活。在既往研究中,多为分别观察HSC中NGF或p75NTR的表达改变,有关研究结果甚至有相互矛盾之处,多认为NGF或p75NTR对HSC具有诱导凋亡的作用。本研究在既往研究基础上,加入p75NTR及NGF共同作用于HSC,结果显示NGF+p75NTR组相较单纯NGF组对HSC的增殖抑制及诱导凋亡作用更加明显,可进一步增加凋亡相关蛋白Caspase-3、P53的表达,提示NGF与其p75NTR对于HSC的增殖抑制及诱导凋亡具有协同作用,NGF可能通过p75NTR从而诱导HSC凋亡及抑制其增殖,机制可能与调节Caspase-3、P53的表达有关。
目前关于NGF如何诱导HSC凋亡机制研究较少,本研究结果希望对今后进一步研究NGF作用于HSC的相关分子机制提供前期实验基础,为防治肝硬化及肝纤维化提供新的路径。

